根用芥菜子叶和下胚轴离体再生体系的建立
2021-01-11周玉丽顾安乐钱海珍杨磊舒英杰
周玉丽, 顾安乐, 李 媛, 许 涛, 钱海珍, 杨磊, 舒英杰*
(1.安徽科技学院 农学院, 安徽 凤阳 233100;2.安徽瑞成福田农业科技有限公司,安徽 合肥 230000;3.安徽皖北老家农业科技有限公司,安徽 临泉 236400)
根用芥菜(Brassicajunceavar. megarrhiza Tsen et Lee)原产于我国,又名辣疙瘩、大头芥等,是芥菜以肉质根为食用器官的一个变种[1-2]。芥菜营养丰富,富含VC、矿物质、微量元素、糖类及蛋白质等[3],芥菜具有生津开胃、下气消食、利尿除湿、温脾暖胃,清热解毒、抗菌消肿等功效[4]。近年来随着农业产业结构的调整和地方特色农业产业的发展,根用芥菜已成为安徽阜阳及周边地区新兴的特色产业,“碗北老家”品牌的芥菜丝深受消费者青睐,远销苏浙沪及长三角地区,为当地脱贫致富和乡村振兴带来新的经济增长点。
根用芥菜为异花授粉植物,由于连年种植会发生生物学混杂和品种退化现象,而且容易出现黑心病,严重制约了当地根用芥菜产业的可持续发展。采用离体培养的方法生产脱毒苗是克服品种退化的有效方法之一,崔慧琳等[5]选取结球甘蓝子叶为外植体,比较了不同材料具柄子叶等材料的再生频率差异,结果显示这种十字花科植物其子叶再生频率较高,可以作为遗传转化受体。对叶用芥菜或茎用芥菜[6-7]做了较多的研究,但由于基因型差异,关于根用芥菜子叶节和下胚轴再生体系的研究尚未见报道。本研究采用正交试验,以根用芥菜子叶及下胚轴为外植体,研究不同浓度植物生长调节剂组合和不同光照条件培养对不定芽诱导率的影响,以期进一步提高根用芥菜子叶和下胚轴再生率,建立简单快速高效的根用芥菜离体再生体系,为根用芥菜脱毒苗生产提供技术支撑,并为根用芥菜遗传转化奠定基础。
1 材料与方法
1.1 试验材料
本试验所用根用芥菜为提纯后的安徽阜阳临泉县花叶地方品种。
1.2 试验方法
1.2.1 根用芥菜子叶和下胚轴的获得 挑选籽粒饱满的根用芥菜种子,流水30 min清洗后置超净台上,用医用酒精(75%)消毒30 s,无菌水冲洗数次,而后在5%的NaClO溶液中浸泡8~10 min,无菌水冲洗5~6次,将种子平铺在滤纸上,将晾干的种子接种于MS培养基中,接种后5~7 d后获得无菌苗备用。
1.2.2 培养基的筛选 愈伤组织诱导和分化培养基:MS培养基附加乙烯抑制剂AgNO3(0.0、3.0、5.0 mg/L),植物生长调节剂为6-BA(1.0、3.0、5.0 mg/L)和NAA(0、0.2、0.5 mg/L)组合,依此设计三因素三水平正交实验,按L9(34)正交设计表,共设置9个处理。
不定芽增殖培养基:MS培养基附加植物生长调节剂6-BA(1、2 mg/L)、NAA(0.1 mg/L)、IBA(0.1 mg/L)、IAA(0.2 mg/L)组合。
生根培养基:MS培养基分别附加植物生长调节剂IBA(0.1、0.2 mg/L)、NAA(0.1、0.2 mg/L)、IAA(0.1、0.5 mg/L)。
1.2.3 愈伤组织诱导和不定芽分化 种子发芽7 d后,选取长势一致的无菌苗,在超净工作台上分别切取子叶(带叶柄,叶柄长2~3 mm)和下胚轴(长度约3~4 mm)作为外植体,均平放接种于加有不同质量浓度植物生长调节剂的MS培养基中,每瓶接种6个外植体,每处理7瓶。培养20 d统计愈伤组织诱导率,培养30 d后统计不定芽的生长情况并计算诱导率。
1.2.3.1 不同光照预处理 切取子叶和下胚轴外植体平放接种于最优配方培养基中,每瓶接种8个外植体,每处理8瓶。设3种光照预培养条件,光照强度分别为2 000~2 500 lx、1 000~1 500 lx和暗培养条件。预培养10 d后转入的正常光照条件下培养,20 d后调查愈伤组织生长状况和不定芽分化状况。
1.2.3.2 不同苗龄对外植体预培养 接种于MS培养基的芥菜种子,分别以5、7、9 d的苗龄截取其下胚轴接种采用1.2.3中筛选的最佳配方的培养基中,通过观察外植体愈伤组织诱导和分化情况选出最适宜诱导分化的外植体苗龄。
1.2.3.3 不定芽增殖 切取诱导的不定芽,接种到添加不同浓度植物生长调剂(6-BA、NAA、IBA和IAA)组合的MS培养基上诱导丛生芽,每处理5瓶,每瓶接3个不定芽,接种25 d后观察生长情况并统计数据。
1.2.4 不定芽生根及移栽驯化 将不定芽分别接种于生根培养基上诱导生根,每瓶1个外植体,每处理12瓶,培养20 d后观察生根情况并计算生根率,具体见表6。将生根幼苗开瓶炼苗2~3 d,移栽至花盆中培养10~15 d后进行正常的栽培管理。
1.2.5 培养条件设定 试验以MS为基本培养基,调节pH值5.8~6.0,光照2 000~2 500 lx(不同光照预处理时,光照强度分别为2 000~2 500 lx(CK)、1 000~1 500 lx和暗培养条件),培养温度(25±2) ℃,14 h/d,相对湿度60%左右。
2 结果与分析
2.1 植物生长调节剂种类及质量浓度配比对根用芥菜不定芽诱导的影响
2.1.1 对子叶不定芽诱导的影响 由图1可得:接种3 d后外植体明显膨大,绿色加深,7 d后愈伤包裹子叶外植体表面,伤口处愈伤生长最为明显,14 d左右,愈伤呈现瘤状突起(图1b)。由表1可知:6-BA、NAA和AgNO3的极差R值分别为19.05、9.52和30.95,即3因素对子叶外植体的不定芽诱导率的影响效应由大到小依次为:AgNO3质量浓度、6-BA质量浓度和NAA质量浓度。在一定AgNO3质量浓度范围内,芽诱导率随AgNO3浓度升高而增加,不加AgNO3(A1、A5、A9)的组合,诱导率在2.38%以下,当AgNO3超过3 mg/L则表现抑制作用。从K值大小可知,根用芥菜子叶不定芽诱导培养基的最优植物生长调节剂组合为5.0 mg/L 6-BA、0.5 mg/L NAA和3.0 mg/L AgNO3,芽诱导率达19.05%,且不定芽较健壮(图1d)。

图1 根用芥菜愈伤组织的诱导及植株再生

表1 植物生长调节剂浓度配比对根用芥菜子叶不定芽诱导的影响
2.1.2 对下胚轴不定芽诱导的影响 接种7 d后下胚轴外植体两端伤口膨大,长出愈伤,14 d左右白色愈伤组织逐渐覆盖整个下胚轴外植体(图1c),随培养时间的延长,约25 d时,淡黄色愈伤组织逐渐分化出绿色芽点,后期分化成苗。由表3可知,6-BA、NAA和AgNO3的极差R值分别为11.90、19.05和35.71,即3个因素对下胚轴的不定芽诱导率的影响效应大小依次为:AgNO3、NAA和6-BA。9个组合中,不加AgNO3的处理中不定芽诱导率最高只有4.76%,MS附加5.0 mg/L 6-BA、0.5 mg/L NAA、3.0 mg/L AgNO3的培养基对下胚轴愈伤组织的诱导率最高达到26.19%,高于其他组合,其下胚轴分化出的不定芽如图1e。

表2 植物生长调节剂浓度配比对根用芥菜下胚轴不定芽诱导的影响
综合表1~2可知,根用芥菜子叶和下胚轴不定芽诱导的最佳培养基为MS+5.0 mg/L 6-BA+0.5 mg/L NAA+3 mg/L AgNO3;根据因素内水平极差大小可知,乙烯抑制剂AgNO3质量浓度对于芥菜组培分化诱导率有更重要的作用。
2.2 不同光照预培养对根用芥菜不定芽诱导的影响
根用芥菜子叶和下胚轴在不同光照条件下预培养10 d后的诱导和分化情况见表3。在暗培养处理下,子叶和下胚轴分化率均最低(子叶没有分化,下胚轴分化率为9.38%),愈伤为白色,疏松,部分死亡;光培养(1 000~1 500 lx)的条件下,子叶和下胚轴愈伤均为淡黄色,较紧实,分化率分别为9.52%和39.04%;光培养(2 000~2 500 lx)条件下,子叶和下胚轴愈伤均为黄绿色,比较紧实,分化率分别为16.67%和23.44%。因此可知,根用芥菜子叶在正常光下不定芽分化率最高达到16.67%,下胚轴在光培养(1 000~1 500 lx)条件下不定芽分化率最高达到39.04%。

表3 不同光照预培养对根用芥菜不定芽诱导的影响
2.3 不同苗龄对根用芥菜不定芽诱导的影响
苗龄对根用芥菜子叶及下胚轴外植体分化率有一定的影响,本试验分别接种了苗龄5、7、9 d的子叶和下胚轴,观察其愈伤组织生长情况及外植体愈伤诱导率和分化率。由表5可知,苗龄对愈伤诱导率没有影响,不同苗龄的子叶和下胚轴的愈伤诱导率均为100%;苗龄对子叶和下胚轴的分化率有一定的影响,5 d苗龄的子叶分化率最大(16.67%),7 d苗龄的下胚轴分化率最大(21.43%)。

表4 不同苗龄对根用芥菜不定芽的诱导的影响
2.4 植物生长调节剂种类及浓度配比对根用芥菜不定芽增殖的影响
由表5可以知,当不定芽接种在含有1 mg/L 6-BA和0.1 mg/L NAA的培养基后,丛生芽的诱导率达到最大值93.33%,但增殖倍数为仅有2.67;当6-BA的浓度为1mg/L、IAA浓度为0.2 mg/L时,丛生芽的增殖倍数最高(6.05倍);当6-BA的浓度为1 mg/L、IBA浓度为0.1 mg/L时丛生芽的诱导率最低,仅为60%。通过比较发现,添加6-BA和IAA的C5和C6处理的增殖倍数和平均芽数都高于前4个处理,添加NAA的处理丛生芽出现不同程度的玻璃化现象,且在基部愈伤组织严重,不利于其增殖。综合以上,认为根用芥菜不定芽最佳增殖培养基为添加1 mg/L的 6-BA和0.2 mg/L的 IAA的MS培养基。
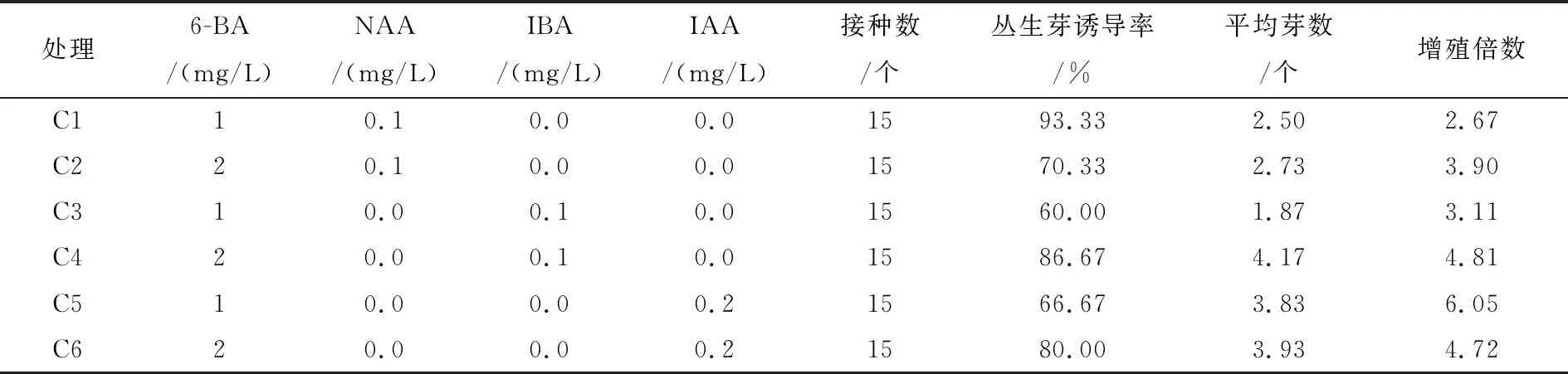
表5 植物生长调节剂浓度配比对根用芥菜不定芽增殖的影响
2.5 植物生长调节剂种类及浓度配比对根用芥菜生根培养的影响
不同植物生长调节剂种类及浓度配比对根用芥菜不定芽生根的影响见表6。接种5~7 d左右部分处理有不定根长出,14 d后,添加了NAA和IAA的处理D3-D6,在外植体接触培养基的部分长有不同程度愈伤,且未见不定根形成;不加任何植物生长调节剂的CK,生根率为20.83%;处理D1和D2组培苗生长健壮,添加0.2 mg/L IBA生根率达91.67%,且无明显愈伤(图1f)。由此可见,添加0.2 mg/L IBA的MS培养基适合其生根培养。生根培养25 d后的组培苗开瓶炼苗3~5 d,转入盆栽中,幼苗生长良好,栽培成活率达到100%(图1g)。

表6 植物生长调节剂浓度配比对根用芥菜生根培养的影响
3 结论与讨论
植物离体培养过程中光照条件是不能被任何植物生长调节剂所替代,外植体的不同培养阶段对光照要求也不同[8]。杨晶等[9]研究表明,黑暗培养有利于愈伤组织和根的生长,但不利于不定芽的分化。师校欣等[10]研究表明,新红星苹果茎尖外植体接种和生根阶段,1周暗培养有利于茎尖分化和不定根诱导;易丽娟等[11]研究表明,2 000 lx的光照适合红花外植体生长;1 500~2 000 lx的光照更有利于红花愈伤组织的生根[12]。本试验结果表明,根用芥菜子叶在2 000~2 500 lx不定芽分化率最高(16.67%),愈伤生长良好;下胚轴在1 000~1 500 lx光照条件下不定芽分化率最高(39.04%),愈伤生长良好。
培养基中加入不同种类的外源激素及配比,通过改变内源激素水平与平衡,对愈伤的形成、不定芽的分化及生根都有影响[13]。不同植物的种类、基因型和外植体等都会影响到外源激素的种类和配比,而且诱导愈伤组织和分化的最适培养基不同。杨洁等[14]年关于芜菁的子叶下胚轴的再生体系建立研究表明,不同种类及浓度的激素对该植物下胚轴不定芽再生影响较大。王丽艳等[15]研究表明,诱导芥菜愈伤组织最适培养基为:MS+(0.1 mg/LNAA)+(3 mg/L 6-BA),最适愈伤组织分化培养基为:MS+(0.1 mg/L NAA)+(1 mg/L 6-BA)。本研究结果表明,根用芥菜子叶和下胚轴最适不定芽分化培养基为MS+(5.0 mg/L 6-BA)+(0.5 mg/L NAA)+(3 mg/L AgNO3),不定芽的增殖效果以MS+(1.0 mg/L 6-BA)+(0.2 mg/L IAA)培养基最佳,生根效果以MS+(0.2 mg/L IBA)培养基最好。
Ag+可以防止外植体产生过多乙烯对植株再生的抑制,是较好的乙烯活性抑制剂[16]。张鹏等[17]研究表明,一定浓度的AgNO3能够提高体细胞胚胎和芽发生的频率,高浓度的AgNO3则降低再生率。AgNO3对许多单、双子叶植物的离体再生的促进作用已有不少报道,如AgNO3能促进小麦[18]、玉米[19]、拟南芥[20]、大白菜[21]、甘蓝[22]、花菜[23]等植物愈伤组织的再生,对难以再生的离体植物,AgNO3对外植体诱导分化起作用更明显。本试验结果表明,AgNO3浓度对根用芥菜子叶和下胚轴体的不定芽诱导率的影响大于6-BA浓度和NAA浓度,在培养基中添加一定浓度的AgNO3,可以提高根用芥菜外植体芽诱导率,当AgNO3浓度超过3 mg/L则表现抑制作用。
