小麦和大麦麸质蛋白的提取方法比较及SDS-PAGE分析
2021-01-10汪佳佳胡慧敏潘雪峰陈霞庄昕波张涛陈银基
汪佳佳 胡慧敏 潘雪峰 陈霞 庄昕波 张涛 陈银基
摘要:以小麦和大麦为材料,分别采用混合物提取法、乙醇提取法、异丙醇结合DTT提取法、异丙醇结合DTT两步提取法、水—氯化钠—乙醇三步提取法及水—氯化钠—乙醇水浴提取法对小麦和大麦进行麸质蛋白提取,比较不同方法提取液中蛋白质的质量浓度,并进行SDS-PAGE分析比较其蛋白组成的差异。结果显示,除水—氯化钠—乙醇提取法不能完整提取小麦麸质蛋白,其余几种方法均成功提取麸质蛋白。混合物提取法、60%乙醇提取法、异丙醇结合DTT提取法、70%乙醇提取法從大麦中提取的麸质蛋白质量浓度较高。混合物提取法提取液中SDS-PAGE条带数最多,并且可以提取高分子量麦谷蛋白。
关键词:小麦;大麦;麸质蛋白;提取;SDS-PAGE
中图分类号:TS201.2 文献标识码:A DOI:10.16465/j.gste.cn431252ts.20210224
小麦和大麦是面食的主要来源,也是必需氨基酸及许多生物活性成分的潜在来源[1-2],其麸质蛋白主要由麦醇溶蛋白和麦谷蛋白组成,是麦类中的贮藏蛋白,约占麦类蛋白的80%[3]。当麸质蛋白与水混合时,麦醇溶蛋白通过形成分子内二硫键赋予面团延展性,麦谷蛋白通过形成分子间二硫键赋予面团黏弹性,二者的组成和结构会影响面团的形成及其制品烘焙品质。麸质蛋白是引起乳糜泻的主要因素,研究[4]表明,麦醇溶蛋白中含有丰富的脯氨酸和谷氨酰胺,是麸质蛋白中最主要的抗原成分,能够触发免疫反应,其中包含刺激性表位最多的是α-/β-醇溶蛋白,能够触发免疫反应,导致乳糜泻。
乳糜泻(Celiac disease)是一种由T细胞介导的慢性小肠炎症性疾病,由基因易感个体摄入小麦和大麦中的麸质蛋白引起[5]。乳糜泻是遗传因素和环境因素共同作用的结果,遗传因素主要包括人类白细胞抗原HLA-DQ2和HLA-DQ8,环境因素主要包括麸质蛋白上的T细胞表位和麸质蛋白中富含的脯氨酸[6]。根据血清学和活检,估计全球乳糜泻的平均患病率分别为1.4%和0.7%,但区域差异较大[7]。患者终生严格执行无麸质饮食是目前治疗乳糜泻的唯一可靠方法。因此,探索和筛选高效的麸质蛋白提取方法对小麦和大麦麸质蛋白检测与应用具有重要意义。
本研究选取混合物提取法[8]、60%乙醇提取法[9]、异丙醇结合DTT提取法[10]、异丙醇结合DTT两步提取法[11]、70%乙醇提取法、水—氯化钠—乙醇三步提取法[12]等麸质蛋白提取具有代表性的方法以及在三步提取法基础上改进的水—氯化钠—乙醇三步水浴提取法对小麦麸质蛋白进行提取,并对提取液进行SDS-PAGE分析,以期筛选高效适宜的麸质蛋白提取方法,为麸质蛋白检测工作及无麸质食品研究提供理论依据。
1 材料与方法
1.1 材料与试剂
小麦(过60目筛):产自河南商丘;大麦(过60目筛):产自吉林通化;Cocktail提取液:德国拜发公司;无水乙醇(分析纯):无锡市亚盛化工有限公司;异丙醇(分析纯)、盐酸(分析纯)、丙酮(分析纯):南京化学试剂有限公司;氯化钠(分析纯)、冰醋酸(分析纯):国药集团化学试剂有限公司;BSA标准品5×G250染色液、DTT(分析纯)、5×Tris-甘氨酸电泳缓冲液、PBS稀释液、5×蛋白质上样缓冲液、考马斯亮蓝R250、TEMED:北京索莱宝科技有限公司;AP(分析纯):上海麦克林生化科技有限公司;预染蛋白Marker:赛默飞世尔科技有限公司。
1.2 主要仪器
THZ-82恒温振荡器:国华电器有限公司;DHG-90338S-Ⅲ型烘箱:中国上海沪粤明科学仪器有限公司;vortex_genie 2型涡旋混合器:美国Scientific Industries公司;TWS-24型四孔恒温水浴锅:上海喆图科学仪器有限公司;TG16WS型高速台式离心机:湖南湘仪实验室仪器开发有限公司;SpectraMax 190型酶标仪:美国Molecular Devices公司;Mini-PROTEAN型电泳仪:美国BIO-RAD公司;ChemiDocTMXRS+型凝胶成像系统:美国BIO-RAD公司。
1.3 麸质蛋白的提取
1.3.1 混合物提取法
称取0.1 g样品,加入1 mL Cocktail提取液,涡旋混匀,于50 ℃孵育40 min。冷却样品,然后加入3 mL 80%乙醇,室温条件下振荡1 h。5 000 r/min离心10 min,收集上清液(样品A)。
1.3.2 乙醇提取法
称取0.1 g样品,加入1 mL 60%或70%的乙醇溶液,涡旋混匀,振荡提取2 h,7 000 r/min离心10 min,收集上清液。分别将60%和70%乙醇提取的样品编号为B和C。
1.3.3 异丙醇结合DTT提取法
称取0.1 g样品,加入1 mL 50%异丙醇—1% DTT—50 mmoL/L Tris-HCl (pH 7.5),涡旋混匀,振荡提取2 h,7 000 r/min离心10 min,收集上清液(样品D)。
1.3.4 异丙醇结合DTT两步提取法
称取0.1 g样品,加入50%异丙醇,涡旋混匀,超声10 min,回旋振荡30 min,7 000 r/min离心10 min,收集上清液1;向沉淀加入1 mL 50%异丙醇—1% DTT—50 mmoL/L Tris-HCl (pH 7.5),超声10 min,60 ℃加热30 min,每5 ~ 10 min混匀一次,7 000 r/min离心10 min,收集上清液2,沉淀再次用1 mL 50%异丙醇—1% DTT—50 mmoL/L Tris-HCl(pH 7.5)提取,步骤同上,得上清液3,合并3次上清液(样品E)。
1.3.5 水—氯化钠—乙醇三步提取法
称取0.1 g样品,加入1 mL蒸馏水,振荡提取30 min,7 000 r/min离心10 min,弃上清液;加入1 mL 0.5 mol/L的NaCl溶液,振荡提取30 min,7 000 r/min离心10 min,弃上清液;加入1 mL 70%乙醇溶液,振荡提取30 min,7 000 r/min离心10 min,收集上清液(样品F)。
1.3.6 水—氯化钠—乙醇三步水浴提取法
称取0.1 g样品,加入1 mL蒸馏水,超声10 min,于水浴中提取40 min,每5 ~ 10 min混匀一次,7 000 r/min离心10 min,弃上清液;加入1 mL0.5mol/L的NaCl溶液,超声10 min,于水浴中提取40 min,每5 ~ 10 min混匀一次,7 000 r/min离心10 min,弃上清液;加入1 mL 70%乙醇溶液,超声10 min,于水浴中提取40 min,每5 ~ 10 min混匀一次,7 000 r/min离心10 min,收集上清液。分别将40、50、60 ℃下水浴提取的样品编号为G40、G50、G60。
以上方法提取的蛋白质均置于-20 ℃保存备用。
1.4 麸质蛋白质量浓度的测定
采用Bradford法。取出冷冻保存的蛋白样品,待其恢复至室温,涡旋混匀,用PBS稀释液将各样品稀释5倍,涡旋混匀;取BSA蛋白标准品10 μL,用PBS稀释液稀释至250 μL,使溶液最终质量浓度为0.2 mg/mL。取2 mL 5×G250染色液,加入8 mL超纯水,混匀成1×G250染色液。将标准品按0、2、4、6、8、12、16、20 μL分别加到96孔板中,加PBS稀释液补足到20 μL;将各样品加20 μL到96孔板中,每孔均做3组平行。每孔加入200 μL 1×G250染色液,室温放置3 ~ 5 min。用酶标仪测定A595 nm值。最后,根据标准曲线计算出样品中蛋白质量浓度。
1.5 SDS-PAGE电泳分析
取出冷冻保存的蛋白质样品,待其恢复至室温,涡旋混匀,每个样品加入4倍体积100%丙酮,-20 ℃冷冻过夜。第2天取出样品,升温至4 ℃,10 000 r/min离心15 min,弃上清液,沉淀样品在50 ℃烘箱中干燥。
向沉淀中加入200 μL稀释后的1×蛋白质上样缓冲液,100 ℃加热5 min,取5 μL上样。采用10%的分离胶和4%的浓缩胶,电泳条件为恒流电压80 V。电泳完毕后,用10%三氯乙酸溶液固定15 min,固定后用考馬斯亮蓝R-250对蛋白进行染色过夜,脱色液脱色6 h,用凝胶成像系统成像。
1.6 数据处理
试验中数据用软件SPSS 16.0进行分析,采用ANOVA分析,并通过Duncan’s法进行多重比较。
2 结果与分析

2.1 提取方法对提取液中麸质蛋白质量浓度的影响
不同提取方法提取小麦和大麦中麸质蛋白的质量浓度如表1所示。从表1可以看出,不同提取方法对同一种谷物麸质蛋白提取效果不同,同种方法对不同谷物麸质蛋白的提取效果有较大差异。混合物提取法、60%乙醇提取法、70%乙醇提取法和异丙醇结合DTT提取法提取大麦中麸质蛋白的质量浓度高于小麦中麸质蛋白的质量浓度;异丙醇结合DTT两步提取法、水—氯化钠—乙醇三步提取法和水—氯化钠—乙醇水浴提取法提取小麦中麸质蛋白的质量浓度显著高于大麦中麸质蛋白的质量浓度。
不同提取方法提取小麦麸质蛋白的结果显示,60%乙醇提取与混合物提取法、异丙醇结合DTT提取法、异丙醇结合DTT两步提取法、水—氯化钠—乙醇三步提取法及水—氯化钠—乙醇水浴40 ℃提取的麸质蛋白质量浓度有显著性差异(P<0.05)。水—氯化钠—乙醇三步提取法和混合物提取法提取的麸质蛋白质量浓度较前面的几种方法差,但是高于水—氯化钠—乙醇三步水浴40 ℃提取和异丙醇结合DTT两步提取法。异丙醇结合DTT提取法对小麦麸质蛋白的提取效果最差。
不同提取方法提取大麦中麸质蛋白的结果显示,混合物提取法、60%乙醇提取、70%乙醇提取的麸质蛋白质量浓度无显著性差异(P>0.05),但是与其他6种方法差异显著(P<0.05)。水—氯化钠—乙醇三步提取法效果较差,水—氯化钠—乙醇三步水浴提取法中,40 ℃提取的麸质蛋白质量浓度最高,与小麦的恰好相反。
2.2 SDS-PAGE电泳分析
2.2.1 条带数比较
采用ImageJ软件分析得到的不同提取方法电泳条带数如表2所示。从表2可以看出,混合物提取法和水—氯化钠—乙醇三步提取法提取得到的小麦中麸质蛋白条带数较多,乙醇和异丙醇提取法得到的条带数较少。对于大麦麸质蛋白的提取,混合物提取法得到的条带数最多,其他几种方法差异不大。
2.2.2 图谱分析
对不同提取方法提取的小麦和大麦麸质蛋白进行SDS-PAGE鉴定,结果如图1所示。
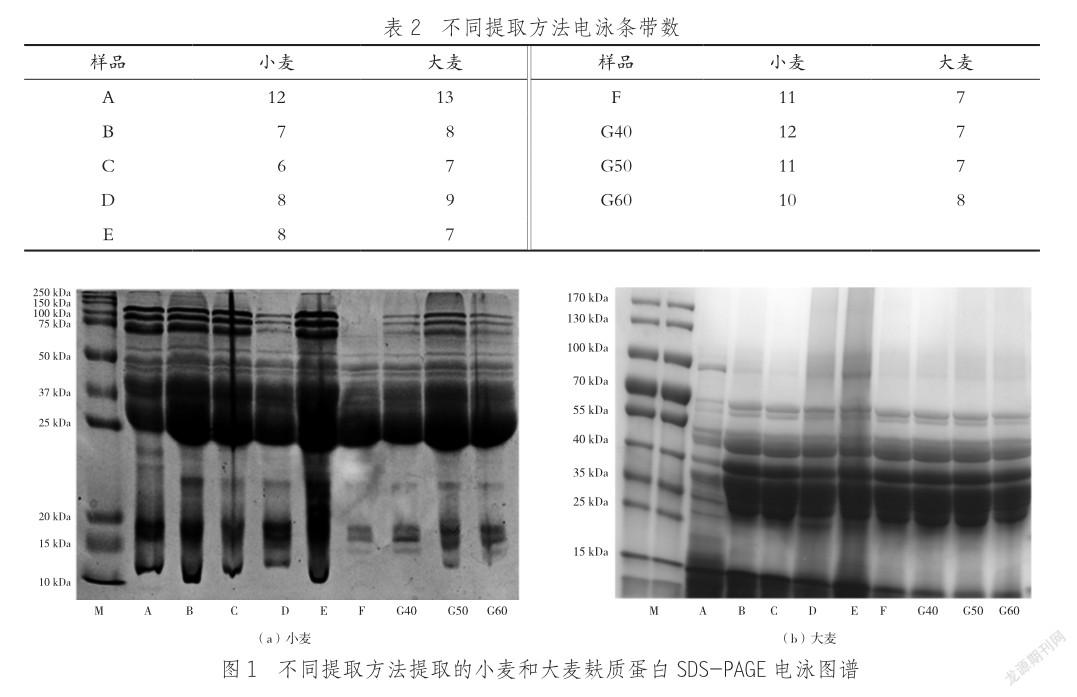
从图1(a)可以看出,大部分方法提取出来的高分子量麦谷蛋白为3个条带。D、G40、G50、G60 4个样品的条带颜色较浅,可能是高分子质量麦谷蛋白含量较低。水—氯化钠—乙醇三步水浴提取法中不同水浴温度所得条带有所差异,其中50 ℃水浴得到的条带颜色最深,40、60 ℃水浴得到的颜色较浅,可能是50 ℃条件下提取的高分子质量麦谷蛋白含量最高。水—氯化钠—乙醇三步提取法的样品在80 ~ 130 kDa条带缺失,可能是此样品中的高分子质量麦谷蛋白含量非常低。
分子量为50 ~ 70 kDa的区间主要分布的是ω-醇溶蛋白(50 ~ 70 kDa)和D-型低分子质量麦谷蛋白(50 ~ 60 kDa),二者存在交叉,很难被清晰地区分开。所有方法提取的蛋白在D-型低分子质量麦谷蛋白区域存在条带,但无分子质量较高的ω-醇溶蛋白(60 ~ 70 kDa)。从整个ω-醇溶蛋白和D-型低分子质量麦谷蛋白区域可知,几种方法提得的蛋白质差异性不大。
分子质量为30 ~ 50 kDa的区间主要分布的是低分子质量麦谷蛋白和α-,β-,γ-醇溶蛋白。其中B-型低分子质量麦谷蛋白主要分布在40 ~ 50 kDa,C-型低分子质量麦谷蛋白主要分布在30 ~ 40 kDa,α-,β-,γ-醇溶蛋白主要分布在30 ~ 45 kDa。由于低分子质量麦谷蛋白和α-,β-,γ-醇溶蛋白的分子质量区间存在交叉,因而想要严格地区分出各种蛋白,存在一定难度。从图1可以看出,分子质量在40 ~ 50 kDa蛋白差异较小,样品B、C、E及G50的蛋白在30 ~ 40 kDa条带颜色更深。
30 kDa以下区域,水—氯化钠—乙醇三步提取法提得的蛋白条带较少,颜色较浅,其余几种方法条带更多,颜色更深。有研究[13—14]证明,提取液中加入的还原剂会影响免疫反应,但还原剂DTT或β-巯基乙醇能提高麦谷蛋白的提取效率,而混合物提取法所用的Cocktail提取液中β-巯基乙醇和胍氯化物以1∶100稀释后不会影响免疫反应。
从图1(b)可以看出,混合物提取法对醇溶蛋白的提取效果较好,条带清晰,除混合物提取法和异丙醇结合DTT两步提取法提取出了高分子质量谷蛋白外,其余几种方法均未能提取,但对醇溶蛋白的提取量都較高,无显著差别。综上,水—氯化钠—乙醇三步提取法提取的麸质蛋白量较少,其余几种方法提取的量较高;几种方法均不能很好地提取出大麦中的高分子质量谷蛋白,相对而言异丙醇结合DTT提取法对高分子质量谷蛋白的提取效果最佳。
3 结 论
采用9种不同的方法提取小麦和大麦中的麸质蛋白,并对其提取效果进行比对分析,结论如下:除水—氯化钠—乙醇提取法不能完整提取小麦麸质蛋白,其余几种方法均成功提取麸质蛋白。采用Bradford法测定蛋白浓度结果显示,60%乙醇提取法和70%乙醇提取法提得的小麦中麸质蛋白浓度最高,是提取小麦麸质蛋白的最优的两种方法;对于大麦中麸质蛋白的提取,70%乙醇提取法提得的蛋白浓度最高,异丙醇结合DTT法次之。而混合物提取法提取小麦和大麦中麸质蛋白得到SDSPAGE条带数最多,显示混合物提取法可以提取麦类中高分子量麦谷蛋白。
参 考 文 献
[1] GUO Tianli, HORVATH Carla, CHEN Ling, et al. Understanding the nutrient composition and nutritional functions of highland barley (Qingke): A review[J]. Trends in Food Science& Technology, 2020, 103: 109-117.
[2] HOUDE Marika, KHODAEI Nastaran, BENKERROUM Noreddine, et al. Barley protein concentrates: Extraction, structural and functional properties[J]. Food Chemistry, 2018, 254: 367-376.
[3] ARISTO Vojdani, ELROY Vojdani. Gluten and non-gluten proteins of wheat as target antigens in autism, Crohn’s and celiac disease[J]. Journal of Cereal Science, 2017, 75: 252-260.
[4] WIESER H, KOEHLER P. The Biochemical Basis of Celiac Disease[J]. Cereal Chemistry, 2008, 85(1): 1-13.
[5] FASANO A, CATASSI C. Current Approaches to Diagnosis and Treatment of Celiac Disease: An Evolving Spectrum[J]. Gastroenterology, 2001, 120: 636-651.
[6] GOSIA Trynka, CISCA Wijmenga, DAVID A van Heel. A genetic perspective on coeliac disease[J]. Trends in Molecular Medicine, 2010, 16(11): 537-550.
[7] PRASHANT Singh, ANANYA Arora, TOR A Strand, et al. Global Prevalence of Celiac Disease: Systematic Review and Meta-analysis[J]. Clinical Gastroenterology and Hepatology, 2018, 16(6): 823-826.
[8] PENG Yanchun, YU Zitong, ISLAM Shahidul, et al. Allelic variation of LMW-GS composition in Chinese wheat landraces of the Yangtze-River region detected by MALDI-TOF-MS[J]. Breeding science, 2016, 66(4): 646-652.
[9] 李崇達.小麦醇溶蛋白的提取及其磁性微球的制备与性能研究[D].郑州:河南工业大学,2011.
[10] SUN Xueni, HEINRICH Paul, BERGER Raffaela S, et al. Quantification and 13C-Tracer analysis of total reduced glutathione by HPLC-QTOFMS/MS[J]. Analytica Chimica Acta, 2019, 1 080: 127-137.
[11] VAN DEN BROECK H C, AMERICA A H P, SMULDERS M J M, et al. A modified extraction protocol enables detection and quantification of celiac disease-related gluten proteins from wheat[J]. Journal of Chromatography B, 2009, 877(10): 975-982.
[12] 潘治利,罗元奇,艾志录,等.不同小麦品种醇溶蛋白的组成与速冻水饺面皮质构特性的关系[J].农业工程学报, 2016, 32(4): 242-248.
[13] SPAENIJ-DEKKING E H A, KOOY-WINKELAAR E M C,NIEUWENHUIZEN W F, et al. A novel and sensitive method for the detection of T cell stimulatory epitopes of α/β- andγ-gliadin[J]. Gut, 2004, 53(9):1 267-1 273.
[14] ENRIQUE García, MERCEDES Llorente, ALBERTO Her- nando, et al. Development of a general procedure for complete extraction of gliadins for heat processed and unheated foods[J]. European Journal of Gastroenterology & Hepatology, 2005, 17(5): 529-539. Comparison of Extraction Methods of Wheat and Barley Gluten Protein and SDS-PAGE Analysis
Wang Jiajia1, Hu Huimin2, Pan Xuefeng1, Chen Xia3, Zhuang Xinbo1, Zhang Tao1, Chen Yinji1
( 1. School of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing, Jiangsu 210023; 2. Anhui Yunyan Food Technology Co., Ltd., Xuancheng, Anhui 341881;
3. Agricultural and Rural Bureau of Gaochun District, Nanjing, Jiangsu 211300 )
Abstract: Gluten of wheat and barley were extracted by nine extraction methods, SDS-PAGE was applied to separate and compare the extraction results. The results revealed that the extraction method of H2O-NaCl-ethanol could not completely extract gluten proteins, While other methods were successful. Mixture extraction, 60% ethanol extraction, Isopropanol/DTT extraction and 70% ethanol extraction obtained higher gluten content in barley. The mixture extraction method extracts the largest number of SDS-PAGE bands in grains and can extract high-molecular-weight glutenin.
Key words: wheat, barley, glulen protein, extraction method, SDS-PAGE
