三种检测技术鉴别结核分枝杆菌复合群与非结核分枝杆菌的效能评价
2021-01-10易俊莉杨新宇张洁田丽丽丁北川武文清
易俊莉 杨新宇 张洁 田丽丽 丁北川 武文清
非结核分枝杆菌病与结核病临床表现相似,如未能及时准确鉴定极易造成误诊,且非结核分枝杆菌(non-tuberculous mycobacteria,NTM)大多对常见的抗结核药品耐药,只采用常规抗结核药品进行治疗疗效大多不理想。因此,需要操作简便、快速、可靠的区分结核分枝杆菌复合群(MTBC)与NTM的检测方法。为此,笔者比较不同原理的3种方法[即:对硝基苯甲酸/噻吩-2-羧酸肼(PNB/TCH)生长试验法、结核分枝杆菌抗原(MPB64)检测法、PCR-荧光探针法]对MTBC和NTM的鉴定结果,分析其临床应用价值。
资料和方法
一、菌株来源
11株标准菌株包括MTB标准株H37Rv及10株 NTM标准株(堪萨斯分枝杆菌、戈登分枝杆菌、胞内分枝杆菌、鸟分枝杆菌、龟分枝杆菌、脓肿分枝杆菌、瘰疬分枝杆菌、溃疡分枝杆菌、蟾蜍分枝杆菌、偶然分枝杆菌)均来源于国家结核病参比实验室。238株临床分离株为北京结核病控制研究所2019年1—12月门诊患者培养阳性冻存菌株,经涂片抗酸染色均为阳性。
二、检验方法
1.仪器与试剂:中性罗氏培养基及PNB/TCH培养基由河南赛诺特生物技术有限公司提供。结核分枝杆菌抗原(MPB64)检测试剂盒由杭州创新生物检控技术有限公司提供。PCR-荧光探针法使用Roche LightCycler480仪,试剂盒由成都博奥晶芯生物科技有限公司提供。微阵列基因芯片试剂盒、核酸提取仪、芯片杂交仪、芯片扫描仪由北京博奥生物有限公司提供。
2.菌株复活:从菌株冻存管中取0.1 ml菌液接种在中性罗氏培养基中,37 ℃孵育2~4周,每周观察生长情况,直至长出可视菌落。
3.PNB/TCH生长试验:按照《结核病实验室检验规程》[1]进行。取中性罗氏培养基中复活的单个菌落加入无菌生理盐水制成1 mg/ml菌液。将稀释成10-2mg/ml的菌液各取0.1 ml分别接种于中性罗氏培养基与PNB/TCH培养基上,37 ℃孵育4周,观察菌落生长情况。PNB/TCH生长者判定为NTM,PNB未生长TCH生长判定为MTBC,中性罗氏培养基无生长时需重新检测。
4.MPB64检测法:在试管中加入0.2 ml生理盐水及中性罗氏培养基中复活的单个菌落,加盖后用涡旋混合器充分混合制成待测样本。将100 μl样本滴入检测板的加样孔内,反应15 min,观察结果。阳性:检测线(T)及质控线(C)都出现紫红色条带。阴性:检测线(T)处没有出现紫红色条带,只有质控线(C)处出现紫红色条带。如质控线没有显示条带时使用其他检测板重新检测。阳性结果判定为MTBC,阴性结果判定为NTM。
5.PCR-荧光探针法:取中性罗氏培养基中复活的单个菌落及50 μl核酸提取液加入核酸提取管中,放入核酸提取仪震荡5 min,95 ℃水浴5 min,3000×g离心1 min。取2 μl核酸样本加入18 μl扩增反应液管后放入实时荧光定量PCR仪。设置PCR扩增程序:37 ℃ 5 min、94 ℃ 3 min后,94 ℃ 15 s、60 ℃ 30 s,40个循环,50 ℃ 10 s。检测通道同时选择羧基荧光素(FAN)和六氯荧光素(HEX)通道,荧光采集点选择60 ℃ 30 s。样本扩增曲线呈S型,且循环阈值(Ct值)<40判定为阳性,扩增曲线不呈S型或Ct值≥40(或无任何数值)判定为阴性。FAM通道阳性,HEX通道阳性或阴性,判定为MTBC。FAM通阴性,HEX通道阳性,判定为NTM。FAM通道阴性,HEX通道阴性判定为分枝杆菌核酸检测阴性。
6.微阵列基因芯片检测:核酸提取方法同PCR-荧光探针法。将提取的2 μl模版DNA加入至18 μl反应体系中,按试剂盒说明书进行PCR扩增。取6 μl PCR扩增产物、9 μl杂交缓冲液制成杂交反应混合物,从盖片的加样孔加入,50 ℃杂交2 h。杂交结束后用十二烷基硫酸钠洗液和柠檬酸钠洗液冲洗干净,用晶芯MTB检测芯片系统进行结果判读。
三、统计学处理
采用SPSS 19.0软件进行分析。计数资料以“率(%)”表示。以微阵列基因芯片鉴定结果为参照,计算PNB/TCH生长试验法、MPB64检测法、PCR-荧光探针法对MTBC的检测效能,计算公式:敏感度(%)=真阳性株数/(真阳性株数+假阴性株数)×100%;特异度(%)=真阴性株数/(真阴性株数+假阳性株数)×100%;符合率(%)=(真阳性株数+真阴性株数)/总株数×100%;阳性预测值(%)=真阳性株数/(真阳性株数+假阳性株数)×100%;阴性预测值(%)=真阴性株数/(真阴性株数+假阴性株数)×100%。采用Kappa值进行一致性检验,Kappa值≥0.75时表示一致性较好。
结 果
一、标准菌株检测结果
10株NTM标准菌株及MTB标准株经PNB/TCH生长试验法、MPB64检测法、PCR-荧光探针法均正确判定。238株临床分离株中,PNB/TCH生长试验法检出207株(87.0%)MTBC、31株(13.0%)NTM;MPB64检测法检出203株(85.3%)MTBC,35株(14.7%)NTM;PCR-荧光探针法检出206株(86.6%)MTBC,32株(13.4%)NTM。有4株菌应用PNB/TCH生长试验法、MPB64检测法、PCR-荧光探针法检测结果不一致,其中3株MPB64检测结果为NTM菌株,PNB/TCH生长试验和PCR-荧光探针法检测结果为MTBC,后经微阵列基因芯片鉴定确认为MTB;1株菌PNB/TCH生长试验法检测结果为MTBC,MPB64检测和PCR-荧光探针法检测结果为NTM,后经微阵列基因芯片鉴定确认为堪萨斯分枝杆菌。
二、检测效能分析
以微阵列基因芯片法鉴定结果为参照标准,PNB/TCH生长试验法检测MTBC的敏感度为100.0%(206/206)、特异度为96.9%(31/32);MPB64检测法检测MTBC的敏感度为98.5%(203/206)、特异度为100.0%(32/32);PCR-荧光探针法检测MTBC的敏感度为100.0%(206/206)、特异度为100.0%(32/32);Kappa值分别为0.98、0.95、1.00(表1)。
三、方法可实施性分析
PNB/TCH生长试验法、MPB64检测法、PCR-荧光探针法检测周期分别为28 d、0.5 h、0.5 d,检测平均成本分别为20、40、60元。PNB/TCH生长试验法和MPB64检测法需要得到培养物才能进行检测。PCR-荧光探针法需要实验室及操作人员具有专业的核酸检测能力(表2)。

表1 以微阵列基因芯片法为参照标准评价3种检验方法检测MTBC的效能
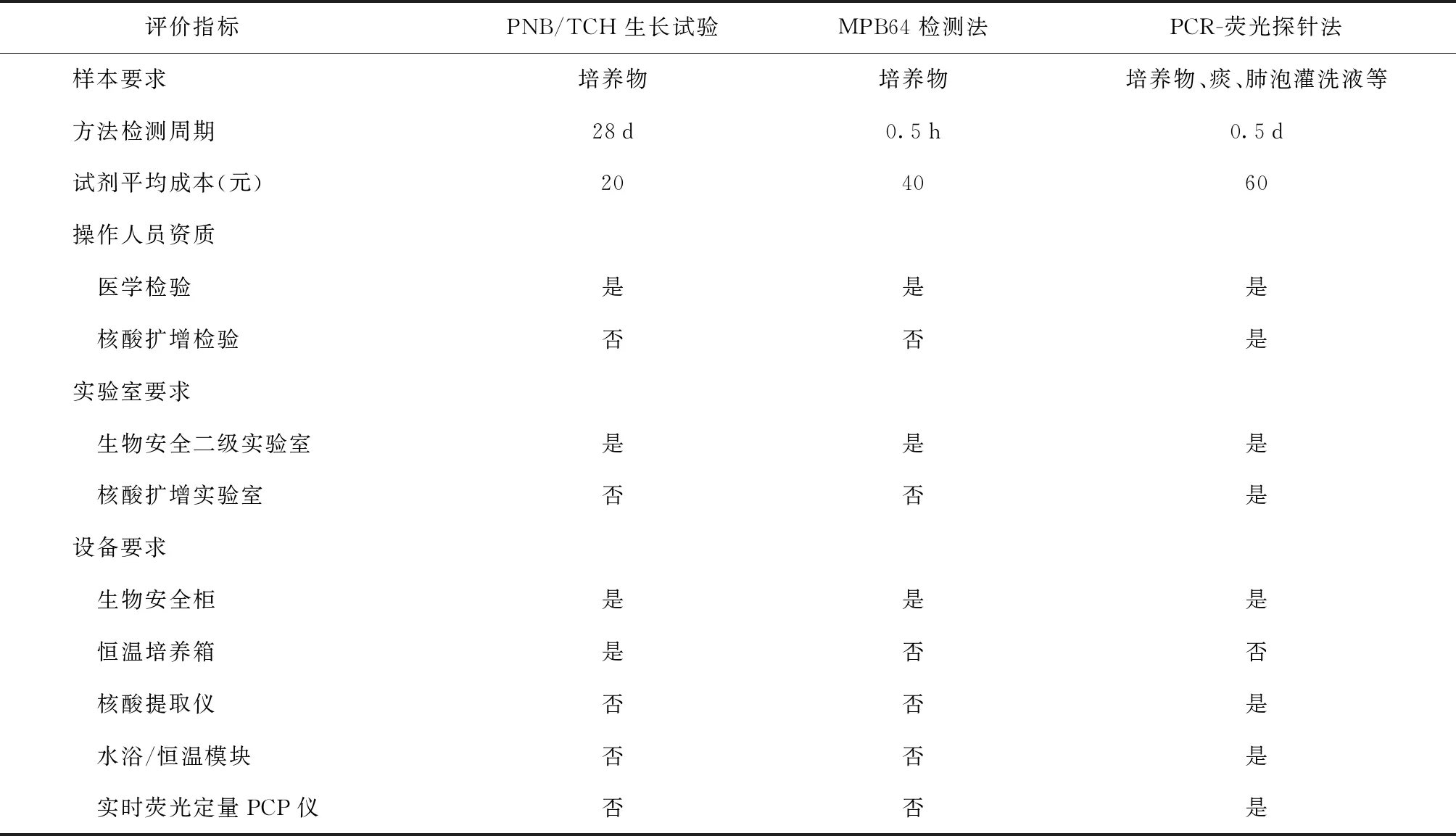
表2 PNB/TCH生长试验法、MPB64检测法、PCR-荧光探针法可实施性比较
讨 论
本研究以微阵列基因芯片法鉴定结果为参照标准,分析比较了三种不同原理的MTBC和NTM鉴定方法的检测效能及可实施性。PNB/TCH生长试验法是最传统的鉴定MTBC的方法,其是利用MTBC在含有PNB培养基中生长受到抑制,大多数NTM对一定浓度的PNB有耐药性的原理,从而鉴别MTBC与NTM。MPB64检测法检测对象为培养物中的结核分枝杆菌抗原MPB64(又称MPT64),是MTBC分泌的一种特异性分泌蛋白,而NTM不分泌。PCR-荧光探针法采用双重PCR技术和Taqman探针技术相结合的原理,对样本中提取的分枝杆菌核酸进行定性检测。
本次研究中,PNB/TCH生长试验法检测MTBC 的敏感度为100.0%,特异度为96.9%。其中,1株菌PNB/TCH生长试验法检测结果为MTBC,MPB64检测法和PCR-荧光探针法检测结果为NTM,经微阵列基因芯片法最终菌种鉴定为堪萨斯分枝杆菌,说明PNB/TCH生长试验法作为MTBC与NTM鉴别试验存在局限性,部分NTM可能被错误归类为MTBC,与李国利等[2]的报道一致。吴龙章等[3]分析认为,需要光学照射才能产生色素的光产色性分枝杆菌菌群(如堪萨斯分枝杆菌)在实验室中未经光学照射易误判为MTBC,从而导致检验结果出现错误。当比例法药敏试验显示多种药品耐药而PNB显示敏感,且对照管生长的菌落为细小菌落或产色时,应高度怀疑为NTM,为避免结果差错,建议采用其他方法进一步验证。
MPB64检测法检测MTBC的敏感度为98.5%,特异度为100.0%。其中,有3株假阴性结果,即MPB64检测法检测结果为NTM,PNB/TCH生长试验法、PCR-荧光探针法检测结果为MTBC,经微阵列基因芯片法最终菌种鉴定为MTBC,该现象此前也有报道。分析其主要原因,可能为MTB中的MPB64编码基因突变,如63 bp缺失,造成出现检测假阴性结果[4-7]。MPB64检测法除了可以利用固体培养基上的菌落进行检测,也可以采用抗酸杆菌培养物的悬浊液或者培养液直接作为样本使用。因此,适用于BACTEC MIGIT 960培养阳性后药物敏感性试验前的菌种初步鉴定,可缩短检测周期。但对生长指数较低的样本,应适当延长培养时间,以避免假阴性产生[8-9]。液体培养法MTB涂片镜检多呈索状排列,NTM多呈团块状排列或散在分布,因此,当MPB64检测法检测结果与涂片镜检形态结果不一致时,建议采用其他方法进一步确认。
PCR-荧光探针法具有较高的敏感度和特异度。《WS 288—2017肺结核诊断》[10]也已将分枝杆菌核酸检测纳入结核病病原学检查范畴。核酸扩增法可以利用临床痰标本直接进行检测,作为痰涂片和培养的补充,对结核病病原学快速检测具有重要的临床应用价值[11]。同时,因无需使用阳性培养物进行检测,可大幅缩短检测周期,为患者早期诊断和制定化疗方案提供依据。
在各实验室技术可实施性方面,PCR-荧光探针法检测耗时短,总检测时间仅需要0.5 d,但操作较为复杂,需要实验室及操作人员具有专业的核酸检测能力,且前期设备仪器投入较大,造成检测成本相对较高,在基层实验室推广使用尚需时日。MPB64检测法操作更为简便,只需在生物安全柜内将样本滴入加样孔后15 min即可观察结果,总检测时间不超过30 min。同时,该方法对实验人员和实验辅助设备要求相对不高,试剂盒可常温保存,费用合理,更适用于标本量较多且检测条件有限的基层实验室。PNB/TCH生长试验法具有操作简单、费用低的优势,但培养判定所需时间较长(28 d),在快速鉴别诊断中并无优势。
综上所述,三种方法均可用于MTBC与NTM的鉴定,各具优势。PCR-荧光探针法敏感度和特异度高,检测结果较其他两种方法更为准确可靠,适合具有核酸检测能力的实验室使用。MPB64检测法操作简便、快速、价格低廉,更适合标本量大且检测能力有限的基层实验室进行初步鉴定使用。
