炎症性肠病患者维生素D水平与肠道菌群的相关性
2021-01-09张瑞丽钱家鸣
陈 丹,李 玥,孙 翰,肖 盟,张瑞丽,邱 玲,谭 蓓,钱家鸣
中国医学科学院 北京协和医学院 北京协和医院 1消化内科 2急诊科 3检验科,北京100730
肠道菌群是哺乳动物体内最复杂和最大的微生态系统,其种类多达1000余种,细菌总数多达100万亿,参与宿主营养物质代谢及免疫功能调节,其构成受遗传、饮食、药物等多因素影响。肠道菌群通过调节维生素D吸收、羟化,活性维生素D降解及维生素D受体 (vitamin D receptor,VDR)的表达等方式影响维生素D/VDR信号通路[1-4]。维生素D除调节钙磷代谢、影响骨骼健康之外,活性维生素D与维生素D核受体结合后,可发挥抗感染、增强固有免疫、抑制过度适应性免疫应答、增强黏膜屏障等功能,间接影响肠道菌群结构[5-9]。肠道菌群与维生素D相互影响,二者平衡对维持肠黏膜稳态至关重要。炎症性肠病(inflammatory bowel disease,IBD)患者体内维生素D/VDR信号通路受损[10-11],普遍存在维生素D缺乏,而肠道菌群失调又是IBD致病机制之一,本研究拟探讨IBD患者血清总25羟维生素D[total 25-hydroxyvitamin D,T-25(OH)D]水平与肠道菌群构成之间的相关性,进一步认识维生素D与肠道菌群之间的关系。
对象和方法
对象纳入标准:2017年10月至2018年3月在北京协和医院住院且临床或病理确诊的IBD患者,IBD诊断标准参照我国 《炎症性肠病诊断与治疗的共识意见 (2018年,北京)》[12];知情并同意留取新鲜粪便标本送检粪便菌群分析;在留取粪便1个月内检测血清T-25(OH)D水平。排除标准:未确诊IBD;粪便采样前行结直肠手术。最终纳入23例IBD患者,均签署知情同意书,本研究经北京协和医院伦理委员会批准 (S-K892)。
分组纳入对象根据血清T-25(OH)D水平分为维生素D正常组、维生素D不足组和维生素D缺乏组。根据我国 《维生素D与成年人骨骼健康应用指南》(2014年标准版)[13],维生素D正常指血清T-25(OH) D≥50 nmol/L(20 ng/ml), 维生素 D不足指30 nmol/L≤血清T-25 (OH) D<50 nmol/L[12 ng/ml≤血清T-25(OH)D<20 ng/ml],维生素D缺乏指血清T-25 (OH) D<30 nmol/L(12 ng/ml)。
液相色谱串联质谱法血清T-25(OH)D采用液相色谱串联质谱法由北京协和医院检验科代为检测。
16S r DNA V4区域扩增子测序分析患者留取新鲜粪便,1 h内冻存于-80℃冰箱,集中送至北京诺禾致源科技股份有限公司代为检测,采用16SrDNA V4区域扩增子测序分析粪便菌群。
测序方法:采用十六烷基三甲基溴化铵法对样本的基因组DNA进行提取,采用16SrDNA V4区特定引物 (515F:GTGCCAGCMGCCGCGGTAA;806R:GGACT ACHVGGGTWTCTAAT)扩增总DNA里16s rDNA V4区,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,并纯化、切胶回收目标条带。使用赛默飞世尔公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和质检,最后产生400 bp和600 bp的单端序列,使用赛默飞世尔的Ion S5TMXL进行上机测序。
信息分析:首先将测序数据进行质控,获得有效数据,然后进行以下生物信息分析:(1)可操作分类单元 (operational taxonomic unit,OTU) 聚类和物种注释:对所有样品中的有效序列,按97%的一致性将序列聚类成为OTUs,在97%以上的序列一致性下聚类成为一个OTU的序列被认为可能是源于同一个种;然后将OTUs的代表序列与Silva数据库比对,进行物种注释。(2)3组患者门水平的物种丰度分析:根据物种注释结果,选取每个组在门水平上丰度排名前10位的物种,生成物种相对丰度柱形累加图,以便直观查看各组患者粪便菌群在门水平上丰度较高的物种及其比例。(3)三元相图分析:为了寻找门水平3组样本之间优势物种的差异,选取3组样品在门水平上平均丰度排名前10的物种,应用R软件生成三元相图[14]。(4)Alpha多样性分析:用于分析样品内的微生物物种多样性,可用生物多样性稀释曲线或Chao1、Shannon等指数分析绘制的箱型图来体现[15]。生物多样性稀释曲线可直接反映测序数据量的合理性,并间接反映样品中物种的丰富程度,当曲线趋向平坦时,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种。Chao1、Shannon等Alpha多样性指数可通过wilcox秩和检验分析组间物种多样性差异是否显著。(5)Beta多样性分析:对不同样品的微生物群落构成进行比较分析,应用主坐标分析体现,如果样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。采用相似性分析评估组间的整体相似性,R介于 (-1,1)之间,R大于0,说明组间差异显著;R小于0,说明组内差异大于组间差异,统计分析的可信度用P值表示,P<0.05表示差异有统计学意义[16]。 (6)组间差异物种分析:选取各组在门、纲、目、科、属分类水平中平均丰度>0.001的物种,对这些物种丰度行组间t检验,找出组间差异显著 (P<0.05) 的物种。 (7) 应用Spearman相关性分析行血清T-25(OH)D水平、炎症指标与粪便菌群中门、纲、科、目、属水平的物种丰度之间的相关性分析。
统计学处理临床资料相关数据应用SPSS 24.0软件进行统计学分析,符合正态分布的计量资料以均数±标准误表示,组间均数比较采用t检验或ANOVA检验;计数资料以例数和百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
临床资料共纳入IBD患者23例,其中克罗恩病8例,1例仅累及小肠、7例回结肠均受累;溃疡性结肠炎15例,其中2例为左半结肠型、13例为广泛结肠型。按照血清T-25(OH)D水平分为3组,其中血清T-25(OH)D正常组5例、不足组5例、缺乏组13例。3组患者的基线资料包括性别、年龄、用药、血红蛋白浓度、血清白蛋白浓度、红细胞沉降率(erythrocyte sedimentation rate,ESR)、 超敏 C反应蛋白等组间比较差异均无统计学意义 (表1)。
粪便菌群OUT 在Ion S5TMXL测序平台对23例IBD患者粪便细菌进行16S rDNA V4区域扩增子单端测序,平均每样本检出81 041条序列,经质控后,纳入分析的平均每样本76 634条序列。生物多样性稀释曲线 (图1)提示每例患者可检出的细菌种类随序列数目增加已经达平台期,评估此次检测有较高准确性及代表性。
粪便菌群差异性维生素D正常、不足、缺乏3组IBD患者粪便菌群Alpha多样性指数Chao1指数依次为 862.72±294.53、762.69±187.73、866.52±377.86(图2A),Shannon指数依次为4.77±1.88、5.56±0.31、4.80±1.04(图2B),wilcox秩和检验分析显示3组间物种多样性差异无统计学意义 (P>0.05)。Beta多样性采用主坐标分析,提示3组患者分布离散,组内个体差异较大,且3组患者粪便菌群不能被明显区分 (图2C)。相似性分析提示3组患者粪便菌群组内差异大于组间差异 (R<0,P>0.05)。
粪便菌群构成通过物种相对丰度柱形累加图分析门水平丰度前10的物种构成,3组患者均以厚壁菌门、拟杆菌门、变形菌门、放线菌门为主,但维生素D缺乏组较维生素D正常组变形菌门丰度明显增高、放线菌门丰度下降 (图3)。三元图分析可见相似结果,变形菌门在维生素D缺乏组相对含量最高,而放线菌门在维生素D正常组相对含量最高 (图4);进一步通过三元图分析属水平细菌构成,Parabacteroides、肠球菌、未分类梭菌和链球菌在维生素D缺乏组含量高,而双歧杆菌、布劳特氏菌在维生素D正常组含量高 (图5)。
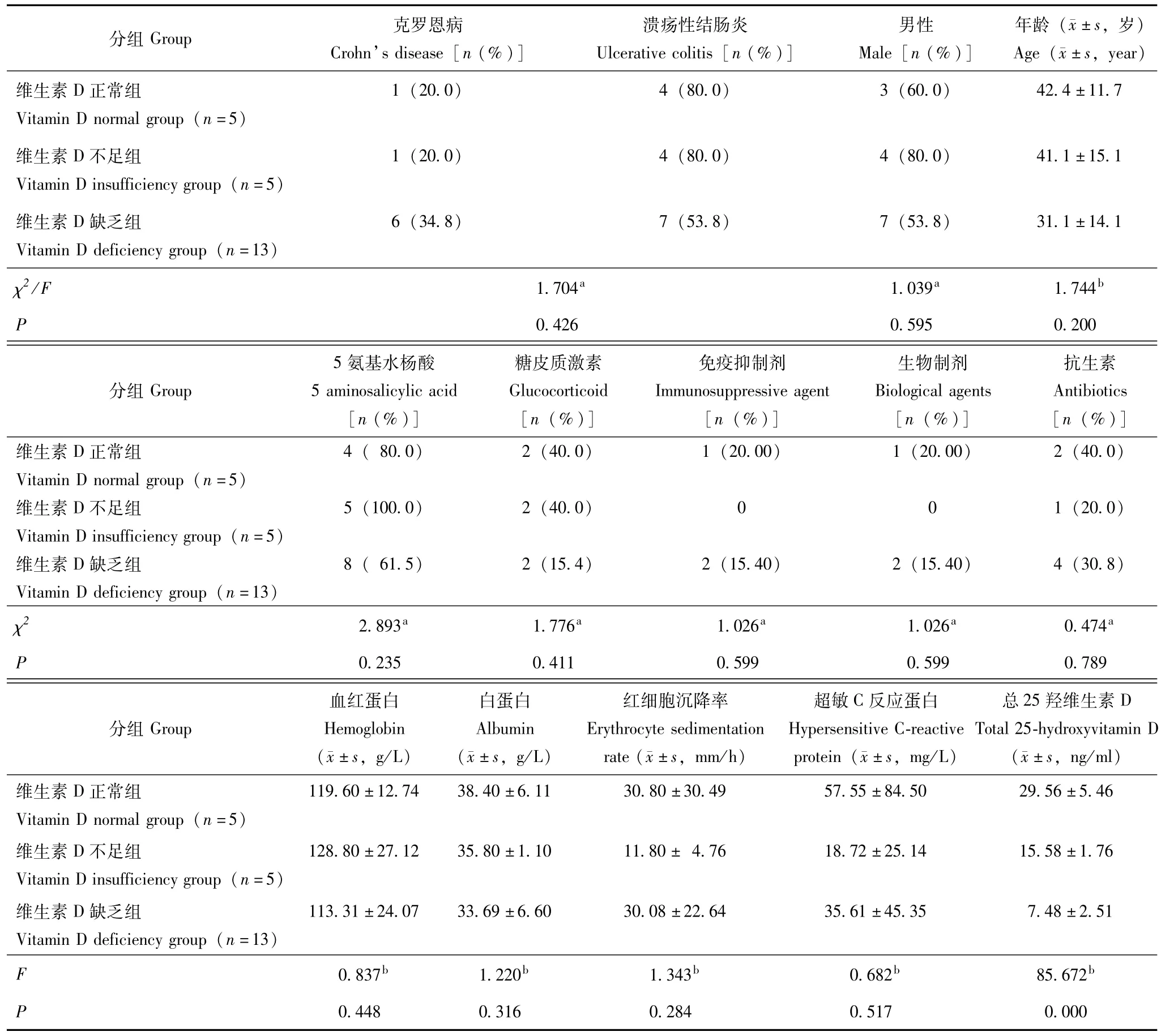
表1 23例炎症性肠病患者临床资料Table 1 Clinical characteristics of 23 patients with inflammatory bowel disease
图1 生物多样性稀释曲线Fig 1 Biodiversity curves
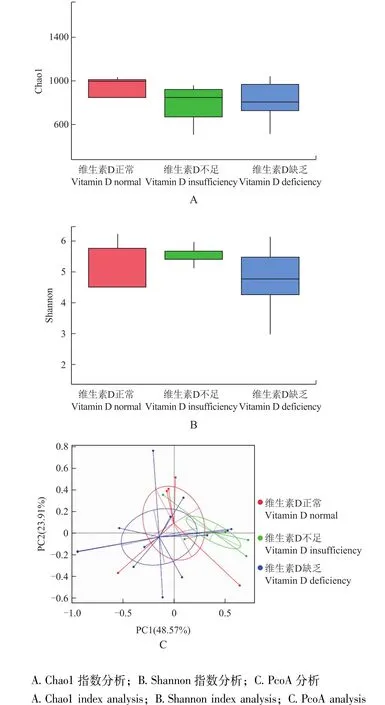
图2 Alpha多样性和Beta多样性分析Fig 2 The alpha diversity and beta diversity analyses
选取3组IBD患者粪便菌群在门、纲、目、科、属水平中平均丰度大于0.001的物种,对所选取物种的丰度行组间t检验分析,结果显示维生素D缺乏组较维生素D正常组 Marinifilaceae丰度 (0.002 73±0.004 46比0.000 01±0.000 03,P=0.049) (科水平) 增高;维生素D缺乏组较维生素D不足组以下物种丰度增高:变形菌门 (0.219 44±0.205 43比0.030 01±0.023 83,P=0.006)、 芽抱杆菌纲 (0.125 39±0.172 24比0.014 29±0.012 67,P=0.039)、 γ变形菌纲 (0.218 30±0.205 80比0.029 37±0.024 35,P=0.006)、乳酸杆菌目(0.124 85±0.171 88比0.013 97±0.012 27, P=0.039)、肠杆菌目 (0.168 88±0.219 71比0.026 52±0.024 59,P=0.039)、 肠杆菌科 (0.168 88±0.219 71比0.026 52±0.024 59,P=0.039)和肠杆菌科未确定属 (0.048 65±0.074 39比0.001 25±0.001 23, P=0.040)。
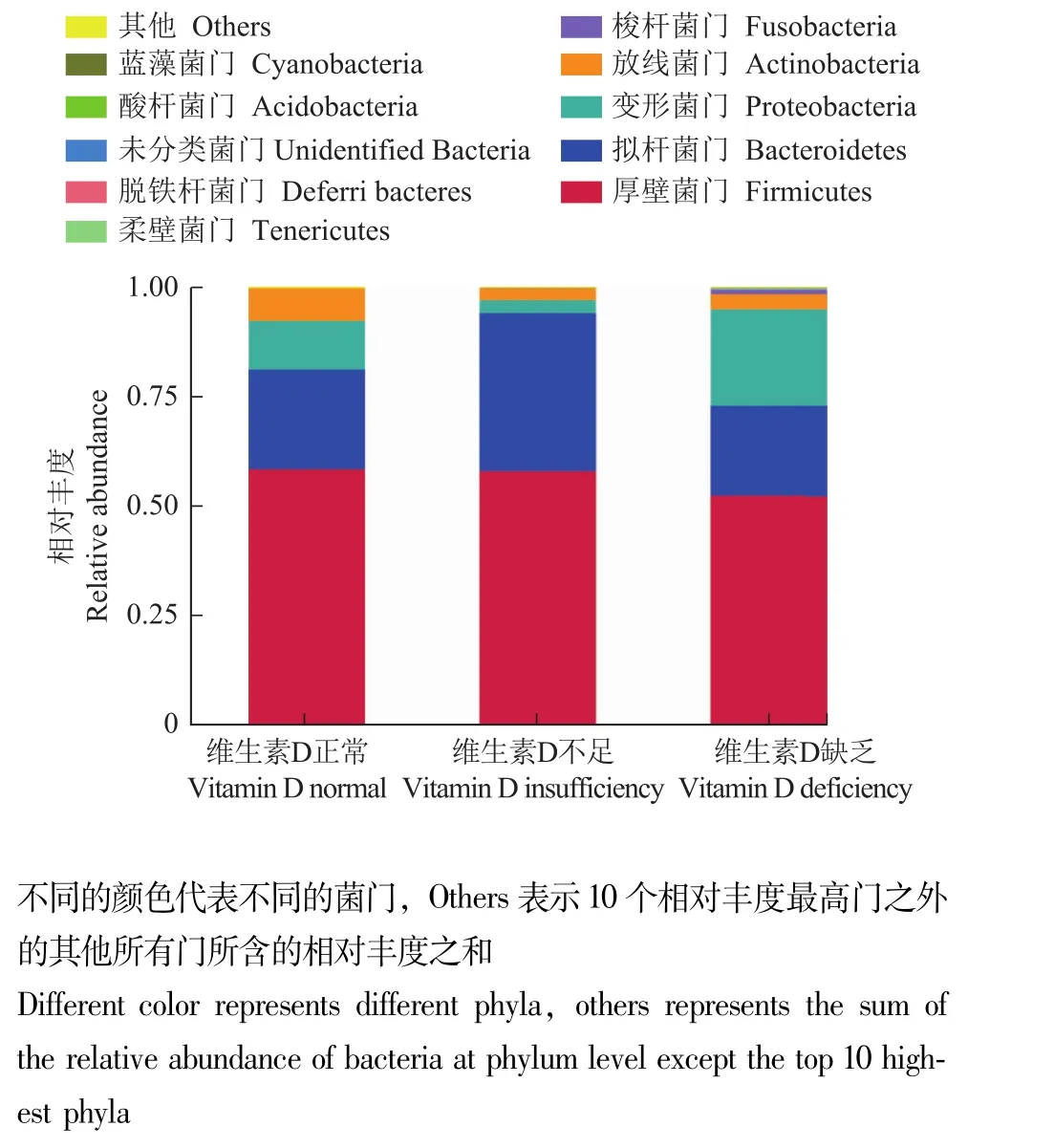
图3 3组炎症性肠病患者门水平相对丰度前10的物种构成Fig 3 The top 10 highest relative abundance of bacteria at phylum level in three groups of patients with inflammatory bowel disease
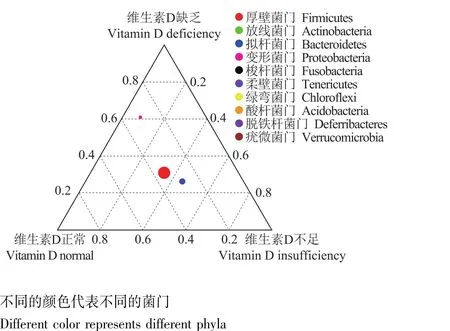
图4 3组炎症性肠病患者门水平粪便细菌含量三元图Fig 4 Ternary plot at phylum level in three groups of patients with inflammatory bowel disease
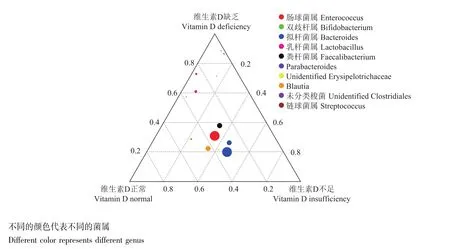
图5 3组炎症性肠病患者属水平粪便细菌含量三元图Fig 5 Ternary plot at genus level in three groups of patients with inflammatory bowel disease
血清T-25(OH)D水平、炎症指标与粪便菌群中门、纲、科、目、属水平物种相对丰度之间的相关性 采用Spearman相关性分析,在门水平:血清T-25(OH)D与变形菌门丰度呈负相关 (r=-0.445,P=0.033)、与放线菌门丰度呈正相关 (r=0.447,P=0.033),变形菌门丰度与ESR呈正相关 (r=0.489,P=0.018)(图6);科水平:血清T-25(OH)D水平与毛螺菌科 (r=0.414,P=0.049)、 双歧杆菌科 (r=0.468, P=0.024)、 Erysipelotrichaceae(r=0.584, P=0.003) 和埃格特菌科丰度 (r=0.507,P=0.014)呈正相关,与气球菌科丰度 (r=-0.514,P=0.012)呈负相关;而毛螺菌科 (r=-0.579,P=0.004)、Erysipelotrichaceae(r=-0.474,P=0.022) 和埃格特菌科的丰度 (r=-0.521,P=0.011)与ESR水平呈负相关;属水平:血清T-25(OH)D水平与布劳特斯菌属 (r=0.459,P=0.028)、 双歧杆菌属 (r=0.468,P=0.024)、 unidentified Erysipelotrichaceae(r=0.485,P=0.019)、 Faecalitalea (r=0.544, P=0.007)、Anaerostipes(r=0.475, P=0.022)、 Romboutsia (r=0.510, P=0.013)、 Flavonifractor(r=0.455, P=0.029) 和 Erysipelatoclostridium(r=0.617, P=0.002)的丰度呈正相关,其中布劳特斯菌属 (r=-0.634, P=0.001)、 未分类 Erysipelotrichacea (r=-0.613, P=0.002)、 Anaerostipes(r=-0.463, P=0.026)、 Romboutsia (r=-0.527, P=0.010) 和 Erysipelatoclostridium(r=-0.616,P=0.002) 的丰度与 ESR呈负相关 (图7)。
讨 论
IBD患者的肠道菌群构成及代谢较正常人群发生了明显变化:菌群多样性减少,稳定性降低,乳杆菌、双歧杆菌减少,放线菌、变形菌、拟杆菌等增加。随着疾病活动度的进展,肠道菌群逐渐由厚壁菌门为主向变形菌门为主转变[17]。肠道菌群与维生素D/VDR信号通路存在双向调节作用。IBD患者肠道菌群失调势必影响维生素D的吸收、代谢及功能;维生素D/VDR信号通路的功能障碍加重菌群失调。本研究显示IBD患者粪便菌群个体间差异大,不同血清T-25(OH)D水平的IBD患者粪便菌群丰度或多样性无差异,但粪便菌群构成发生改变,血清T-25(OH)D水平减低的IBD患者粪便菌群中放线菌门丰度低,变形菌门丰度高;血清T-25(OH)D水平与部分有害菌如变形菌门等丰度呈负相关性,而与部分益生菌如毛螺菌科、双歧杆菌科、丁酸弧菌属等丰度呈正相关性。
经食物中摄入的维生素D2/D3和皮肤中7-脱氢胆固醇经紫外线照射合成的维生素D3,在肝脏中被肝脏细胞色素P450 2R1和肝脏细胞色素P450 27羟化形成25(OH)D,后者在肾脏被细胞色素P450 27B1羟化形成1,25(OH)2D,为其活性形式。纤维组织母细胞生长因子 (fibroblast growth factor,FGF)23促进1,25(OH)2D转化为无活性形式的24(OH)D。酸性环境利于维生素D吸收[1],口服罗伊氏乳杆菌可通过代谢产物降低肠道pH、促进肠道维生素D吸收,增加血清25(OH)D水平[2];放线菌可应用自身代谢产物羟化维生素D;肠道菌群还可抑制活性维生素D降解,无菌小鼠体内FGF23水平升高,1,25(OH)2D3减低,微生态重建后FGF23水平下降,1,25(OH)2D3升高[3]。VSL#3、鼠李糖乳杆菌可上调肠上皮细胞VDR表达[4]。综上,肠道细菌可通过调节肠道维生素D吸收、羟化,活性维生素D降解,VDR表达等多种途径影响维生素D/VDR信号通路。IBD患者肠道菌群失调,可能参与患者维生素D/VDR通路障碍的形成。本研究显示IBD患者血清25(OH)D水平与放线菌门呈正相关,放线菌门可通过羟化维生素D提高25(OH)D水平。
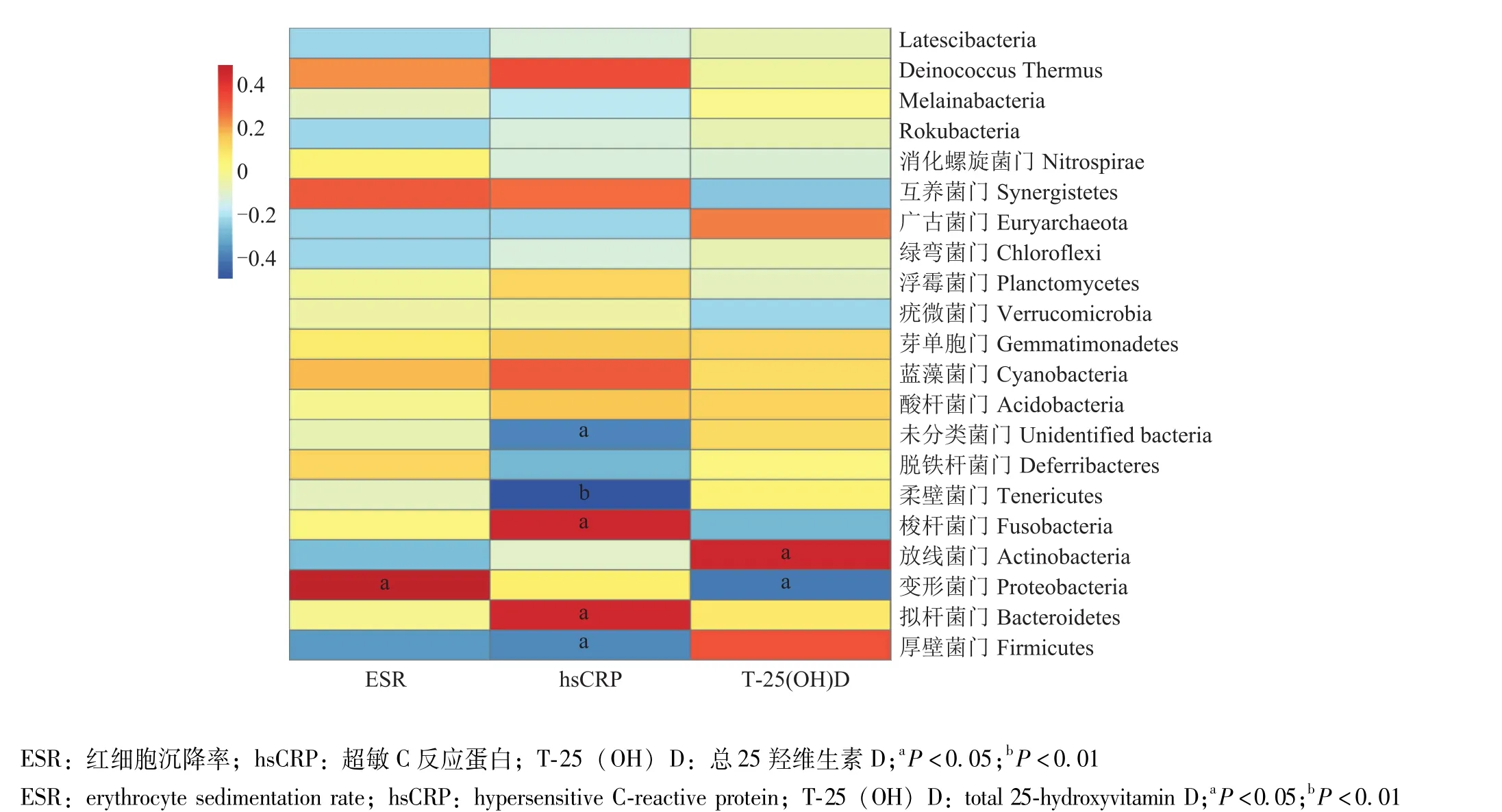
图6 血清总25羟维生素D及炎症指标与门水平细菌丰度的相关性分析Fig 6 Spearman correlation analysis of serum total 25 hydroxyvitamin D and inflammatory markers with the fecal microbiota at phylum level
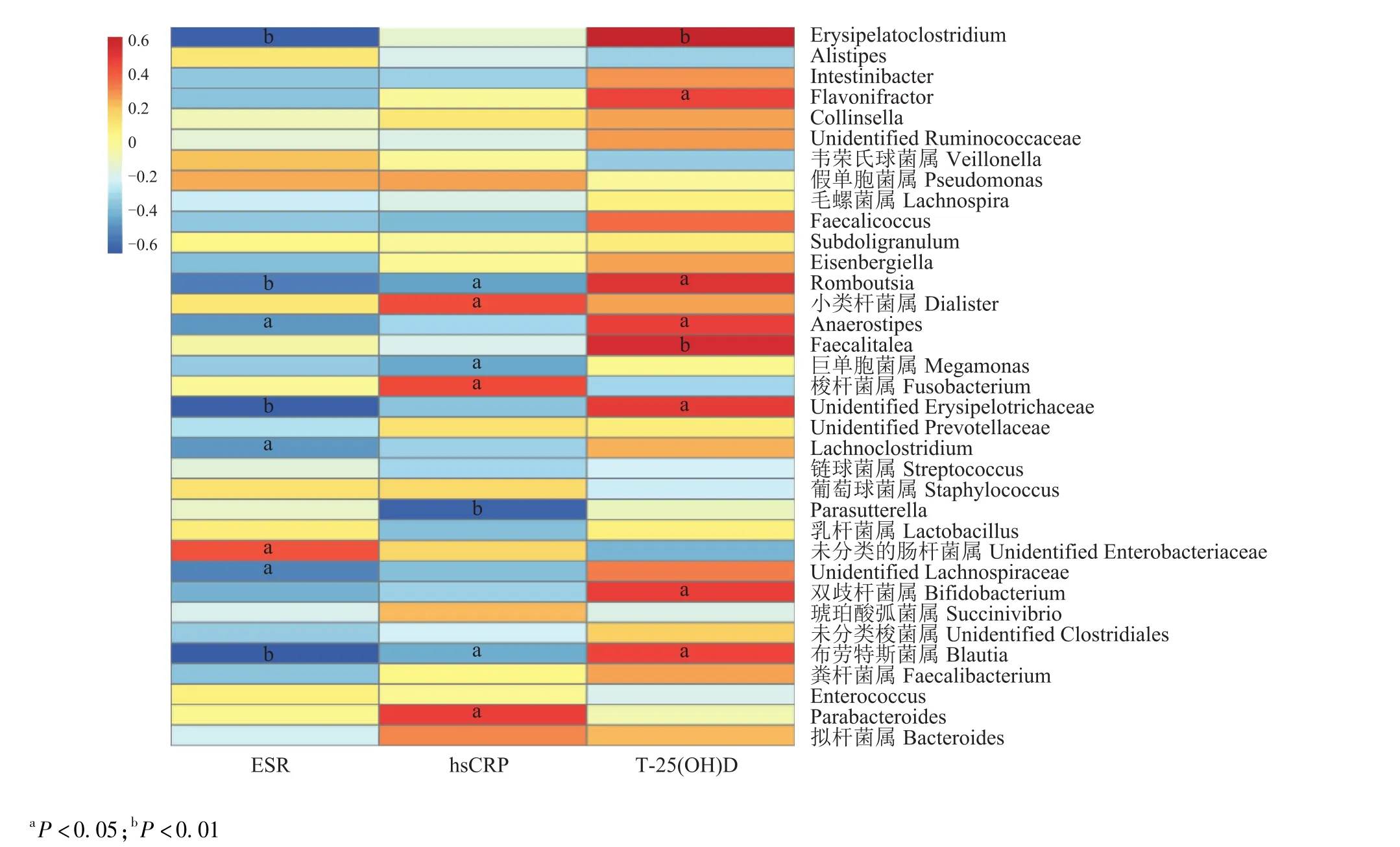
图7 血清总25羟维生素D及炎症指标与属水平细菌丰度的相关性分析Fig 7 Spearman correlation analysis of serum total 25 hydroxyvitamin D and inflammatory markers with the fecal microbiota at genus level
维生素D/VDR信号通路影响肠道菌群构成。由于原核生物不表达VDR,故推测维生素D对肠道菌群并无直接作用,而是通过间接作用如肠黏膜免疫等途径影响肠道微生态。活性维生素D可促进巨噬细胞分泌抗菌肽、β防御素等,VDR可上调单核细胞核苷酸结合寡聚化域2表达,发挥杀菌作用[18];维生素D/VDR通路受损后,肠上皮ATG16L1基因在转录水平被下调,导致肠上皮细胞自噬缺陷,从而影响潘氏细胞功能,其分泌的抗菌肽、溶解酵素减少,有利于致病菌增殖[19]。因此,血清25(OH)D水平减低可造成致病菌增加。本研究显示血清25(OH)D水平减低的IBD患者粪便菌群中变形菌门、肠杆菌、链球菌等致病菌增多,Ooi等[6]报道VDR基因敲除鼠或Cyp27B1基因敲除鼠较其野生型小鼠粪便菌群中变形菌门丰度增加,变形菌门中致病菌如沙门菌等本身可分泌有害代谢产物,抑制正常常驻菌群。本研究显示血清T-25(OH)D水平减低的患者肠道益生菌如双歧杆菌科、毛螺菌科丰度下降,与文献报道[6,20]一致。以上有害菌的增加、益生菌的减少,可导致IBD患者肠道炎症易感性增加。
本研究存在一定局限性。IBD患者本身肠道微生态失调,个体差异大,且IBD患者肠道菌群受多种因素影响,如疾病分期 (活动期或缓解期)、疾病类型(溃疡性结肠炎或克罗恩病)及治疗药物等。而本研究所纳入对象均为IBD活动期患者,无缓解期患者或正常人血清T-25(OH)D水平与肠道菌群资料,不能反映缓解期IBD患者血清T-25(OH)D水平与肠道菌群的关系。另外,本研究样本量较小,难以将IBD患者按照疾病类型或治疗药物等因素进行亚组分析,存在一定的偏倚,有待更大样本量的研究进行亚组分析以更准确地探讨疾病状态下二者的相关性。此外,本研究可反映血清总25(OH)D水平与肠道菌群之间的相关性,但不能反映二者的因果关系。
综上,本研究显示IBD患者体内血清T-25(OH)D水平与肠道菌群存在一定相关性,血清T-25(OH)D水平与双歧杆菌科、毛螺菌科、丁酸弧菌属等物种相对丰度呈正相关,与变形菌门等物种相对丰度呈负相关,为进一步研究肠道菌群与维生素D/VDR信号通路的相互作用及其二者在炎症性肠病中的作用奠定了基础。
