剁辣椒中一株乳酸菌的分离与鉴定
2021-01-09周维成卞杰松蔡明基杨钧惠李晓平杨德俊
周维成,卞杰松,刘 晶,蔡明基,杨钧惠,李晓平,杨德俊
(1. 湘南学院化学生物与环境工程学院,湖南 郴州 423000;2. 湖南省嘉禾县三味 食品有限公司,湖南 郴州 423000)
剁辣椒是湖南的特色食品,酸辣可口,深受消费者喜爱。剁辣椒主要利用天然乳酸菌进行发酵,一方面发酵速度慢,另一方面品质的形成受自然条件的影响非常大,常因为自然条件的变化而导致产品品质发生变化[1]。因此,筛选高效、耐盐、耐酸同时具有较强亚硝酸盐降解能力的优良乳酸菌进行纯种发酵,成为提高剁辣椒发酵品质的重要途径。目前从剁辣椒中分离出的发酵菌主要是植物乳杆菌、短乳杆菌、戊糖片球菌等,但以乳杆菌为主。叶陵等[2]从12 份剁辣椒样品中分离出乳酸菌,用产酸、亚硝酸盐降解率等指标筛选出优良的乳酸菌,并对其进行鉴定,然后进行耐盐、耐酸能力的比较。随后,叶陵等[3]以筛选到的优良植物乳杆菌W-4 作为发酵菌株进行纯种发酵,观察发酵过程中剁辣椒中微生物菌群及有机酸的变化规律,进一步阐明植物乳杆菌在剁辣椒发酵过程中的作用机制。胡博涵等[4]采用乳酸菌和酵母菌混合发酵的方式生产剁辣椒,研究其适宜发酵条件,为缩短发酵周期,提高剁辣椒品质做出了相关贡献。郭蓉等[5]也从剁辣椒中分离出一株乳酸菌,在接种发酵过程中相比其他乳酸菌亚硝酸盐含量低。徐浩等[6]筛选出一株耐盐在24%以上的酵母菌,经鉴定为鲁氏结合酵母。
目前,以人工接种方式进行剁辣椒工业化生产尚处于起步阶段。为了使传统产品在工业化过程中仍能保持其特色,笔者拟从剁辣椒中筛选出优良乳酸菌菌株,通过研究其生长繁殖与代谢特性,优化其培养条件,为剁辣椒工业化生产提供优良菌株。
1 材料与方法
1.1 材料与试剂
剁辣椒来源于湖南省郴州市嘉禾县三味食品有限公司;MRS 培养基购自北京索莱宝,其他试剂均为分析纯(均购于国药化学试剂有限公司)。
1.2 仪器设备
立式压力蒸汽灭菌器(LDZX-50FBS,上海申安医疗器械厂);pH 值计(E-301F pH 三复合电极,雷磁);紫外可见分光光度计(UVmini-1240,岛津);电子恒温水浴锅(HH-2,苏州威尔实验品有限公司);电热鼓风干燥箱(101 型,北京中兴伟业仪器有限公司);离心机(TDZ5-WS,湘仪);PCR 扩增仪(MiniAmp Plus,赛默飞世尔);电泳仪(DYCP-31BN,北京六一生物科技有限公司);紫外凝胶成像仪(BOT-III,中仪博腾)
1.3 试验方法
1.3.1 剁辣椒中乳酸菌的分离及形态学观察 无菌条件下,取10 g 剁辣椒溶于100 mL 无菌生理盐水中,摇匀,经系列稀释后涂布MRS 固体平板中,37℃培养24 h。挑取单菌落至新的MRS平板上进行划线纯化,将纯化的单菌落进行保存。对分离菌落进行革兰氏染色并镜检。
1.3.2 分子鉴定 取适量菌液,CTAB 法提取DNA。利用16s rRNA 通用引物5F:ATGAACGCTGGCGGTA TG,819R:TTCCTTTGAGTTTCACAGTTGC 进行PCR 扩增。PCR 反应体系:12.5 μL Taq MasterMix(康为世纪),10 μmol/L 上下游引物各1 μL,1 μL 总DNA,补无菌水至25 μL。反应程序:94℃预变性3 min;94℃变性30 s,55℃退火40 s,72℃延伸1 min,30个循环;72℃延伸5 min。PCR 产物切胶回收,连接pMD18-T 载体(Takara,Japan),测序。在NCBI 中进行BLAST 序列比对分析。利用Mega 7.0 构建系统发育树。
1.3.3 生长曲线的测定 将活化菌株按2%接种量转接至100 mL MRS 液体培养基中,每4 h 于紫外分光度计下测定600 nm 处培养基吸光值。
1.3.4 耐酸性试验 将活化的乳杆菌分别接种于pH值为3、5 和7 的MRS 培养基中,37℃摇床培养24 h,每隔4 h 测定600 nm 处吸光值。
1.3.5 亚硝酸盐降解率测定 取2 mL 活化菌液,接种 至100 mL 含有100 mg/L NaNO2的MRS 培养基中, 37℃摇床培养24 h后,离心取上清按照GB/T 5009.33— 2003 测定培养基中NaNO2浓度。
1.3.6 耐盐性试验 配制不同盐浓度(0、5%、7%、10%、12%和15%)的MRS 培养基,分别接种等量2%的活化菌液,37℃摇床培养24 h,测定600 nm 处吸光值。
2 结果与分析
2.1 乳杆菌的分离与鉴定
挑取单菌落进行多次划线后,菌落形态呈圆形,表面光滑,白色。对纯化后的菌株进行革兰氏染色发现该菌株为革兰氏阳性菌株(图1 a),菌体呈杆状。16s rRNA 序列比对后发现该菌株与植物乳杆菌(L. plantarum)最为相近(图1 b),NCBI 数据库BLAST比对显示与L. plantarum 的相似性可达99.9%,因此将分离获得的菌株命名为L. plantarum SW。
2.2 菌株生长特性
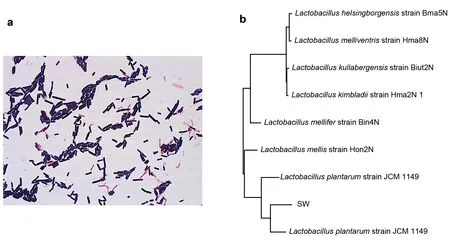
图1 分离菌株形态与系统发育树
SW 菌株在MRS 液体培养基中的生长曲线见图2,接种0~8 h 内,菌株生长较缓慢,随后菌体生长速率快速增加,24 h 后菌株数量相对缓慢,培养32 h 时菌株数量达最大值,随后,菌株数量开始下降。
2.3 不同pH 值对菌株生长的影响
不同pH 值条件下SW 菌株生长状况见图3,当在pH 值为3 时,SW 菌株数量在整个培养周期内无显著变化,当pH 值为5 和7 时,随着pH 值的增加菌株增长速率加快。24 h 时,pH 值为7 时处理组菌 株生长速率相对pH 值为3 和5 时增加了57%和31%。
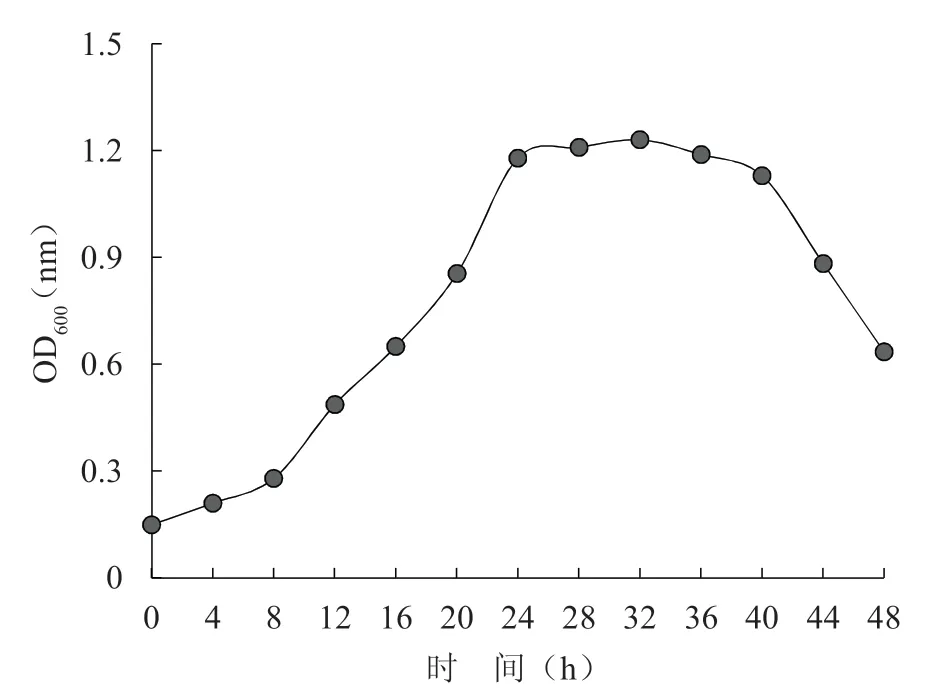
图2 SW 菌株的生长曲线
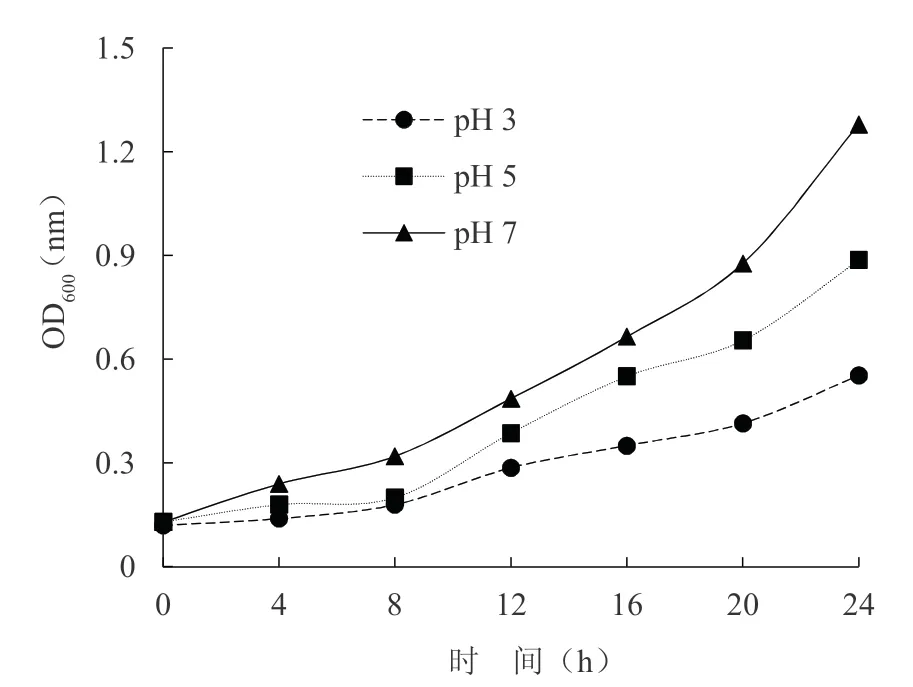
图3 不同pH 值条件下菌株生长状况
2.4 菌株对亚硝酸盐降解能力分析
随着培养时间延长,SW 菌株对亚硝酸盐的降解能力不断增强(图4),培养24 h 后含有SW 菌株的MRS 培养基中亚硝酸钠含量下降至空白对照的21%,表明菌株SW 具有较强的亚硝酸盐降解能力。
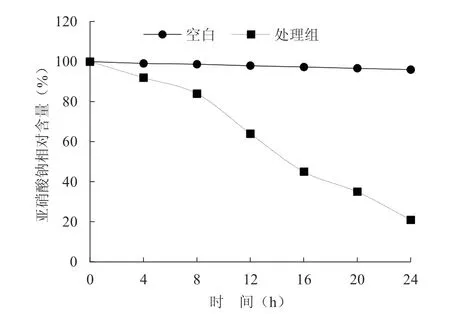
图4 菌株对亚硝酸盐降解能力
2.5 氯化钠对菌株生长的影响
由图5 可知,在不含氯化钠培养基中SW 菌株生长状况最好,随着盐浓度的升高,SW 菌株的生长速率逐渐减慢,当氯化钠浓度为15%时,SW 菌株的吸光值仅为0.57,同对照相比生长速率降低了53%。表明氯化钠会抑制菌株SW 的生长。
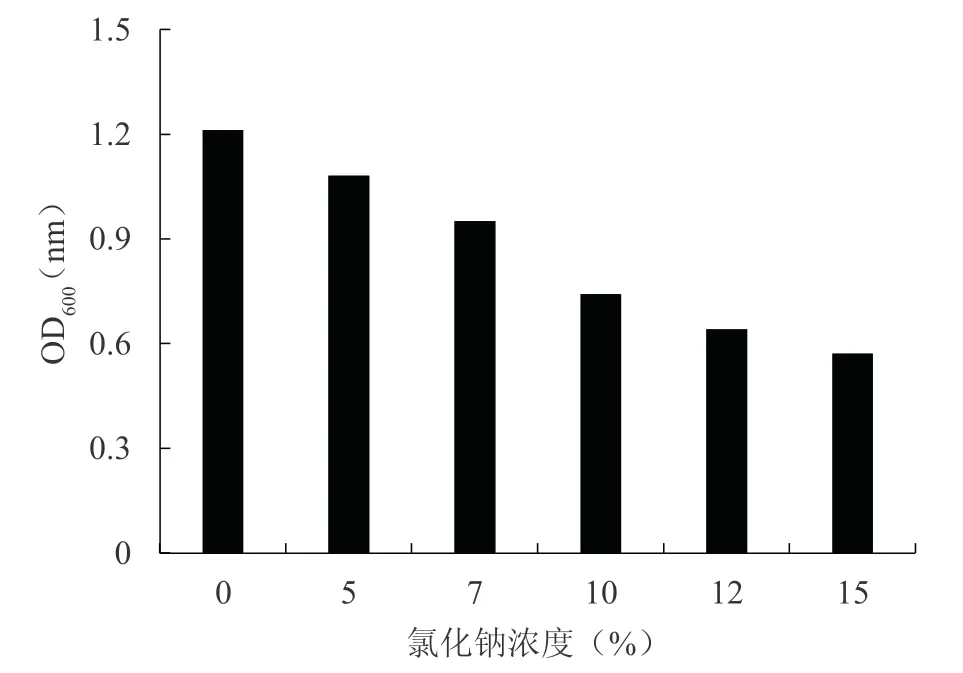
图5 不同氯化钠浓度菌株生长状况
3 结论和讨论
传统的菌种分离鉴定手段很难通过单一方式对菌株进行准确鉴定,随着现代生物技术的发展,分子生物学为研究微生物种类和组成提供一条准确、高效的技术手段。形态学特征结合rDNA 测序的分析鉴定方法已成为菌种分离鉴定的主要方式。卿煜维等[7]利用16s rDNA 序列鉴定了4 株亚硝酸盐降解乳酸菌。徐浩等[6]采用26s rDNA 测序法将分离的耐盐酵母菌鉴定为鲁氏接合酵母。潘睛等[8]在泡菜中基于通过16s rDNA 基因序列比较准确鉴定了从泡菜中分离的12 株乳酸菌。笔者在研究了SW 菌株形态特征的基础上,对其16s rDNA 基因进行测序,构建系统发育树,最终确定该菌株为植物乳杆菌。
剁辣椒发酵过程中,乳酸菌不仅可以降低发酵液pH 值,改善辣椒原始组织构造,同时还可促进其风味与色泽的形成。发酵液中的离子强度会随着发酵时间的延长而变化,为了抑制杂菌的生长,发酵液往往含有大量盐分,因此剁辣椒发酵过程中乳酸菌具有一定的耐盐性。李梓铭等[9]在盐坯辣椒中分离出一株可以在氯化钠含量为18%的培养基生长的植物乳酸杆菌。这是因为植物乳杆菌与其他乳酸菌相比具有较多的植物多酚降解基因,具有更强的适应环境胁迫的能力。叶陵等[2]比较植物乳杆菌与短乳杆菌后发现,植物乳杆菌具有较强的耐酸和耐盐能力。笔者从剁辣椒中分离的SW 菌株在盐胁迫条件下生长速率减慢,但在高盐环境中仍可以生长,说明该植物乳杆菌具有一定的耐盐能力。食品中硝酸盐或亚硝酸盐的含量过高,会造成高铁血红蛋白症,严重时可引发人体窒息死 亡[10]。乳酸菌对亚硝酸盐具有较强的降解能力,这主要归功于乳酸菌在代谢过程中产生乳酸和一系列酶,同时乳酸菌还具有抑制亚硝酸盐还原酶生长的功能。研究对分离的植物乳杆菌SW 进行亚硝酸降解试验发现,该菌株具有较强的亚硝酸盐降解能力。
