苯酚-硫酸法测定佛手瓜水溶性多糖的条件优化研究
2021-01-08黄凤柳
黄 丽,黄凤柳
(广东农工商职业技术学院 热带农林学院,广东 广州 510507)
佛手瓜,又名合掌瓜、拳头瓜、福寿瓜,是一种具有丰富营养价值和极高药用价值的绿色蔬菜[1].但由于其口感欠佳,限制了佛手瓜的推广,对佛手瓜进行深加工、延长产业链、增加附加值势在必行.近年来,针对佛手瓜的研究大多是初加工,目前已开发的产品有酸奶、果脯、蜜饯、蔬菜酒、果酱及腌制品等,但这些产品存在技术含量和营养附加值不高的缺点[2].佛手瓜富含多种活性物质,包括来自于叶子的抗氧化提取物、从种子中分离出的某些胰岛素抑制因子、乳汁中含有的植物凝集素、果肉中富含的果胶、黄酮以及对巨噬细胞功能有调节作用的生物活性多糖等[3-6].对佛手瓜中活性物质的提取及其相关产品的深加工日益成为国际研究热点和难点.其中多糖具有降血糖、降血脂、抗病毒等多种生物活性功能,备受人们关注,研究佛手瓜种多糖的提取,然后进行相应的深加工具有较强的应用价值.国外关于佛手瓜水溶性多糖的研究和探索多有报道[7-8].但是,国内关于佛手瓜多糖的研究尚处于初步阶段,相关提取工艺研究的报道目前只有热水浸提法[9]和超声波辅助法[10].两种方法均提取的是粗多糖,对多糖的纯化、结构和活性并没有进一步研究.因此,为了对以多糖为有效活性成分的佛手瓜原料和佛手瓜多糖产品的质量有一个比较和评判标准,研究佛手中瓜水溶性多糖含量测定方法具有一定的实际意义.
多糖含量的检测方法主要可以分为两类:一是高效液相或酶法,高效液相法需要昂贵仪器和多糖纯品,酶法则需要特定的酶,以上两种方法都是直接测定多糖本身,操作步骤均较繁琐.二是地衣酚-盐酸法、蒽酮-硫酸法、苯酚-硫酸法,这几种方法具有简便和快速的优点,但是,地衣酚-盐酸法因为所用试剂昂贵且用量大,不通用;蒽酮-硫酸法存在较严重的稳定性问题,容易被色氨酸含量较高蛋白质所影响,且重现性不好;关于多糖的含量测定大都采用苯酚-硫酸法,但该法也存在平行样品之间的吸光度相差较大、检测的重现性与准确性不好等缺点[11].因此,本研究从检测波长、样品添加顺序、试剂用量、显色测定条件等方面进行了苯酚-硫酸法测定佛手瓜中水溶性多糖的首次研究,并研究了其线性关系、精密度、稳定性和加标回收率等,以期得出苯酚-硫酸法测定佛手瓜中水溶性多糖含量的最佳测定条件,从而为佛手瓜中多糖提取以及利用活性物质进行佛手瓜的精深加工提供参考.
1 试剂与方法
1.1 材料与试剂
绿皮佛手瓜,购自增城中新镇超市;葡萄糖、苯酚、浓硫酸、石油醚、正丁醇、氯仿等试剂均为分析纯;数显恒温水浴锅(HH-4)、子华牌循环水真空泵(B-2-DⅡ)、布氏漏斗(实验室提供)、分光光度计(N723)、恒温烘箱(101-3)、高速粉碎机(SN-400)、高速离心机(广丰科技).
1.2 试验方法
1.2.1 材料的制备和溶液的配制
佛手瓜样品制备:佛手瓜去皮去核,切片,60 ℃烘箱中烘干,粉碎过80目筛即得.
佛手瓜多糖溶液配制:取适量佛手瓜样品用石油醚回流1 h去除脂肪,晒干样品,往烧杯中倒入脱脂后的样品,添加20倍质量的水,放入81 ℃恒温水浴锅中(需要保鲜膜包住烧杯,并不时搅拌),热水浸提138 min,抽滤得滤液.滤液中加入Servage试剂(滤液∶氯仿∶正丁醇=16∶4∶1),萃取去除蛋白及有机溶剂,将上清液转移到100 mL容量瓶中,稀释定容.
佛手瓜多糖粉末制备:重复佛手瓜多糖溶液配制过程的脱脂、水提、脱蛋白操作,往上清液中加入无水乙醇,使乙醇体积分数为80%,过夜醇沉12 h,离心,干燥至恒重即可得.
葡萄糖标准溶液配制:精确称取干燥至恒重的葡萄糖0.015 0 g于250 mL容量瓶中,加水至刻度,摇匀,即可得60 ug/mL的葡萄糖标准溶液.
1.2.2 苯酚-硫酸法测定佛手瓜水溶性多糖条件优化
(1)最大吸收波长的确定
分别吸取佛手瓜水溶性多糖溶液和葡萄糖标准溶液2 mL,以空白试剂为对照,加入6%苯酚1 mL,摇匀,加入浓硫酸5 mL摇匀,放置5 min,沸水浴15 min,取出后冷却到室温,在波长范围为400~600 nm内采用紫外可见分光光度计测定吸光度,记录其最大吸收值对应的波长.
(2)试剂添加顺序的确定
以空白试剂为对照,固定佛手瓜水溶性多糖溶液和试剂用量:佛手瓜水溶性多糖溶液2 mL(P),6%苯酚溶液1 mL(B),浓硫酸5 mL(N),改变样品添加顺序:PBN、BPN、BNP、NBP 、PNB,放置5 min,沸水浴15 min,取出后冷却到室温,测定吸光度,确定其样品添加顺序.
(3)试剂用量的确定
浓硫酸用量分别控制在 4.0,4.5,5.0 ,5.5,6.0,6.5 mL,以试剂空白为空白对照.测定吸光度,得出最适浓硫酸用量. 6%苯酚的用量分别控制在 0.7,0.8,0.9,1.0,1.1,1.2 mL,以试剂空白为空白对照.测定吸光度,得出最适苯酚用量.试验中苯酚应避光保存,防止苯酚被氧化影响显色效果.
(4)显色测定条件
显色温度分别控制在20、40、60、80 ℃,以试剂空白为空白对照.测定吸光度,得出最适显色温度.显色时间分别控制在5、10、15、20、25 min,以试剂空白为空白对照.测定吸光度,得出最适显色时间.
1.2.3 换算因子和多糖含量的计算
(1)葡萄糖标准曲线的绘制
分别吸取葡萄糖标准溶液0.4、0.8、1.2、1.6、2.0 mL于比色管中,加水至刻度,摇匀,即得12、24、36、48、60 ug/mL的葡萄糖标准使用液,以试剂空白为空白对照,根据上述试验优化的苯酚-硫酸法进行测定,绘制葡萄糖标准溶液曲线.
(2)换算因子的计算

式中:m佛手瓜多糖粉末的质量(mg),c备用液中佛手瓜多糖葡萄糖质量浓度(mg·mL-1),d备用液稀释倍数.
(3)水溶性多糖含量的计算
准确称取材料制备中干燥得到的佛手瓜样品10 g,脱脂、水提和脱蛋白,将萃取后得到的上清液定容,得到样品液,以空白试剂为对照,参照公式(2)来计算佛手瓜水溶性多糖含量.
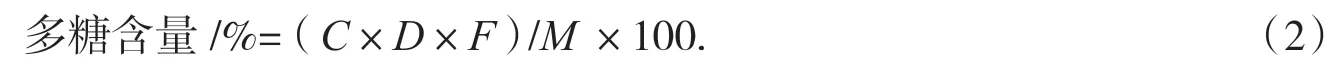
式中:C样品中葡萄糖质量浓度(ug·mL-1),D样品液稀释倍数,F换算因子,M佛手瓜的样品质量(g).
1.2.4 苯酚-硫酸法测定佛手瓜水溶性多糖方法学验证试验
(1)精密度试验
吸取5份佛手瓜水溶性多糖溶液2 mL,根据上述优化后的苯酚-硫酸法进行测定,重复测定5次,计算相对标准偏差RSD值(n=5),验证方法的精密度.
(2)稳定性试验
综上所述:脑卒中筛查中采纳颈动脉超声,可有效诊断出颈动脉狭窄程度及其血流参数,并分析其超声特征,值得临床信赖并进一步推广。
吸取1份佛手瓜水溶性多糖溶液2 mL,根据上述优化后的苯酚-硫酸法进行测定,每隔30 min测1次吸光度值,考察3 h内佛手瓜水溶性多糖的稳定性,计算RSD值(n=6),验证显色液及方法的稳定性.
(3)加样回收率试验
取5个比色管,分别加入1 mL佛手瓜水溶性多糖溶液和1 mL葡萄糖标准溶液,根据上述优化后的苯酚-硫酸法进行测定,计算加样回收率,计算RSD值(n=5).
2 结果与分析
2.1 苯酚-硫酸法测定佛手瓜水溶性多糖条件优化
2.1.1 最大吸收波长的确定
佛手瓜多糖在苯酚-浓硫酸作用下生成络合衍生物,其组分较单一,显色效果较好[13].佛手瓜多糖溶液和葡萄糖标准溶液在400~600 nm的波长范围内扫描结果如图1所示.由图1可知,佛手瓜多糖溶液和葡萄糖标准溶液均在485 nm处有最大吸收,确定最大吸收波长为485 nm.
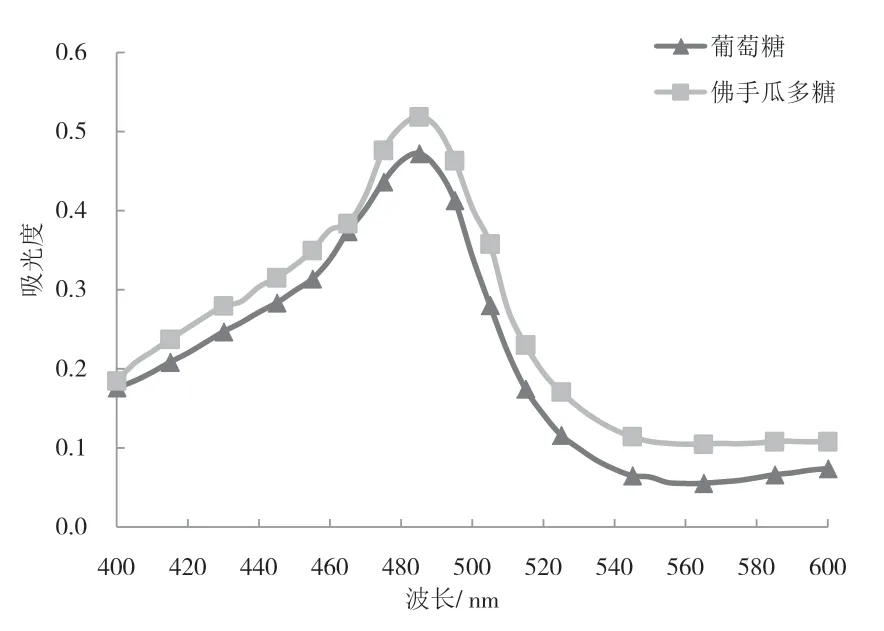
图1 最大吸收波长的确定
2.1.2 试剂添加顺序的确定
阴婉婷等人测定蛹虫草多糖含量研究时,改变浓硫酸及苯酚的加入顺序会使产物稳定,灵敏度提高,并具良好重现性[14].本文尝试改变试剂添加顺序研究其对吸光度值的影响,如图2所示.结果表明,吸光度按依次减弱的顺序为:PBN>BPN>BNP>NBP>PNB,因此,吸光度最大时试剂最佳添加顺序是PBN,即佛手瓜多糖溶液,苯酚,浓硫酸.这可能是因为浓硫酸的添加会快速水解多糖,所以要放在最后;而先加入苯酚会使反应更充分,所以要放在前面.
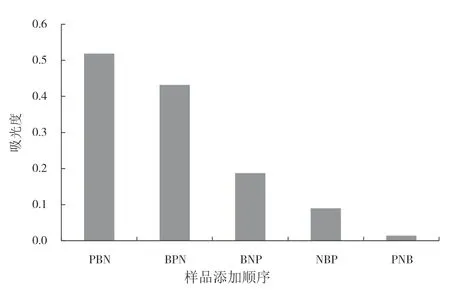
图2 样品添加顺序对吸光度的影响
2.1.3 试剂用量的确定
(1)浓硫酸用量
浓硫酸用量是反应显色过程的重要影响因素.图3为浓硫酸不同用量对吸光度的影响.结果表明,吸光度随浓硫酸用量的增加而不断提高,但超过5.5 mL后,随着浓硫酸用量的增加,吸光度反而下降,这可能是因为过量的硫酸导致显色物质的分解.因此,浓硫酸最佳用量为5.5 mL.
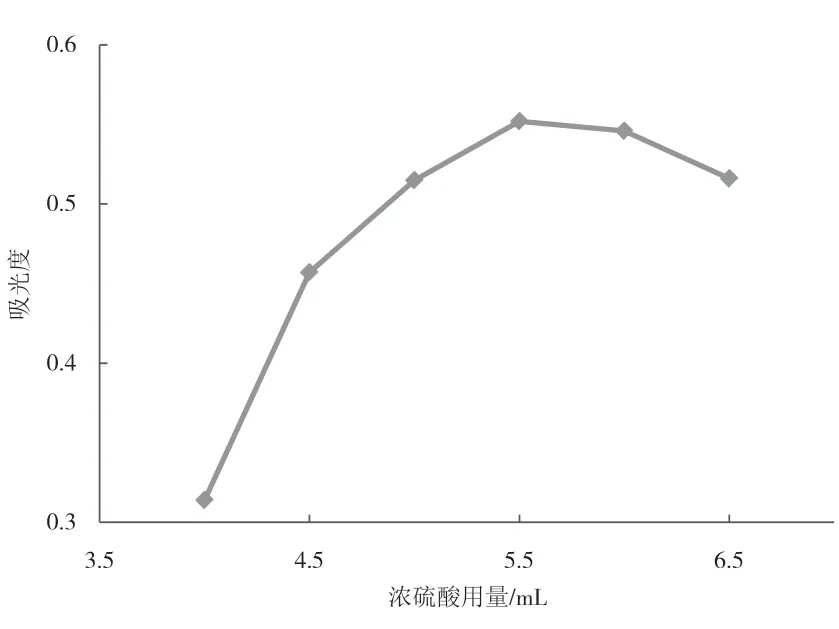
图3 不同浓硫酸用量对吸光度的影响
(2)苯酚用量
不同苯酚用量对吸光度值的影响如图4所示.结果表明,吸光度随着苯酚用量增加而增加,当苯酚用量0.9 mL时吸光度最大,0.9 mL之后吸光度值开始减小.该结果与张居作等人在进行苦瓜多糖苯酚-硫酸法的苯酚用量试验结果类似[15].这可能是因为随着苯酚用量的增加,浓硫酸会抢先跟苯酚反应,导致与佛手瓜多糖反应会减少.因此,苯酚最佳用量为0.9 mL.
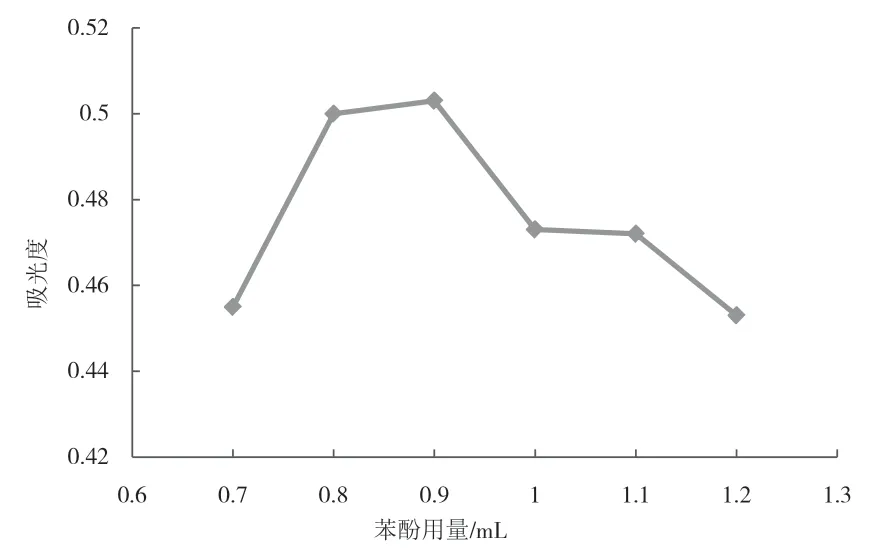
图4 不同苯酚用量对吸光度的影响
2.1.4 显色测定条件的确定
显色温度和时间会直接影响多糖的析出以及显色反应的程度.
(1)显色温度
图5为不同显色温度对吸光度值的影响.结果表明,温度在20~40 ℃之间,吸光度随着温度的升高而升高,当温度达到40 ℃时,吸光度最大,大于40 ℃时吸光度开始减小.这可能是因为温度低显色反应速度变慢,而温度升高到佛手瓜多糖保护温度40 ℃及以上,佛手瓜水溶性多糖活性结构又会遭到破坏.因此,最佳显色温度为40 ℃.
(2)显色时间
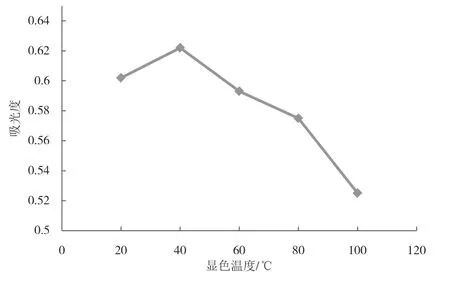
图5 不同显色温度对吸光度的影响
不同显色时间对吸光度值的影响如图6所示.结果表明,显色时间5 min时,吸光度最大.当显色时间继续增加时,吸光度开始降低,这可能是因为显色时间过长导致橙色复合物发生了分解.因此,最佳显色时间为5 min.
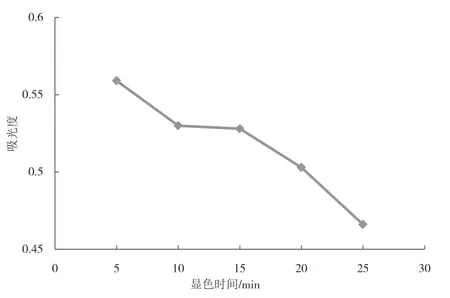
图6 不同显色时间对吸光度的影响
2.2 苯酚-硫酸法测定佛手瓜水溶性多糖换算因子和多糖含量的计算
2.2.1 葡萄糖标准曲线的绘制
以葡萄糖质量浓度为横坐标,吸光度为纵坐标,绘制吸光度-葡萄糖质量浓度的关系曲线,如图7所示.结果表明,线性回归方程y= 0.016 7x-0.079 0,R2为0.999 1,相关系数为0.999 5.线性关系良好.
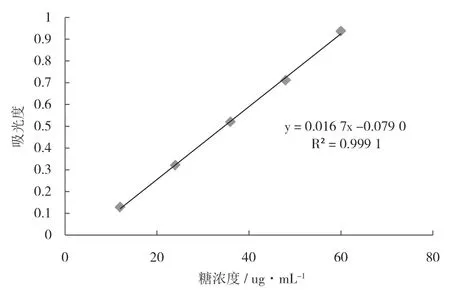
图7 葡萄糖标准曲线
2.2.2 换算因子和多糖含量的计算结果
本试验利用佛手瓜中的水溶性多糖来计算换算因子,避免了用葡萄糖做标准引起的系统误差,而且因为组成上与待测样品最接近,结果会比较接近真实值.为了提高苯酚-硫酸法的准确性,目前多糖含量测定时大多采用校正系数或换算因子的方法[16].本试验对3次备用液的吸光度进行了平行测定,吸光度平均值0.576,按公式(1)计算得到换算因子F=2.55.
试验中对3次样品液的吸光度进行平行测定,吸光度的均值为0.436,试验中对样品液进行了800倍的稀释,代入换算因子,按公式(2)计算得到佛手瓜水溶性多糖的含量为0.629 1%.
2.3 苯酚-硫酸法测定佛手瓜水溶性多糖方法学验证试验
2.3.1 精密度试验结果
为确定试验的精密度,在上述优化后的条件下,对显色反应进行精密度试验. 5次吸光度测定的结果分别为0.430,0.442,0.401,0.437,0.428,RSD=3.71%,显示优化后的苯酚-硫酸法精密度良好.
2.3.2 稳定性试验结果
为确定试验的稳定性,在上述优化后的条件下,对显色反应进行稳定性试验.显色液在0.5 h时的吸光度值为0.424,显色液在3 h时的吸光度值为0.425,稳定性试验中RSD=0.08%,结果表明,显色液在3 h内稳定性良好.因此,优化后的苯酚-硫酸法稳定性良好.
2.3.3 加样回收率试验结果
按照样品测量方法,在上述优化后的条件下,对显色反应进行加样回收率试验.如表1所示,平均回收率为110.1%,RSD为1.52%.结果表明,优化后的苯酚-硫酸法加样回收率较高.
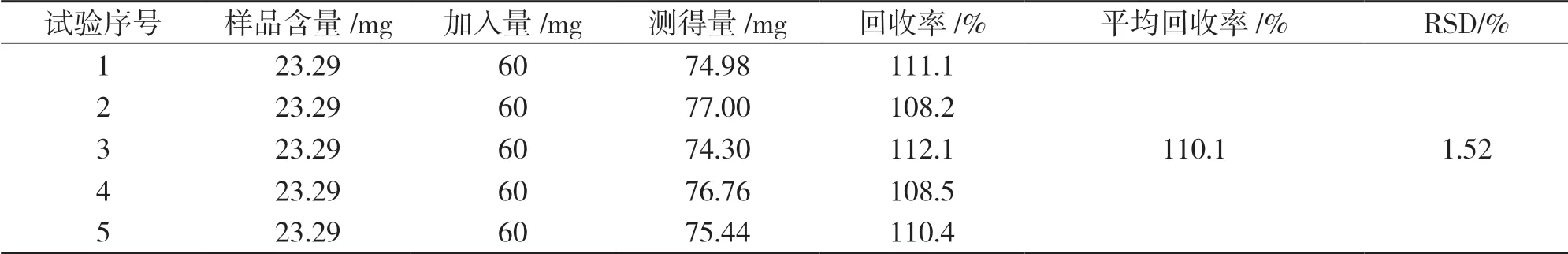
表1 加样回收率试验结果
3 结论
苯酚-硫酸法测定佛手瓜水溶性多糖含量最佳测定条件是:最大吸收波长485 nm;试剂最佳添加顺序:多糖溶液,苯酚,浓硫酸;试剂最佳用量:浓硫酸5.5 mL,苯酚0.9 mL;显色测定最佳条件:温度40 ℃,显色时间5 min.回归方程为y=0.016 7x-0.079 0,相关系数为0.999 5.该方法平均回收率110.1%,RSD1.52%,显色液在3 h内稳定性良好.苯酚-硫酸法是测定佛手瓜中水溶性多糖含量的一种高稳定性和高回收率的方法,为将来利用活性物质进行佛手瓜的精深加工打下基础,同时具有很高的实际应用价值.
