乌骨鸡肠乳杆菌的分离鉴定及体外抑菌试验
2021-01-08刘小兰邓舜洲康绍珠刘可心钟霆霆黄靖文朱芝秀
刘小兰,邓舜洲,康绍珠,曹 刚,高 蕊,刘可心,钟霆霆,黄靖文,朱芝秀
(江西农业大学动物科学技术学院,江西南昌 330045)
【研究意义】20世纪40年代以来,在饲料工业及养殖业生产中,抗生素饲料添加起到了不容置疑的重大作用[1]。然而,长期使用抗生素所引起的药物残留及毒害作用又给人类的健康带来了潜在的威胁[2]。因而寻找一种无残留、无毒害、无耐药性的饲料添加剂来替代抗生素用于畜牧业生产便愈来愈受到重视[3]。乳酸菌(Lactic acid bacteria,LAB)是指一群可发酵碳水化合物、发酵时产生大量乳酸的革兰氏阳性球菌或杆菌的统称[4]。乳酸菌是定居在肠道中的一类有益菌群,在健康人畜的肠道中,各种细菌的种类、数量和定居部位是相对稳定的,它们相互协调,互相制约,共同形成一个微生态系统[5]。乳酸菌作为微生态饲料添加剂在畜牧行业中的应用越来越广泛,其具有安全、绿色、无污染、无残留等特性,是抗生素的理想替代品[6]。【前人研究进展】乳酸菌具有抗氧化、抑菌、耐药性等作用。梁晓明等[7]试验发现副干酪乳酸菌产生的有机酸对致病弧菌有显著的抑制作用。朱建宁等[8]从牦牛中分离出的乳酸菌能抑制大肠杆菌的生长。李宏伟等[9]从乌骨鸡肠道内容物中分离到植物乳杆菌菌株、短乳杆菌菌株对猪霍乱沙门氏菌有明显的抑制作用。Yang等[10]饲喂了乳酸菌饲料的仔猪腹泻率显著降低,证明了乳酸菌作为益生菌的实用性。高畅等[11]通过研究发现富硒乳酸菌中药制剂可以大大提高育肥猪免疫能力和血清及组织的抗氧化能力。乳酸菌还具有改善动物的肠道健康、提高肉品质的作用。Wang等[12]在日粮中添加微囊化植物乳杆菌(MLP)和低聚果糖(FOS)组成的合生素,提高猪的平均日增重和平均日采食量。Lojanica等[13]给断奶仔猪口服干酪乳杆菌和粪肠球菌等的复合制剂,结果表明仔猪平均日增重显著增加。Genis等[14]给产犊前奶牛的阴道内注射两次乳酸菌后,子宫炎患病率降低至58%。Zhang等[15]报道,在日粮中添加微囊化乳酸菌可显著提高肉鸡生长性能和免疫功能,并且可以改善盲肠微生物群落,调整肉鸡的健康状况。【本研究切入点】为了获得益生效果良好的优势乳酸菌,本试验通过对乌骨鸡肠道黏膜组织进行细菌分离及体外抑菌试验,旨在寻找能在禽类生产实践中替代抗生素的乳酸菌,提高乌骨鸡生产性能,减少抗生素的使用率。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 乌骨鸡:体质量1.5~2.0 kg,由南昌乌骨鸡养殖场提供;试验小白鼠:健康雄性6周龄的BALB/c小白鼠,体质量18~22 g,由南昌大学医学院动物试验中心提供。
1.1.2 病原菌 大肠杆菌、沙门氏菌、链球菌等病原指示菌由江西农业大学动科院预防兽医教研室保存。
1.1.3 主要仪器 COCI光学显微镜,购自重庆光学仪器厂公司;立式自动电热蒸气灭菌器,购自上海申安医疗器械厂公司;电热恒温培养箱,购自上海跃进科学仪器厂公司;PCR仪、电泳仪,购自Bio−Rad公司。
1.1.4 主要试剂 MRS培养基、伊红美蓝培养基、麦康凯培养基、革兰氏染色剂,均为自行配制;药敏纸片、微量生化发酵管,均购自杭州微生物试剂有限公司。
1.2 试验方法
1.2.1 细菌的分离鉴定 (1)细菌的分离培养与纯化。样品的采集与处理:将健康乌骨鸡解剖,取出其肠道,用生理盐水冲洗肠道,刮取小肠黏膜组织,取1 g黏膜组织加5.0 mL生理盐水制作组织悬浮液。细菌的分离培养与纯化:取组织悬浮液至MRS液体试管(100µL/支),37 ℃扩增培养24 h后,10倍递减稀释至10−6,挑选10−4、10−5稀释液涂抹改良MRS固体培养基,37 ℃摇床振荡(200 r/min)培养24 h,挑取有溶钙圈的菌株革兰氏染色镜检,再次划线接种纯化,4 ℃保存备用。分离菌的生长特性:将分离菌接种MRS液体培养基,37 ℃摇床培养72 h,每隔12 h取样2份;1份测定OD值(600 nm),以时间为横坐标,OD值为纵坐标,绘制生长曲线图;另1份测定pH值,以时间为横坐标,pH值为纵坐标,绘制pH值变化曲线图。分离菌的产酸特性:将分离菌点种于溴甲酚紫蛋白胨培养基,置于37 ℃温箱培养24 h,观察菌落产酸圈的大小。分离菌对胃蛋白酶、猪胆盐的耐受性:将分离菌接种到3组MRS液体培养基,37 ℃摇床培养24 h后,第一试验组调整pH值为3后加入胃蛋白酶(5 mg/mL)处理,第二试验组加入0.1%猪胆盐处理,第三组为空白对照组,均放入37 ℃摇床继续振荡培养30 min后取出,按10倍梯减法稀释至10−7,取1 mL稀释液涂布于MRS固体培养基,37 ℃静置培养24 h后,进行菌落计数,根据下式计算存活率:

分离菌的微量生化特性:参照文献[16−17],将分离菌分别接种阿拉伯糖、七叶苷等微量生化反应管中,37 ℃静置培养24 h后,比对《伯杰氏细菌鉴定手册》[18]与《常见细菌系统鉴定手册》[19],初步鉴定分离菌的种属。
(2)分离菌16S rDNA分子生物学鉴定。挑取分离菌单个菌落于MRS液体培养基中,振荡培养48 h,菌体经变性处理后,12 000 r/min,离心10 min,取上清液为模板,利用16S rDNA通用测序引物16S−F:5′−AGAGTTTGATCTGGCTCAG−3′,16S−R:5′−TACGGTACCTTGTTACGACTT−3′,进行PCR扩增[20]。PCR扩增体系:ddH2O 37.5 µL、10×TransTaqHiFi Buffer 5µL、dNTPs(2.5 mmol/L)4 µL、DNA模版2.0 µL,TransTaqHiFi酶0.5µL、上游引物16S−F 0.5µL、下游引物16S−F 0.5µL,共50µL。PCR扩增程序:94 ℃预变性10 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1.5 min。共35个循环,最后72 ℃再延伸10 min。PCR扩增产物在EB染色后的15 g/L琼脂糖凝胶上进行电泳检测(96 v电压下电泳30 min),取岀凝胶于凝胶成像系统观察结果并拍照。将PCR产物送至湖南擎科生物技术有限公司测序,测序结果用美国国立生物技术信息中心(NCBI)的Blast进行序列在线比对分析,确定菌种名。
1.2.2 分离菌的体外抑菌试验 (1)分离菌的药敏试验。依据琼脂扩散法[21]对分离菌进行药敏试验。将分离菌培养液均匀涂抹于MRS固体培养基,用眼科镊按梅花状将试纸轻贴于其上,37 ℃培养24 h后,测量抑菌圈直径。
(2)分离菌体外抑制试验及影响因素。分离菌的抑菌谱:将分离菌分别接种MRS液体培养基,37 ℃摇床振荡培养3 d。依据牛津杯法[22]评价分离菌的抑菌活力,分别进行大肠杆菌、沙门氏菌、链球菌等病原指示菌的体外抑菌试验。温度对分离菌发酵液的影响:将WJ2−6发酵液分别于60,80,100 ℃下水浴20 min,再进行对金黄色葡萄球菌的体外抑制试验。pH值对分离菌发酵液的影响:将WJ2−6发酵液pH值分别调至3.0、4.0、5.0、6.0、7.0,再进行对金黄色葡萄球菌的体外抑制试验。
蛋白酶对分离菌发酵液的影响:将WJ2−6发酵液中分别加入胃蛋白酶(每5 mL 0.2 g)和胰蛋白酶(每5 mL 0.2 g),水浴温育2 h,设置空白WJ2−6发酵液为对照组,再进行对金黄色葡萄球菌的体外抑制试验。
1.2.3 动物安全性试验 将试验小白鼠分为4组,每组5只,第4组为对照组。试验组连续灌服对应的3株分离菌株,每只灌服0.5 mL,2次/日;对照组服喂等量的0.85%生理盐水。观察小鼠的状态,试验时间为2周。
2 结果分析
2.1 细菌的分离鉴定
2.1.1 细菌的分离培养与纯化 分离纯化得到3株菌株,分别编号为WJ2−1、WJ2−6、WJ2−7,分离菌在MRS固体培养基上菌落形态一致,呈圆形、微隆起、有明显的溶钙圈(图1),革兰氏染色镜检均为革兰氏阳性单杆菌(图2)。

图1 分离菌菌落形态Fig.1 Morphology of isolated bacteria

图2 分离菌染色镜检(10×100)Fig.2 Microscopic examination of isolates(10×100)
2.1.2 分离菌的生理、生化特性 分离菌的生长特性:分离菌生长曲线(图3实线)所示,分离菌于6 h左右进入对数生长期;24~60 h进入稳定期。分离菌发酵液pH值变化情况(图3虚线):6~16 h发酵液pH值逐渐下降,24 h后处于稳定状态。
分离菌的产酸特性:分离菌在溴甲酚紫蛋白胨培养基上形成黄色产酸圈(图4),测得分离菌直径大小分别是WJ2−1为18.74 nm、WJ2−6为20.39 nm、WJ2−7为20.33 nm。

图3 WJ2−7生长曲线和pH值变化Fig.3 Growth curve and pH change of WJ 2−7

图4 分离菌产酸圈Fig.4 Acid production circle of isolated bacteria
分离菌对胃蛋白酶、猪胆盐的耐受性:分离菌经胃蛋白酶处理后,存活率=5.88×106/9.8×106=60%;分离菌经猪胆盐处理后,存活率=2.058×106/9.8×106=21%。
分离菌的微量生化特性:分离菌均能分解乳糖、蔗糖甘露糖、七叶苷等,不分解木糖、阿拉伯糖等。M−R试验为阳性;精氨酸水解酶、精氨酸脱羧酶、鸟氨酸脱羧酶、赖氨酸脱羧酶、H2S、氧化酶、V−P等均为阴性(表1)。

表1 分离菌株的生理生化结果Tab.1 Physiological and biochemical results of isolated strains
2.1.3 分离菌16S rDNA分子生物学鉴定 PCR产物在15 g/L琼脂凝胶上的电泳结果见图5,WJ2−1、WJ2−6、WJ2−7与2株唾液乳杆菌阳性对照均扩增出约为1 500 bp大小的目的片段;扩增后的PCR产物送至湖南擎科生物技术有限公司测序,测序结果在NCBI数据库比对,分离菌与唾液乳酸杆菌(Lactoba⁃cillus salivariusstrain)同源性最高(图6);从GenBank中挑选13株乳酸杆菌属菌株,利用MEGA7.0软件的Clustal W算法进行多序列比对并构建系统发育树,结果见图7。其中WJ2−1、WJ2−6、WJ2−7与菌株NR028725.2、NR112759.1亲缘关系最近,与菌株NR112758.1、NR042442.1亲缘关系最远(图7)。
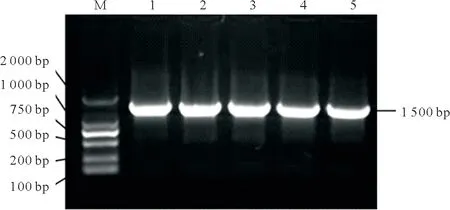
图5 分离菌16S rDNA扩增电泳图Fig.5 Isolation bacteria 16S rDNA amplification electrophoresis
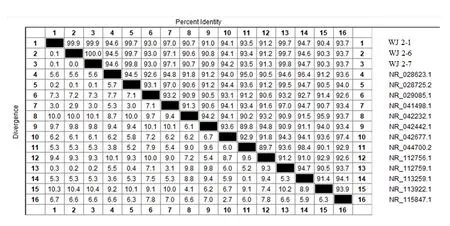
图6 分离菌16S rDNA基因序列同源性图Fig.6 16S rDNA gene sequence homology of isolates
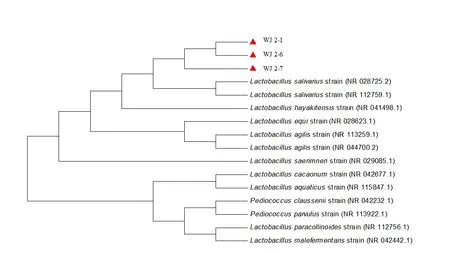
图7 分离菌16S rDNA基因系统发育树Fig.7 Isolation strain 16S rDNA gene sequence phylogenetic tree
2.2 分离菌体外抑制试验
2.2.1 分离菌药敏试验 分离菌对新生霉素等高度敏感,对诺氟沙星等耐药(表2)。

表2 分离菌药敏试验结果Tab.2 Drug sensitivity test resultsmm
2.2.2 分离菌体外抑菌试验及影响因素 分离菌抑菌谱:分离菌对大肠杆菌、沙门氏菌、链球菌、巴氏杆菌等病原指示菌均具有较强的抑制作用,具体结果见表3,图8~10。
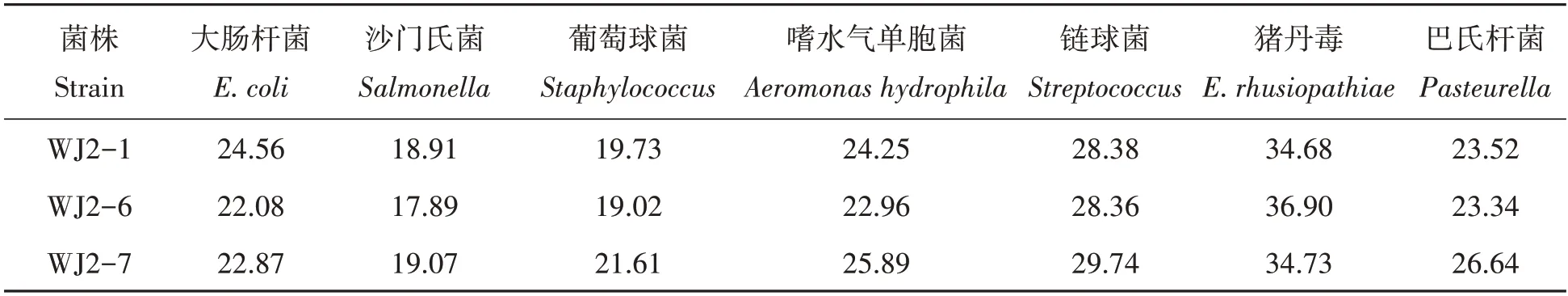
表3 分离菌体外抑菌试验结果Tab.3 In vitro antibacterial test results of isolated bacteriamm

图8 大肠杆菌抑菌圈Fig.8 Bacteriostatic ring of Escherichia coli

图9 葡萄球菌抑菌圈Fig.9 Bacteriostatic ring of Staphylococcus

图10 嗜水气单胞菌抑菌圈Fig.10 Bacteriostatic ring of Aeromonas hydrophila
温度对分离菌发酵液的影响:随着温度的提高,分离菌发酵液抑菌活性变化不大(图11);pH值对分离菌发酵液的影响:分离菌发酵液有较强的抑菌活性,但随着pH值增加至7时,分离菌发酵液抑菌活性下降至0(图12);蛋白酶对分离菌发酵液的影响:分离菌发酵液经胃蛋白酶、胰蛋白酶处理后,抑菌活性基本不变(图13)。

图11 分离菌发酵液耐热性结果Fig.11 Heat resistance results of the fermentation broth of isolates

图12 分离菌发酵液耐酸性结果Fig.12 Acid resistance results of the fermentation broth of isolates
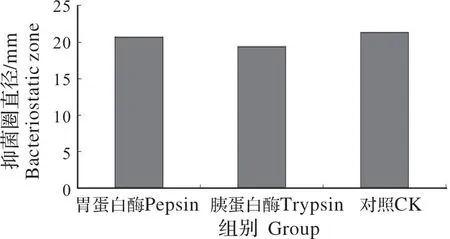
图13 分离菌发酵液酶稳定性结果Fig.13 Enzyme stability results of the fermentation broth of isolates
2.3 动物安全性试验
4组小鼠均无一死亡,均采食正常,精神良好。说明分离到的3株唾液乳酸杆菌安全可靠。
3 讨论
乳酸菌具有安全、提高动物生产性能、增强免疫力等益生特性,在生物体的肠道中,它作为优势群体,能产生多种有机酸及代谢产物,能够有效抑制病原菌的生长繁殖[23],维护动物的健康。从动物肠道中分离筛选乳酸菌是一个较佳选择[24],本试验从乌骨鸡肠道黏膜分离到3株乳酸菌,分离菌的菌落形态与杨红亚等[25−27][报道一致;生化试验结果,与杨俊俊[28]和孔璨等[29]报道的发酵葡萄糖等,不发酵木糖、阿拉伯糖等结果基本一致。经16S rDNA基因序列比对,与唾液乳酸杆菌的同源性最高,相似性高达99%,经序列系统进化树分析可得分离菌WJ2−1、WJ2−6、WJ2−7与唾液乳酸菌株NR028725.2、NR112759.1的亲缘关系最近。综合分离菌的培养染色形态,生理生化特性与基因测序分析确定分离菌为唾液乳酸杆菌。
乳酸菌是一种能定植于动物机体胃肠道内,改善胃肠道内的微生态环境的益生菌,它可以通过调节宿主微生态平衡来达到益生的作用,在畜牧生产中有极高的应用前景,找到有独特优势的乳酸菌则极为重要。本试验分离的乳酸菌生长迅速,溶盖圈明显,产酸能力强,在溴甲酚紫蛋白胨培养基上可以形成18~20 nm的黄色产酸圈。分离菌耐胃蛋白酶,有60%存活率,能抵御体外模拟的胃肠道逆环境的影响;分离菌抑菌谱广,能抑制大肠杆菌、沙门氏菌、葡萄球菌、嗜水气单胞菌、链球菌、猪丹毒丝菌、巴氏杆菌等多种病原菌的生长,与刘小兰等[30]和何轶群[31]报道一致;抑菌效果好,抑菌圈直径较大,抑菌效果不受温度、蛋白酶的影响,具备成为益生菌的优势条件。分离菌可与诺氟沙星等药物配合用药,不可与头孢曲松、新生霉素等药物配合使用。分离菌灌喂小鼠均无一死亡,精神良好,确定分离到的3株唾液乳酸杆菌安全可用。
