寺河矿15号煤层中产氢产乙酸微生物的富集和群落结构研究
2021-01-08元雪芳段月岚MohamedKeita2MartialLePrinceEssengueSamboukel
肖 栋 元雪芳 段月岚 李 进 Mohamed Keita,2Martial Le Prince Essengue Samboukel,2 何 环
(1. 中国矿业大学煤炭资源与安全开采国家重点实验室,江苏省徐州市,221116;2. 中国矿业大学矿业工程学院,江苏省徐州市,221116;3. 煤与煤层气共采国家重点实验室,山西省晋城市,048000;4.徐州市第一人民医院,江苏省徐州市,221116;5.中国矿业大学化工学院,江苏省徐州市,221116)
微生物法煤炭气化开采是煤炭流态化开采技术方法之一[1]。伴随采矿深度的增加,地温升高、地压增大,以及煤层水文地质条件复杂[2]、煤炭运输成本增加等难题成为限制超深煤层开采的关键影响因素[3]。
煤层微生物的活动需要温度较高、物质丰富的水资源,且微生物的耐压能力较强[4],这使得煤炭生物气化技术能够极好地适应超深煤层地质条件[5];所以利用微生物对煤中有机质进行降解,在地下煤层中可将固态资源转化为气态资源[6]。而且,煤炭气化开采能够解决固态煤炭运输成本高的难题。因此,煤炭生物气化的技术发展可以为超深煤层常规开采难的问题提供一种有效的技术解决方法。
产甲烷微生物菌群是实现煤炭微生物气化的关键菌群[7],当前产甲烷菌群对煤的降解关键特征、生物群落结构[8]、菌群的培育与诱导方法等研究相继展开[9]。研究结果表明,多数煤地质产甲烷菌以乙酸发酵型产甲烷菌为主,部分煤层伴有二氧化碳还原性菌种[10]。关于对乙酸代谢途径的煤的生物降解特征研究证实,煤炭发酵过程是由水解菌群、发酵菌群、产乙酸菌群和产甲烷菌群等功能性微生物类群共同作用完成[11]。
产乙酸菌是自然界普遍存在的一类微生物,主要以水溶性糖类物质、蛋白质水解产物、小分子酸、醇类等碳水化合物为碳源[12],通过生物代谢产生乙酸的微生物。乙酸菌的代谢特点是以质子作为唯一的电子受体,所以进行的大多数氧化反应在标准热力学状态下是吸能的[13],该菌种的生长需要较高的环境温度,其代谢产物的集聚对菌群的生长和代谢具有抑制作用[14]。在产甲烷菌群系统中,产甲烷菌和硫酸盐还原菌与产乙酸菌形成共生关系[15],并且在营养传递链中产甲烷菌和硫酸盐还原菌位于产乙酸菌之后,它们对乙酸的消耗降低了乙酸聚集对乙酸菌的抑制作用[16]。共生关系对保持煤层地质产甲烷菌群中乙酸菌的活性能够起到至关重要的作用,由此,煤层地质微生物群中产乙酸特征菌属的多样性研究为进一步开展煤层地质产甲烷微生物群落代谢途径与代谢组学研究具有重要的指导意义。
1 材料与方法
1.1 实验菌群和煤样
本项研究所采用的产甲烷菌群取自山西晋城无烟煤矿业集团有限责任公司寺河矿。矿区位于沁水煤田东南边缘,矿井面积约为230 km2,南北走向长约为12 km,东西倾斜宽约为23 km,地质储量为15亿t。井田主采煤层分为3号、9号和15号煤层,总厚度为10.32 m。煤种为低硫、低-中灰、高发热量、高机械强度的无烟煤[17]。其中,15号煤层已证实存有休眠状态的产甲烷微生物群,并成功利用该煤层菌群实现煤的生物气化试验[18]。本次实验用菌群来自15号煤层,取掘进头新揭露块状煤样为本次实验富集菌群所需样品,煤样采集一是取块体短边不小于150 mm,二是取样位置未受注水等作业影响,三是煤样需从新揭露煤壁采用掏槽法取样,四是取样过程避免供风直吹、水淋、肢体直接接触等环境污染。新取煤样快速置入无菌自封袋,并采用氮气吹扫,减少煤样与空气接触、保持煤样处于厌氧状态。煤块在实验室氮气保护下破碎,块体粒度为5~10 mm,破碎后的块体采用氮气保护并置于4 ℃的冷藏箱中待用。
1.2 培养基配置与实验装配
实验中设置了3种培养基,分别是牛肉膏蛋白胨培养基(BP:牛肉膏为3 g/L、蛋白胨为10 g/L、NaCl为10 g/L)[15]、马铃薯淀粉葡萄糖培养基(PSG:马铃薯淀粉为200 g/L、葡萄糖为20 g/L、酵母抽提物为0.5 g/L)[19]、葡萄糖小分子酸培养基(GSMA:葡萄糖为20 g/L、酵母抽提物为0.5 g/L、甲酸钠为6.8 g/L、乙酸钠为8.2 g/L)。3种培养基各配置1200 mL,配置好的培养基用0.1 mol/L的NaOH调节pH至7.0。
BP培养基是一种应用十分广泛的天然培养基,在前期试验中该培养基能够成功对煤层产甲烷菌群实现活化[18]。BP培养基中的牛肉膏能够为微生物提供碳源、磷酸盐和维生素,蛋白胨主要提供氮源和维生素,NaCl提供无机盐;PSG培养基以PDA培养基为基础去除琼脂组分后完成配置,其中马铃薯淀粉为微生物提供碳源和多种营养,葡萄糖提供碳源、酵母提取物提供微量元素与生长因子[19];GSMA培养基由葡萄糖提供主要碳源,酵母提取物提供微量元素与生长因子,乙酸盐和甲酸盐模拟乙酸菌代谢产物,提高溶液中代谢产物浓度,增加干扰设置,培养基配置中,甲酸钠与乙酸钠采用相同的摩尔浓度配置(0.1 mol/L)。每升培养基中加入W/V 为0.1%的刃天青1 mL作为厌氧指示剂,该指示剂在氧化还原电位为100 mV以上时显示蓝色,随着氧化还原电位的降低,逐渐转为淡粉色,当氧化还原电位达到-40 mV以下时显示无色[20]。配置好的培养基采用上海申安医疗器械厂生产的型号为LDZF-75KB立式压力蒸汽灭菌器进行灭菌,BP培养基采用1.05 kg/cm2的压力,在121℃和20 min内灭菌2次,PSG培养基和GSMA培养基采用1.05 kg/cm2的压力,在111℃和20 min内灭菌2次(温度设置为111℃是为了防止葡萄糖高温分解)。灭菌后培养基采用氮气保护冷却至室温,移至英国DWS公司生产的型号为DG500的厌氧培养箱中备用。
实验采用500 mL的血清瓶为培育器皿。将21个灭菌后的血清瓶进行标记,然后根据标记分别在厌氧培养箱中分装3种培养基,每瓶200 mL。每种培养基设置5个平行样、2个无菌样。3种培养基的5个平行样中添加煤块5.0±0.1 g,厌氧培养箱中用基丁胶塞密封,并用铝盖封口。装配完成的试样放入恒温震荡培养箱内40℃避光培养,震荡速度设置为80 rpm。
1.3 产乙酸菌群产气和产酸特征分析
实验中采用注射器对各实验样品的产气量进行周期测定,容积产气率见式(1):
(1)
式中:VLRin——第i个培养单元第n次容积产气率,L/(L·d);
Vin——1 atm条件下第i个培养单元第n次测试产气总体积,mL;
Vvi——第i个培养单元培养基总量,mL;
Tin——第i个培养单元第n次测试时的时间点,h;
Ti(n-1)——第i个培养单元第n-1次测试时的时间点,h。
排出混合气样中的H2、CO2和CH4含量测定采用安捷伦7890A气相色谱仪进行,色谱柱为Agilent Carbonplot(60 m×320 μm),载气为高纯氮气(99.999%),填充柱进样口温度为150℃,隔垫吹扫流量为3 mL/min,进样量为500 μL,柱箱温度为25℃,保持7.5 min,采用TCD检测器检测温度为200℃,参比流量为400 mL/min,尾流量为8 mL/min。H2的出峰时间为3.2 min,CH4的出峰时间为3.7~4 min,CO2的出峰时间为4.4 min。
甲酸、乙酸、丙酸等挥发性小分子酸采用气相色谱-质谱联用仪测定,该设备由安捷伦7890A气相色谱仪与5975C质谱仪组成。色谱柱采用VF-WAXms色谱柱柱(30 m×250 μm×0.25 μm)。程序升温设置如下:初始温度为80℃,以10℃/min的速率升温至100℃后保持3 min,以15℃/min升温至150℃后保持5 min,再以运行温度为250℃保持5 min。进样口为无分流模式,温度为280℃,吹扫速率为15 mL/min,吹扫时间为0.2 min。载气为99.999%的高纯度氦气,柱流速为1.0 mL/min。
BP、PSG培养基中小分子酸测试时,混合标样中3种酸的质量比如下:甲酸∶乙酸∶丙酸=1∶1∶1。测试中首先对标样进行测试,得到不同酸的出峰时间和峰高,获得3种小分子酸的线性关系,然后测试样品。
GSMA培养基中小分子酸测定时,混合标样设计为“3种酸+2种盐”,质量比∶甲酸∶乙酸∶丙酸∶甲酸钠∶乙酸钠=1∶1∶1∶1∶1。测试中首先对标样进行测试,得到不同酸以及盐的出峰时间和峰高,获得不同酸与盐的线性关系,然后测试样品,以排除培养基中甲酸钠和乙酸钠对测试结果的影响。
1.4 淀粉与还原糖检出测定
采用碘-碘化钾溶液检测培养基中是否含有淀粉。稀释后的碘-碘化钾溶液与淀粉作用时,会形成碘化淀粉,并呈蓝色的特殊反应,淀粉的水解物糊精遇碘变红。测试时,用移液器于各平行样取培养液1 mL加入小试管,滴入标准碘-碘化钾溶液,根据变色反应,测定培养基中是否含有淀粉。
采用本尼迪特试剂测定培养基中是否含有还原糖。还原糖环境中,本尼迪特试剂中的CuSO4中的Cu2+被还原成Cu+,并以Cu2O的形式沉淀出来。如果溶液中还原糖含量较低,产生的Cu2O相应减少,试验后会出现绿色、混浊的黄色或橙色沉淀物。测试时,用移液器于各平行样取培养液2 mL加入小试管,加入1 mL标准本尼迪特试剂,摇匀后将此混合物在沸水中加热,反应时间3 min。根据变色反应,测定培养基中是否含有还原糖(葡萄糖等)。
1.5 产乙酸菌群的群落结构分析
产气产酸实验中,每种培养基平行样各抽取10 mL混合后至于100 mL无菌离心管中,以此每种培养基共获取50 mL菌液作为菌样。利用冷冻离心机12000×g离心10 min,倒掉上清液,收集离心管内的菌沉淀在温度为-20℃的条件下冻存用于提取DNA。DNA提取方法采用宝生物工程(大连)有限公司水样DNA提取试剂盒提取方法进行,检测委托上海美吉生物科技有限公司完成。收集的菌样用小型珠磨式研磨器破碎,经SDS与Proteinase K消化、酚-氯仿抽提、异丙醇沉淀、75%乙醇洗涤沉淀后,加入灭菌双蒸水溶解沉淀得到微生物总基因组DNA。0.7%的琼脂糖凝胶电泳检测提取基因组DNA 的长度及完整性。
提取的基因组DNA作为模板进行细菌16SrRNA 基因V1-V3 区片段的扩增。PCR扩增引物采用21F、1492R(21F:5′-TTCCGGTTGATCCTGCCGGA-3′、1492R:5′-TACGGCTACCTTGTTACGAC-3′)。扩增条件为94℃预变性5 min,随后以94℃,30 s;55℃,30 s;72℃,1 min;72℃保温10 min进行30个循环。最后将扩增产物冻存,委托广州赛哲生物科技有限公司完成高通量测序与数据分析。
1.6 产甲烷菌的鉴定
试验中采用荧光显微镜观察法对培育系统中是否含有产甲烷菌进行鉴定。产甲烷菌在420 nm紫外光激发下产生蓝-绿色荧光[18]。该检测方法利用了产甲烷菌细胞中含有辅酶F420和甲基喋呤类化合物具备420 nm紫外照射下具备荧光激发这2个特征[21]。目前除了甲烷菌外还未发现其他厌氧菌具备这一特征,因此420 nm荧光检测是作为产甲烷菌鉴定的重要方法。
2 结果与分析
2.1 产乙酸菌富集培育过程中产乙酸量和pH变化
试验中采用BP培养基、PSG培养基、GSMA培养基这3种培养基对煤样中的产乙酸菌进行培育。培育温度为40℃、振荡频率为80 rpm。每种培养基设置空白样2个。试验中任何一个空白样出现产气或刃天青变色均判定为实验污染,重复实验。实验中分别在第5天和第10天对培养基中的淀粉、还原糖、3种小分子酸(甲酸、乙酸、丙酸)浓度和培养液酸碱度进行测定。测试完成每种培养基5个平行数据中取结果最接近的3组数据取平均值计为本次测试结果。
首先从培养基的利用情况分析,采用碘-碘化钾溶液和本尼迪特试剂对培育5 d后3组培育组是否含有淀粉与还原糖进行了测定,产乙酸菌富集培育过程中3种培养基中淀粉与还原糖含量测定见表1。
由表1可以看出,淀粉检测中BP、GSAM呈阴性,PSG呈阳性。即培育后第5天,PSG中的淀粉未被完全水解。还原糖检测中,BP、PSG 、GSAM这3种培养基均呈阳性。该结果证明,BP培养基中的部分营养物质被水解为还原糖,PSG、GSMA中仍存在一定量的还原糖未被完全降解。

表1 产乙酸菌富集培育过程中3种培养基中淀粉与还原糖含量测定
小分子酸与pH测试结果表明,3种培养基自第5天,均测到一定浓度的乙酸,伴随培育时间的增长,乙酸浓度总体呈增长趋势,各组均未检测到甲酸与丙酸。培育后第5天,PSG培养基中乙酸浓度最高,达到120.10 mmol/L;其次为GSM培养基,乙酸浓度为87.53 mmol/L;BP培养基的乙酸浓度变化最小,乙酸浓度仅为19.61%。3种培养基中酸碱度变化与乙酸浓度成正比,3种培养基pH酸性特征顺序为PSG(pH=5.1)、GSM(pH=6.2)、BP(pH=6.9)。
培育第10天,对培养基中淀粉、还原糖、小分子酸、pH值进行了第2次测定。首先淀粉与还原糖分析结果如下:淀粉检测结果表明,BP、PSG、GSAM均呈阴性,即培育后第10天,PSG中的淀粉完全水解。还原糖检测结果表明,BP呈阳性(颜色呈绿色),PSG 、GSAM培养基均程阴性。该结果证明,BP培养基中含有少量还原糖,PSG、GSMA中的还原糖已被完全降解。
乙酸测试结果表明,经过10 d的培育,乙酸浓度最高的培育组依然是PSG培养组,乙酸浓度达到231.26 mmol/L,乙酸增长率为92.56%;其次为GSM培育组,乙酸浓度上升至152.49 mmol/L,乙酸增长率为74.21%;BP培养基乙酸浓度则为25.47 mmol/L,该培养基中乙酸增长率为29.88%。 此时,3种培养基的酸碱度分别为BP(pH=6.5)、PSG(pH=3.8)、GSMA(pH=4.3)。3种培养基培育实验第5天和第10天各组乙酸含量和pH变化如图1所示。
3组培养基2次测试结果表明,马铃薯淀粉葡萄糖培养基(PSG培养基)获得最佳的乙酸富集,葡萄糖小分子酸培养基(GSMA培养基)的最终乙酸浓度为PSG最终浓度的65.93%,相对而言,BP培养基未成功获得显著的乙酸富集。
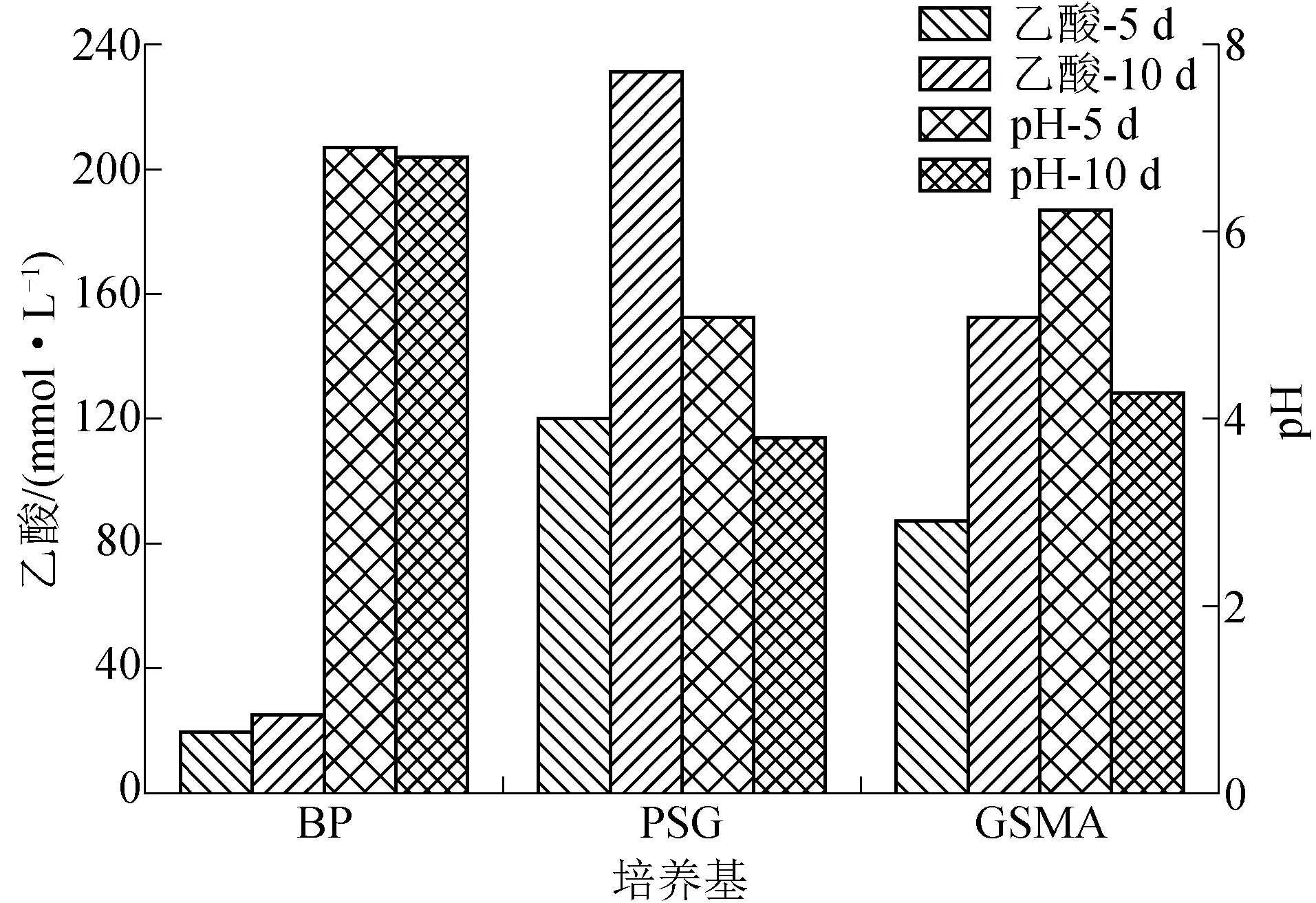
图1 3种培养基培育实验第5天和第10天各组乙酸含量和pH变化
培养基中乙酸浓度的变化能够间接反应产乙酸菌是否被富集。由于乙酸是有机质代谢产甲烷的关键中间产物,当乙酸菌与具有乙酸降解特征的产甲烷菌等共同生长时,培养基中乙酸浓度变化将不显著。试验中的BP培养基对煤中微生物群进行培育时即出现该类情况,3种培养基对产氢产乙酸菌富集培育第5天和第10天培养基菌群镜检如图2所示。
由图2(a)和图2(f)可以看出, BP培育组第5天和第10天培养基试样在420 nm紫外线照射下能够观测到蓝绿色光斑,图中每个蓝绿光斑为单个或多个产甲烷菌,证明BP培养基培育被同步培育。利用图像提取反相处理后,图2(a)和图2(f)中的蓝绿光斑以黑色斑点展现在白色背景中,对比图2(b)和图2(g),结合图2(c)和图2(h)首先能清晰观测到代表产甲烷菌数量的斑点/斑块数量变化与总菌群群落数量变化的趋势关系,由此证实BP培育系统中的产甲烷菌从培育第5天到培育第10天与其他菌种共同增长,并被显著富集。
由图2(d)、图2(e)、图2(i)和图2(j)可以看出,PSG和GSMA培育组中菌种数量伴随培育时间增加,并同样呈现显著增长趋势,但是荧光观测未发现产甲烷菌。
这一结果证明,BP培养基实现对乙酸菌等菌种培育的同时,也实现了对产甲烷菌的培育。
2.2 产乙酸菌富集过程中的产氢规律
产乙酸菌发酵过程中有2种类型菌种,一种是产氢产乙酸菌,另一种是不产氢产乙酸菌,2种菌种具备相同的产乙酸特性,但是产气特征不同。为深入观测寺河矿15号煤层产乙酸菌种是否具备产气特征,试验中每天对各培育组的容积产气率进行了测定与统计,各培育组实验期间H2、CO2、总容积产气率与累积容积产气率变化曲线如图3所示。

图2 3种培养基对产氢产乙酸菌富集培育第5天和第10天天培养基菌群镜检
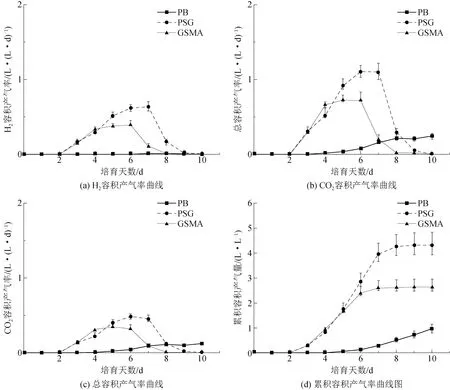
图3 3组培养基实验期间H2、CO2、总容积产气率与累积容积产气率变化曲线
容积产气率测定表明,PSG与GSMA培养基均在第2天产气, BP培养基在培育后第4天开始产气,产H2过程中均伴生CO2气体。生物成气组分中,PSG培养组产气中的H2平均体积浓度为56.63%,GSMA培育组产气中H2浓度略低,其体积浓度为53.25%。培育期间, BP组总产气率最低。实验结束时,该实验组产气正处于缓慢升高阶段。
对该实验组分析中发现,生物成气组分中H2体积浓度保持在8%以下,CO2平均体积浓度为55.29%,除此之外该培养组产气中测得CH4浓度平均为36.71%。试验中PSG和GSMA分别在第9天和第8天停止产气。生物产气过程停止原因如下所述。
(1)各培养基中的碳源是乙酸菌代谢基础,培育终点通过淀粉与还原糖检出实验证明,PSG培养基中的淀粉已被完全水解,并且PSG与GSMA中的还原糖被充分利用,因此培养基底物的匮乏是导致生物成气停止的原因之一。
(2)常规培育实验认为,培育系统的pH值低于4.5时,会出现酸抑制,并且随着酸性的增加,抑制效果更加明显。至培育终点,PSG培养基的pH为3.8,GSMA培养基的pH为4.3,培养系统偏酸,抑制了产氢产乙酸菌活性。
试验中,PSG培育组最大容积产气率出现在第6天和第7天,容积产气率达到1.11 L/(L·d),在第2天到第6天内,容积产气率一直处于上升阶段,此阶段也是产氢产乙酸菌的快速生长阶段,实验结束,该培育组最大累积容积产气量为4.83 L/L;GSMA最大容积产气率出现在第4天到第6天,容积产气率为0.72 L/(L·d),第2天到第4天是该培养基产气上升期,该组培育中最大累积容积产气量为2.95 L/L。
2.3 各培育组菌群结构分析
实验中分别在第5天和第10天对3种培育条件下培育系统中的生物多样性进行了测定,对丰度在0.1%以上的菌种进行了统计。高通测序结果表明,伴随培育时间的增长,各培育系统中的菌种多样性呈递减的趋势发展,并且不同培养基的不同菌种的富集效果不同。其中富集效果最好的是PSG培养基,该培养基能够很好的实现对TerrisporobacterSP.的富集。培育5 d时,培育系统丰度大于0.1%的菌属为CitrobacterSP.、TerrisporobacterSP.和EnterococcusSP.等。经过10 d培育后,该培养组富集出TerrisporobacterSP.菌属,相对丰度大于98%。3种培育方式对寺河煤层产氢产乙酸菌富集中生物多样性的变化如图4所示。

图4 3种培育方式对寺河煤层产氢产乙酸菌富集中生物多样性的变化
BP培育组在培育后第5天,丰度大于0.1%的菌属有9种,培育终点,该组培养基主要完成富集的菌属包括BacteroidesSP.、CitrobacterSP.、CupriavidusSP.、TerrisporobacterSP.和DysgonomonasSP.,共计5种;GSMA培育组第5天的菌属测序中,丰度大于0.1%的菌属为Citrobacter SP.、ClostridiumSP.、EnterococcusSP.、LachnoclostridiumSP.、ParaclostridiumSP.、TerrisporobacterSP.共计6种,经过10 d培育后,ClostridiumSP.、EnterococcusSP.、LachnoclostridiumSP.和TerrisporobacterSP.等4种菌属被富集。
通过菌种多样性伴随培育时间的变化分析,首先BP、PSG、GSMA这3个培育组中均培育了TerrisporobacterSP.菌属。据文献记载,TerrisporobacterSP.为严格厌氧发酵菌,可以利用各种糖、蛋白质、有机酸作为底物[22],乙酸是该菌属的标志性产物,并且代谢中伴随H2和CO2生成[23],纯化培育中,该细胞呈杆状。本实验所富集的菌株具有显著的产气能力,气体产物以H2和CO2为主,H2浓度大于50%。根据培养基组分,该菌株具备将还原糖转化为乙酸的特性。由于在培育前5天,培养基中处于淀粉、葡萄糖和淀粉水解产物复合状态,并且菌群中除了TerrisporobacterSP.菌属外,还包含CitrobacterSP.、EnterococcusSP.等,因此本次试验中无法确定该菌种是否会释放胞外淀粉酶淀粉水解酶。但根据后5天菌种的富集结果,该菌种在PSG营养条件下具有利用还原糖为营养的快速生长能力,并且对其他周围的菌种具有较强的抑制性,从而使该菌种能在培育期间快速形成优势菌种。
其次,GSMA培育中,除TerrisporobacterSP.之外,还富集了ClostridiumSP.、EnterococcusSP.、LachnoclostridiumSP.等3种。其中EnterococcusSP.是一种革兰氏阳性兼性厌氧发酵菌,外形呈球状,又名肠球菌。该菌种多以双球或短链形式存在,代谢中产酸、产氢特征不显著[23];ClostridiumSP.为梭状芽胞杆菌属杆状细菌(见图4)、多数菌种为革兰氏阳性厌氧菌,该菌种广泛分布于土壤、淡水、海洋沉积物以及动物的肠道中。菌种大小根据种类不同差异较大,从0.6~3 μm,最长7 μm。ClostridiumSP.菌属中的某些菌株的能够利用H2和CO2产生乙酸[24]。LachnoclostridiumSP.严格厌氧发酵杆菌,具备发酵糖类物质并转化为乙酸的代谢特征,代谢中产气特征不显著[25]。
综合各组培育方法、乙酸富集、产气特征分析,PSG培养基富集了TerrisporobacterSP.菌属,GSMA富集了TerrisporobacterSP.、EnterococcusSP.、LachnoclostridiumSP.这3种菌属,由此证明了寺河矿煤层地质微生物群中产乙酸特征菌是由多种产乙酸菌构成的菌群,该菌群具备利用还原糖等碳水化合物产生乙酸的代谢。除此,菌群中还存在有类似ClostridiumSP.菌属,可以利用产氢产乙酸菌的代谢产物H2和CO2生成乙酸,以生物合成的方式提高系统乙酸浓度。结合GSMA培养基与PSG培养基,在培育系统中存在乙酸盐和甲酸盐情况下,对TerrisporobacterSP.菌属的竞争具有一定抑制作用,该条件下能够获得除TerrisporobacterSP.菌属之外的多种具有产乙酸特征菌种的富集。BP培养基提供了更为均衡的营养,该条件下产甲烷菌群能够获得一定程度的生长(PSG和GSMA中均为通过荧光显微镜观察到产甲烷菌),但是该培育条件下不利于产乙酸菌的富集。
3 结论
研究中首选利用3种不同碳结构培养基对寺河矿15号煤层中的产氢产乙酸菌进行了为期10 d的培育。培育中选取第5天和第10天分别对培养基中乙酸含量、酸碱度水平、淀粉与还原糖存在状态以及生物多样性进行了测定,同时培育中对每个平行样每天容积产气率进行了跟踪测定。综合以上因素,本试验研究结果如下所述。
(1)不同培养基对寺河矿15号煤层产氢产乙酸菌产生不同的培育结果。其中BP培养基基本保持了原煤地质微生物菌群所具备的产甲烷特征,未能富集产氢产乙酸菌。PSG与GSMA培养基各自实现具备菌种结构特征的产乙酸特征菌的富集。
(2)PSG培养基实现了对TerrisporobacterSP.菌属的富集,该菌属具备利用还原糖产乙酸的特征,H2和CO2是该菌株的代谢伴生产物。经10 d培育,培养基中的淀粉与葡萄糖均被降解。
(3)GSMA培育结果证实,甲酸钠和乙酸钠对TerrisporobacterSP.菌属形成优势菌属具有抑制性,该培养基培育条件下完成对ClostridiumSP.、EnterococcusSP.、LachnoclostridiumSP.和TerrisporobacterSP.等4种菌属的富集。其中TerrisporobacterSP.菌属具备典型的产氢产乙酸特征;LachnoclostridiumSP.菌属不具有产氢产乙酸特征;而ClostridiumSP.菌属则具有利用其它菌种代谢生成H2和CO2的特征,以及通过代谢合成生成乙酸的能力。3种菌属在具备产乙酸特征的同时,又各自具有独特的代谢方式。
(4)产乙酸菌的富集证明,寺河矿15号煤层中存有不止一种属种的产乙酸菌,并且部分菌种代谢中具备显著的产H2和CO2特征,还存有菌属可以利用H2和CO2产生乙酸。而BP实验组的生物多样性与产气特征有待进一步证实,寺河矿煤层中的产甲烷菌群具备乙酸降解型发酵特征,从PSD与GSMA富集菌种的代谢产气特征表明,煤层中除乙酸发酵性产甲烷菌外,还存有二氧化碳还原性产甲烷菌的可能性。
