玻璃电极法测定水体pH值的不确定度分析
2021-01-08贾春玉
贾春玉
(长春市绿园区环境监测站,吉林 长春 130000)
1 引言
pH值是评价水质合格与否的重要参考指标,针对饮用水、地面水、工业废水等都需要严格控制其pH值,因此,对pH值的准确测定具有重要的实用意义。测定不确定度能够表征出被测量值的分散性和测量结果相联系的参数。本文根据《测定不确定度的评定与表示》和GB5750-2006生活饮用水pH值的测定方法,利用玻璃电极法对饮用水样品不确定度进行测定,并基于测定结果对不确定度来源及其各分量进行了分析,以期为玻璃电极法测定水体pH值提供参考。
2 适用范围
玻璃电极法适用于各种水体的pH值测定,其可以用来测定生活用水、工业用水、雨水等水体的pH值。其中,水体的颜色、浑浊程度、内部所含的胶体物、盐含量等均不影响该方法的测定结果。
3 pH值与测试原理
pH值表示的实质是水溶液的酸碱度,常用质量百分度(1.8%氢氧化钠溶液)、摩尔浓度、当量浓度、体积比来表示溶液酸碱度,但是,当溶液酸碱度极小时,就需要借助pH值来表示,其实质只是对溶液酸碱度的一种定义,并没有真正的理论意义。待测样品的pH值在0~14之间,当pH值<7时,表明水体溶液呈酸性,且pH值越小,则意味着水体溶液的酸性越强;pH值>7,则表明水体溶液呈碱性,且pH值越大,则表明水体的碱性越大。pH=7,则表明水体溶液呈中性。酸度计测量pH值的原理是利用内部测量电池电动势的变化而计算得出的,通常而言,在25 ℃条件下时,当水体溶液的酸碱性改变时,则电池电动势会产生一个极差值,而极差值的变化会直接反映在pH值变化上。
4 操作流程
4.1 仪器的校准
在校准仪器时,首先应将水体样品与所使用的标准溶液调整至温度一致,并记录此时的温度值,同时使用仪器温度补偿旋转调至该温度。值得注意的是,用标准溶液校准仪器时,应确保标准溶液和水样品的pH值相差不超过2个pH单位,将电极从标准溶液中取出,用清水冲洗,并用滤纸吸干,然后将电极浸入第二种标准溶液中。此时,标准溶液的pH值与以前的标准溶液相差约3个pH单位。在仪器校准过程中,如果仪器的响应指示与第二标准溶液的pH值之差超过0.1pH单位,则需要检查仪器、电极等,并对标准溶液进行重新测定,在检查无误后方可对样品进行测量。
4.2 样品的测定
测定样品前首先需要对所选用的样品进行测定,并用煮沸后冷却的蒸馏水对玻璃电极进行冲洗,冲洗完成后则使用滤纸吸干水渍,并将电极置于测定完成的样品内,之后搅拌均匀,静置至读数稳定后,即可读出pH值。
5 测定关键技术
5.1 玻璃电极
首先,在使用玻璃电极前需要使用蒸馏水将其浸泡活化24 h以上;玻璃电极在测量完成后,需要使用蒸馏水进行冲洗,冲洗完成后再用清水进行冲洗,并用滤纸吸干表面水渍,然后使用保护套将电极套上,保持薄膜湿润;在实践中电极的表面不可避免的会遭受污染,因此,应针对不同的污染物进行清理,如果玻璃电极表面附着了无机盐结垢,则可以使用温稀盐酸对其进行溶解处理如果玻璃电极表面附着的为钙镁型难以溶解的盐类结垢,则可使用乙二胺四乙酸二钠溶液溶解。在对玻璃电极表面的结垢或油污进行清理后,应将玻璃电极置于蒸馏水中置放超过24 h。玻璃电极的使用寿命有限,在长时间使用后,如果出现测量不稳定的现象,应及时进行更换。此外,由于玻璃电极下部为一球泡型玻璃膜,极易发生破碎,所以在使用的过程中,应注意轻拿轻放,不与硬物接触,防止球泡玻璃膜破碎。
5.2 试剂
在购买试剂时,应注意不可混淆所购买试剂的分子式与分子量。在使试剂的过程中,应使用分析纯或优级纯;在测定过程中所使用的蒸馏水应经煮沸冷却后使用,确保其pH值处于6.7~7.3;在配置标准溶液时,应注意使用蒸馏水,且该蒸馏水应是新煮沸且经冷却后的蒸馏水,煮沸的目的是防止蒸馏水内含有二氧化碳。
5.3 标准溶液
在配置标准溶液时,应将配置环境温度控制在20 ℃,若环境温度无法控制,则应对标准溶液体积进行修正。在标准液配置完成后,应将其倒入玻璃瓶内密封,保存或使用后应将溶液置于冷藏箱内,冷藏箱的温度应保持在4 ℃,这样保存有助于延长溶液的使用寿命,在使用溶液后,不得再将使用过的溶液倒入原储存瓶内。在室温环境下,标准溶液的保存期限为1~2个月,如果在保存的过程中发现标准溶液出现浑浊、沉淀等现象,则表明标准溶液已损坏,不得继续使用。标准溶液的pH值会随着保存环境的温度变化而出现些许差异,差异值可以参见《水质pH值测定玻璃电极法》。
5.4 仪器调试和标定
温度的变化会对电极电位与水电力平衡产生影响,进而导致pH值出现较小的差异,因此,在实际测定中应确保补偿装置和待测溶液温度相同。如果待测溶液的pH值过高(碱性较强)或过低(酸性较强),则配置和溶液pH值相近的标准溶液校正仪器。在测定的过程中,酸度计所配置电极的碱性斜率与酸性斜率基本一致,尽量使用酸性的校正溶液。用标准溶液校准仪器时,应确保标准溶液和水样品的pH值相差不超过2个pH单位,将电极从标准溶液中取出,用清水冲洗,并用滤纸吸干,然后将电极浸入第二种标准溶液中。此时,标准溶液的pH值与以前的标准溶液相差约3个pH单位。在仪器校准过程中,如果仪器的响应指示与第二标准溶液的pH值之差超过0.1PH单位,则需要检查仪器、电极等,并对标准溶液进行重新测定,在检查无误后方可对样品进行测量。
6 案例应用
(1)本次测量的数据如表1所示。
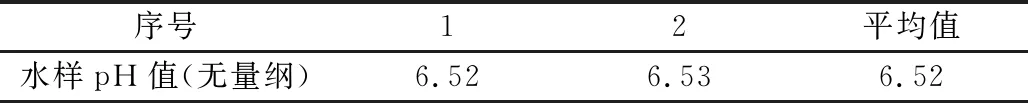
表1 本次测量数据
(2)构建数学模型。可用y=x表示水溶液的pH值。其中y表示水溶液的pH值,x表示仪器响应的pH值(x、y均无量纲)。若用u(xi)表示xi的标准不确定度,则u(y)=u(x)。
(3)标准不确定度分量。重复测量所产生的不确定度我们称之为u1(x),如前所述,在进行pH值重复测定时,pH值的容许差为0.1pH单位,则根据均匀分布可得,。仪器校准所具有的不确定度称为u2(x)。标准缓冲溶液的不确定度以及仪器值误差所产生的不确定度是仪器校准所具有的不确定度的主要原因。由于在实际测定的过程中,在稀释溶液体积以及转移过程中试剂损失对溶液的弱碱电离常数不产生影响,所以可以认为标准缓冲溶液pH值的不确定度对仪器校准所产生的不确定度的影响几乎可以忽略不计。所以可得u2(x)=u1(x)=0.06。
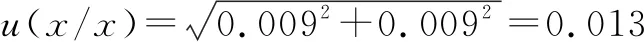
(4)标准不确定度分量如表2所示。

表2 标准不确定度分量
(5)扩展不确定度分析。取近似95%的置信概率,即包含因子k=2,则u=0.085×2=0.17pH单位。出于本实验的目的,在对测量结果进行后续简化处理后,统一按照近似正态分布处理。
7 结论
在运用玻璃电极法测定水体pH值时,会受到众多因素的影响,导致测定结果的不确定度分量较多,由于这些分量所占的影响比率并不完全一致,因此,在实践中,需要加以控制,确保测定结果的可靠性。
