双调控肿瘤特异性溶瘤腺病毒对卵巢癌靶向治疗的研究
2021-01-08赵婷石琴
赵婷,石琴
卵巢恶性肿瘤是全世界女性生殖器官最常见的恶性肿瘤之一,其发病率仅次于子宫颈癌和子宫内膜癌,但是死亡率居三大妇科恶性肿瘤之首。卵巢癌治疗主要采取肿瘤细胞减灭术联合以铂类为基础的化疗。其中,化疗耐药是卵巢癌高死亡率的重要原因之一。切除修复交叉互补基因1(Excision repair cross complementing group1,ERCC1)是铂类耐药最为关键的因子,也是目前研究较多的DNA修复基因之一。2018年1—12月,本研究构建了一种双重调控的新型肿瘤特异性增殖溶瘤腺病毒并以此为载体转染ERCC1小干扰RNA,来靶向杀灭卵巢癌细胞,进一步研究其灭瘤分子机制,并初步探讨其卵巢癌化疗增敏效果,以期研究出卵巢癌治疗及化疗辅助新方案。
1 资料与方法
1.1 主要试剂和设备
实验用质粒载体由上海吉凯基因公司实验构建并保存。正常的卵巢癌细胞系SKOV3 购自美国ATCC 公司,人胚胎肾细胞293t细胞株购自加拿大Microbix Biosystem 公司,DEME培养基、胎牛血清购自GIBCO BRL 公司,噻唑蓝(MTT)购自美国Genview 公司,RIPA 裂解液购自碧云天生物公司,磷酸酶抑制剂购自美国Sigma公司,二甲基亚砜(DMSO)购自上海试一化学试剂厂,DHanks 由上海吉凯基因技术有限公司配制,酶标仪购自Tecan infinite公司细胞凋亡试剂盒购自南京凯基生物科技发展有限公司,ERCC1、β-actin、JAK2、STAT、PI3K、Akt 抗体皆购买于美国Abcam 公司,二抗为山羊抗兔IgG(H+L)、山羊抗小鼠IgG(H+L),均购自Thermo Pierce公司,ERCC1干扰序列(siRNA-ERCC1)、阴性对照序列均由上海吉凯基因有限公司设计合成。1.2 方法
1.2.1 双调控腺病毒构建及鉴定 使用吉凯基因有限公司提供的pXC-1 载体进行改造,其E1a 基因上游插入了人端粒酶逆转录酶启动子(hTERT),E1b 基因上游插入了缺氧调控元件序列(HRE),于E1a 表达盒上游预留了酶切位点(具体结构模式图如图1)。根据Genbank 的ERCC1 基因序列涉及特异siRNA。ERCC1-siRNA 序列为5’-ccAAGCCCTTATTCCGATCTA-3’。同时设计阴性对照序列5’-TTCTCCGAACGTGTCACGT-3’。编 码siRNA 的DNA(由吉凯基因有限公司合成)结构为:AgeI+U6启动子+Sense DNA+Loop(TTCAAGAGA)+Antisense DNA+TTTTT+NotI,将双酶切线性化的载体和退火双链DNA 进行连接反应,连接后的产物进行转化、PCR 鉴定及测序、质粒提取后与腺病毒包装质粒(PBHGE3)一起转染293 细胞,重组出携带ERCC1-siRNA 的双调控腺病毒(AD-ERCC1-siRNA)及未携带ERCC1-siRNA的对照腺病毒(AD-NC-siRNA)。
1.2.2 鉴定 各腺病毒经PCR 扩增鉴定E1a 序列后,于293细胞中反复扩增,氯化氩密度梯度离心纯化,TCID50法检测病毒滴度:挑取病毒克隆噬斑,提取腺病毒DNA,鉴定腺病毒E1a和hTERT序列。
1.2.3 MTT 法检测细胞增殖能力 将对数期生长细胞离心后,重悬细胞,于96 孔板接种(密度5×10个∕孔),继续培养,用无血清培养液稀释病毒ADERCC1-siRNA、AD-NC-siRNA,按照MOL=5.00、10.00、20.00、40.00、60.00加入100 μL稀释好的病毒液分别感染细胞,对应于每个病毒感染复数(MOI)值设3 个复孔,于24 h 后向各孔加入MTT 液(5 mg∕mL)20 μL,孵育4 h,终止培养,小心的将孔内上清液吸弃,将100 μL 二甲基亚砜加入各孔,振荡15 min,待结晶物完全溶解后,利用酶标仪检测各孔在492 nm波长处的吸光度A值。
根据DDP 作用于SKOV3 预实验结果,得出DDP IC10(2.26 mg∕L),并设置五个组别DDP IC10(2.26 mg∕L)、AD-ERCC1-siRNA(MOI 30)、AD-NCsiRNA(MOI=30)、DDP IC10+AD-NC-siRNA(MOI 30)、DDP IC10+AD-ERCC1-siRNA(MOI=30),MTT法比较各组的吸光度(A)值及细胞增殖抑制率。
1.2.4AnnexinV-FITC 双染结合流式细胞术检测SKOV 3 细胞的凋亡
收集不同作用组的细胞及细胞培养液,按照AnnexinV-FITC试剂盒说明,1 000 r∕min 离心5 min(TGL-16B 台式离心机上海安亭科学仪器厂),弃上清,用PBS轻轻重悬细胞并计数。取1×10个重悬的细胞,1 000 r∕min 离心5 min,弃上清,加入195 μL AnnexinV-FITC 结合液重悬细胞。加入5 μL AnnexinV-FITC,轻轻混匀,室温避光孵育10 min。1 000 r∕min 离心5 min,弃上清,加入190 μL Annexin V-FITC 结合液轻轻重悬细胞。加入10 μL 碘化丙啶染色液,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测。1.2.5 蛋白质印迹法(Western Blot) 检测细胞中JAK2、STAT、PI3K、Akt蛋白表达各组细胞转染后培养24 h,用预冷的RIPA裂解液和磷酸酶抑制剂分别提取总蛋白并检测纯度。取总蛋白30 μL,进行10%聚丙烯胺凝胶电泳,电至聚偏二氟乙烯膜(PVDF)膜上,用3%牛血清白蛋白室温下封闭60min,TBST冲洗3次,加入一抗JAK2、STAT、PI3K、Akt,4 ℃过夜孵育,TBST 冲洗3 次,将二抗加入,37 ℃孵育60 min,用TBST 冲洗3 次,暗室下用ECL反应15 min,用Image J 软件分析,计算细胞中JAK2、STAT、PI3K、Akt蛋白表达量。
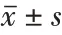
2 结果
2.1 RSOAds-hTERT/HIF-ERCC1 双调控腺病毒成功构建并可以高效转染卵巢癌细胞
我们将携带ERCC1-siRNA基因的工具载体质粒(载体顺序为pU6-MCS-phTERT-E1A-pHREE1B55K-pIX-E2B,克隆位点:Age I、Not I),与腺病毒包装质粒-PBHGE3一起转染293 细胞,成功构建双调控溶瘤腺病ADERCC1-siRNA,见图1。我们将构建成功的AD-ERCC1-siRNA 病毒增加荧光载体,置于荧光显微镜下进行观察,病毒转染效率较高,见图2。2.2 RSOAds-hTERT/HIF-ERCC1 双调控腺病毒对卵巢癌细胞有增殖抑制作用
MTT 方法检测双调控腺病毒对卵巢癌细胞SKOV3 细胞的增殖抑制作用,结果提示,当病毒接触卵巢癌细胞24 h 后发挥出对卵巢癌细胞较明显的增殖抑制作用,且ADERCC1-siRNA组与AD-NC-siRNA组无明显差异,在感染强度(MOI)=30时,卵巢癌SKOV3细胞增殖率下降到50%以下,见图3和表1。
表1 双调控腺病毒对SKOV3细胞的半数抑制率病毒浓度
2.3 RSOAds-hTERT/HIF-ERCC1 双调控腺病毒对卵巢癌细胞促凋亡作用
将AD-ERCC1-siRNA病毒对卵巢癌细胞作用效果进行了图像观察及细胞凋亡实验,与空白细胞对照组相比,细胞培养24 h后,可见大量SKOV3 细胞形态不规则,细胞体老化分解或者萎缩聚集,胞核深染(显微镜放大倍数40倍)。流式细胞实验显示AD-ERCC1-siRNA 组细胞凋亡率(5.5±0.75)%较对照组(0.5±0.24)%明显升高(P<0.01)。见图4。2.4 RSOAds-hTERT/HIF-ERCC1 双调控腺病毒高效屏蔽ERCC1 耐药基因,并可能通过JAK/STAT通路介导杀伤上皮性卵巢癌细胞
我们采用传统WB 方法对病毒作用后的SKOV3 细胞进行细胞收集以及蛋白提取后检测。结果显示AD-ERCC1-siRNA 组作用后细胞ERCC1 蛋白(0.553±0.036)表达较对照组(1.607±0.102)明显减少(P<0.01)。JAK2,STAT3 表达量较对照组表达明显增加(P<0.01)。同时我们也进行了PI3K∕Akt 通路的相关蛋白检测,其表达差异无统计学意义(P>0.05)。见图5、表2。
表2 AD-ERCC1-siRNA病毒作用后对ERCC1蛋白及细胞凋亡蛋白影响∕
2.5 携带ERCC1-siRNA的双调控病毒较AD-NCsiRNA 更能增强顺铂的用药效果,其机制可能与ERCC1耐药基因成功屏蔽有关
我们采用MTT方法检测单药顺铂组、病毒组、联合组等组别对卵巢癌细胞SKOV3 细胞的杀灭作用,结果提示,五组卵巢癌细胞SKOV3 增殖率均被明显抑制(P<0.01),其中携带ERCC1-siRNA 的双调控病毒联合顺铂组较其余各组抑瘤作用更强,较AD-NC-siRNA+DDP组更能增强顺铂的用药效果(P<0.01),而AD-NCsiRNA组与AD-ERCC1-siRNA组对肿瘤细胞作用差异无统计学意义(P>0.05)。见表3。
表3 噻唑蓝检测DDP组、病毒组、联合组等组别对卵巢癌细胞SKOV3的增殖抑制率
3 讨论
卵巢癌以盆腔种植及转移为主,因病灶位置较深,化疗药物静脉用药盆腔局部难以达到有效浓度,治疗效果不佳,盆腔灌注的方法亦对正常组织和细胞造成很大损伤。且肿瘤细胞对铂类药物产生耐药性更是阻碍了药物的抗肿瘤效应,使术后5年生存率徘徊在30%~50%之间。因此,一种肿瘤靶向性强且能逆转耐药的卵巢癌治疗新方案已经成为妇科肿瘤学重要的研究目标之一。
肿瘤特异性增殖溶瘤腺病毒(RSOAds)载体因其高度肿瘤靶向性及杀伤力引起我们关注,它能感染肿瘤细胞,在其中复制、增殖、裂解、杀伤肿瘤细胞并释放出更多病毒,感染其他肿瘤细胞进行链式杀伤反应,且复制、增殖仅限于肿瘤细胞,对正常宿主组织几乎无破坏。
目前认为,端粒酶的活化与卵巢癌的发生密切相关,其活性增加在卵巢癌的进展中具有重要意义。在肿瘤细胞的恶性增殖过程中,细胞耗氧量剧增,肿瘤内缺氧微环境诱导缺氧诱导因子(HIF-1)形成,HIF-l在包括卵巢癌在内的多种肿瘤中广泛存在,它与一系列缺氧反应元件(HRE)结合,从而启动目的基因的转录表达,在肿瘤发生、发展、凋亡、浸润及转移等方面起着十分重要的作用。有研究证明HIF-1在卵巢癌、脑癌、乳腺癌、肾癌、膀胱癌等一系列人体实体瘤中均高表达,而在相邻的正常组织或基质细胞中则无表达。
卵巢癌铂类耐药最为关键的因子是切除修复交叉互补基因1(ERCC1),也是目前研究较多的DNA 修复基因之一。ERCC1位于人类19号染色体上,参与了DNA 链的切割和损伤识别,ERCC1 mRNA 水平可以反映肿瘤组织修复铂类药物所致DNA螺旋扭转的能力,是标志肿瘤病人预后和铂类化疗效果的重要指标。很多研究发现接受以铂类为基础的化疗病人中ERCC1表达越高,化疗效果及病人的预后越差。
综上所述,我们设想依据恶性实体肿瘤无限增殖和瘤内缺氧环境的存在这两个主要特征,构建一种人端粒酶逆转录酶(hTERT)启动子和HIF-1双重调控的新型肿瘤特异性增殖溶瘤腺病毒并以此为载体转染ERCC1 siRNA,靶向杀灭卵巢癌细胞同时初步探讨其卵巢癌化疗辅助效果,以期灭瘤同时增强肿瘤细胞化疗敏感性,两者相辅相成,有效预防肿瘤复发,并减少化疗药物用量,加强化疗效果并提高病人生活质量,延长病人生存期。
本研究将hTERT和HIF-1分别插入已删除病毒复制所必需的E1A、E1B 基因启动子删除的腺病毒质粒,成功构建仅在肿瘤细胞内特异性增殖的双调控溶瘤腺病毒(RSOAd-hTERT-HIF),并以此为耐药基因ERCC1的siRNA基因载体,进一步包装成溶瘤腺 病 毒hTERT 启 动∕HIF -ERCC1siRNA 质 粒(RSOAds-hTERT∕HIF-ERCC1 siRNA),以抑制癌细胞增殖、诱导癌细胞凋亡,达到提高肿瘤基因治疗的目的。经鉴定,本研究构建的双调控腺病毒能够在卵巢癌细胞中高拷贝增殖,并能成功屏蔽卵巢癌SKOV3细胞中ERCC1耐药基因,且实现了针对恶性肿瘤端粒酶阳性和缺氧环境的双调控作用。
磷脂酰肌醇3激酶(PI3K)∕蛋白激酶B(Akt)通路是一个经典的抗凋亡、促存活的信号转导途径,由PI3K 家族、Akt 蛋白及其一系列底物组成。PI3K是细胞膜上的表皮生长因子受体(EGFR)细胞内部分的下游分子,EGFR 激活后,PI3K 随后活化,并进一步磷酸化激活Akt,磷酸化的Akt 直接或间接参与许多生理和病理过程。目前研究表明,PI3K∕Akt转导途径是卵巢癌细胞对DDP敏感性的关键调控因素。
JAK-STAT 信号通路是一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。JAK-STAT 信号通路功能广泛,目前与疾病及药物创新相关的研究都集中于炎症性疾病及肿瘤性疾病。
我们选用卵巢癌SKOV3 细胞进行该病毒的细胞学试验,通过对细胞进行MTT检测发现此病毒对上皮性卵巢癌细胞株SKOV3具有一定的杀灭作用,且携带ERCC1 siRNA后并不影响病毒灭瘤效果;甚至屏蔽ERCC1 基因后还具有明显顺铂增敏作用。同时进行了细胞凋亡通路的检测,JAK∕STAT通路的激活可能是该病毒诱导肿瘤细胞死亡的一条重要途径,PI3K∕Akt 通路尚未发现参与其中。
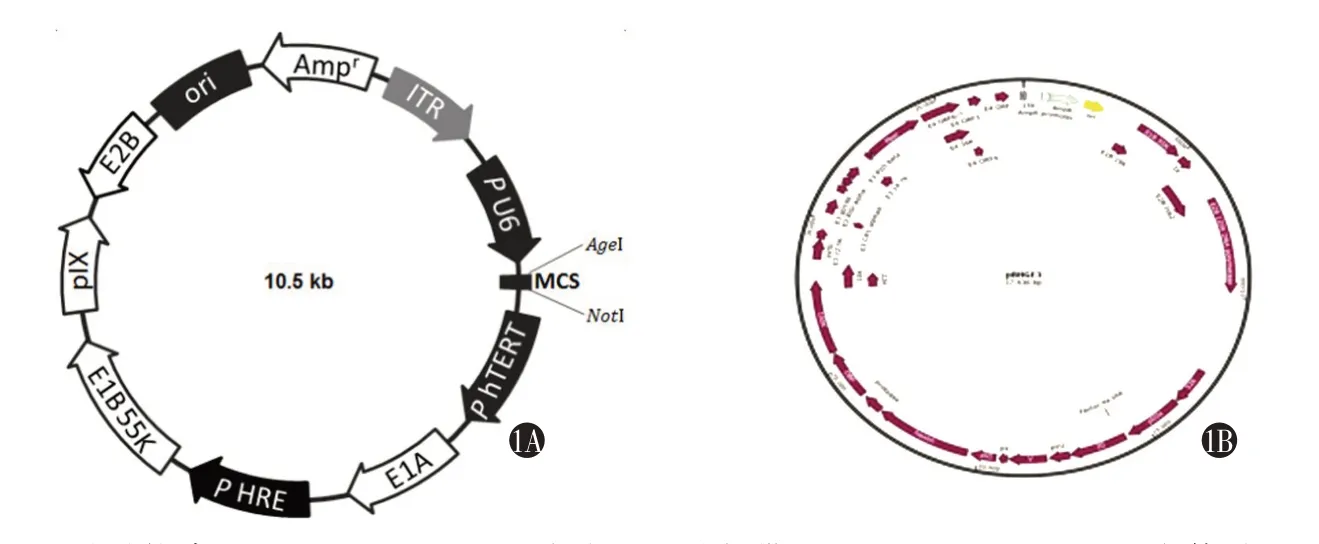
图1 成功构建AD-ERCC1-siRNA的相关质粒:1A为携带ERCC1-siRNA基因的工具载体质粒;1B为溶瘤腺病毒包装辅助质粒(PBHGE3)
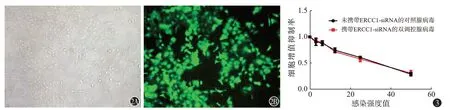
图2 构建成功的AD-ERCC1-siRNA病毒增加荧光载体,将病毒转染后的卵巢癌细胞SKOV3放置于荧光显微镜下观察:2A为正常光线下细胞图像;2B为荧光显像(放大倍数为100倍) 图3 噻唑蓝检测双调控腺病毒对SKOV3细胞的增殖抑制作用

图4 携带ERCC1-siRNA的双调控腺病毒(AD-ERCC1-siRNA)作用SKOV3人卵巢癌细胞24 h凋亡效果图:A为AD-ERCC1-siRNA组;B为细胞对照组

图5 WB检测AD-ERCC1-siRNA病毒作用后ERCC1蛋白表达及相关细胞凋亡通路:A为ERCC1蛋白表达,B为细胞凋亡通路蛋白表达
我们首例将双调控腺病毒应用于妇产科肿瘤,致力构建一种靶向性极高的溶瘤腺病毒应用于卵巢癌的治疗,探讨其溶瘤机制及化疗增敏效果,为卵巢癌的基因治疗打下坚实的研究基础。当然,后续还有一些问题亟待我们不断进行完善研究,比如探讨目的病毒屏蔽ERCC1 耐药基因后化疗增敏分子机制研究及完善相关动物实验等。(本文图1~5见插图1-1)
