微小RNA-129-5p 在喉鳞状细胞癌中的表达及对细胞增殖、侵袭的影响
2021-01-08张炜魏珍星郭洁张严乐
张炜,魏珍星,郭洁,张严乐
喉癌是一种临床常见头颈部恶性肿瘤,其中约85%~90%为喉鳞状细胞癌,在耳鼻喉咽喉科肿瘤中排第3 位,且近来发病率呈上升趋势。虽然手术、放化疗等治疗方式对提高病人5 年生存率已有很大突破,但手术致残、放化疗出现的严重不良反应等限制其应用,导致此种疾病仍严重威胁人类健康。研究报道,空气污染、病毒感染、饮酒、吸烟、抑癌基因失活及原癌基因激活等因素是导致喉鳞状细胞癌发生的危险因素,但迄今为止,喉鳞状细胞癌的病因及发病机制尚未完全阐明。微小RNA(microRNA,miRNA)是一类非编码小RNA,长度约18~25 个核苷酸,在细胞增殖、凋亡、能量代谢等过程及肿瘤发生发展中发挥重要作用。近来研究报道,微小RNA-129-5p(microRNA-129-5p,miR-129-5p)下调与肺癌、脑胶质瘤、乳腺癌等多种癌症发生、发展及癌细胞增殖分化有关,但关于miR-129-5p在喉鳞状细胞癌中的作用鲜有研究。故本研究拟通过检测喉鳞状细胞癌组织中miR-129-5p 表达水平,探究miR-129-5p 对喉鳞状细胞癌Hep-2 细胞增殖、侵袭的影响,以期为喉鳞状细胞癌的治疗提供一定理论参考。
1 资料与方法
1.1 一般资料
选取郑州大学附属洛阳中心医院2015年1月至2019年2月收治的喉鳞状细胞癌病人58例,癌变组织切除手术中采集喉鳞状细胞癌及距离喉鳞状细胞癌组织大于1 cm 处癌旁正常喉粘膜上皮组织标本,置于液氮中保存备用。所有病人术前均未接受放化疗及生物治疗,且均经病理证实。研究对象或其近亲属签署知情同意书,本研究所用方法符合《世界医学协会赫尔辛基宣言》,且经郑州大学附属洛阳中心医院伦理委员会审核批准后实施(伦理批号20150327)。1.2 细胞、主要仪器及试剂
喉鳞状细胞癌Hep-2细胞株(批号JKCS0277,美国ATCC)购自上海晶抗生物工程有限公司;总RNA 提取试剂(Trizol)、二甲基亚砜(DMSO)、蛋白抽提及二喹啉甲酸(BCA)蛋白定量试剂盒均购自上海碧云天有限公司,批号分别 为R0016、ST038、P0028、P0010S;PrimeScript ™RT reagent Kit(TaKaRa)、microRNA 定 量(qRTPCR)试剂盒(TaKaRa)均购自大连宝生物科技有限公司,批号分别为RR037A、638315;DMEM∕F-12 培养基、胎牛血清均购自美国Gibco 公司,批号分别为12634010、10 099141;miR-129-5p mimics、miR-129-5p mimics NC 购自上海吉玛生物科技有限公司;Lipofectamine ™2000 转 染 试 剂 盒(批 号:11668027,美国,Thermo 公司);噻唑蓝(MTT)、一抗鼠源原癌基因(c-Myc)、细胞周期蛋白D1(Cyclin D1)、基质金属蛋白酶2(matrix metalloprotein2,MMP-2)、基质金属蛋白酶9(matrix metalloprotein9,MMP-9)、β-肌动蛋白(β-actin)抗体、二抗羊抗鼠IgG 均购自美国Invitrogen,批号分别为V13154、13-2500、33-3500、MA5-14186、MA5-14228、MA5-15739、B-2752。紫外分光光度计、二氧化碳培养箱均购自美国Thermo 公司;RT-qPCR7500 仪、MODEL550 型酶标仪均购自美国Bio-Rad 公司;Ⅸ73 倒置荧光显微镜购自日本Olympus公司。1.3 方法
1.3.1 RT-qPCR检测喉鳞状细胞癌组织及Hep-2细胞中miR-129-5p 水平 Trizol 提取喉鳞状细胞癌、癌旁组织及Hep-2 细胞中总RNA,紫外分光光度计检测总RNA 浓度及纯度。反转录制备互补DNA(cDNA)。实时荧光定量PCR 仪(RT-qPCR)检测样品中miR-129-5p 水平。反应体系(20 μL):TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)(2×)10 μL,ROX Reference Dye or Dye Ⅱ(50×)0.4 μL,cDNA(50 ng∕μL)2 μL,上下游引物(10 μM)各0.8 μL,ddH2O 6.0 μL。反应条件设置为:95 ℃,30 s;95 ℃,5 s;60 ℃,34 s,40 个循环。以U6 为内参,采用2法计算miR-129-5p的相对表达水平。

表1 实时荧光定量聚合酶链反应引物序列
1.3.2 细胞培养及转染 细胞培养:Hep-2 细胞复苏后接种于DMEM∕F-12培养基[含有10%胎牛血清(FBS)、1%青链霉素],置于37 ℃5%二氧化碳培养箱培养。
细胞转染:(1)转染前1 d(细胞汇合至30%~50%)更换不含抗生素培养基,(2)用无血清opti-MEM培养基50 mL分别稀释1.25 mL微小RNA-129-5p模拟物(miR-125-5p mimics),2.5 mL miR-125-5p 模拟物-空白对照组(mimics-NC),轻轻混匀,室温静置5 min;(3)用无血清opti-MEM 培养基50 mL 稀释1 mL 转染试剂脂质体(Lipofectamine)2000,室温静置5 min;(4)将“(2)”与“(3)”分别轻轻混匀,室温静置20 min;(5)将miR-125-5p mimics∕NC 转染试剂混合液分别逐滴加入培养板中,轻轻混匀。分别设转染miR-125-5p mimics 为mimics组,转染miR-125-5p mimics NC为mimics-NC组,另设无任何转染的Hep-2细胞为空白对照组(NC),每组6 个重复。(6)培养4~6 h后,更换新鲜生长培养基,置于37 ℃5%二氧化碳培养箱分别培养24 h、48 h、72 h。
1.3.3 四甲基偶氮唑蓝(MTT)法检测喉鳞状细胞癌Hep-2细胞增殖 取对数期生长的Hep-2细胞,以约5.0×10个∕孔的浓度接种于96 孔板,添加培养液200 微升∕孔。分别转染miR-129-5p mimics∕NC培养24 h、48 h、72 h,另设阴性对照组,转染步骤及分组同1.3.2。培养结束后用MTT试剂盒检测mimics组、mimics-NC 组、NC 组各孔细胞增殖情况。细胞增殖抑制率=(1-实验组OD∕NC组OD)×100%。
1.3.4 平板克隆试验检测喉鳞状细胞癌Hep-2细胞克隆能力 取对数期Hep-2细胞,胰酶消化后以200个∕孔接种于6 孔板,细胞贴壁后,更换培养基并转染miR-129-5p mimics∕NC 处理48 h,设置阴性对照组,按照1.3.2 项下进行转染和分组,每组设置6 个复孔。于培养箱中继续培养14 d,待肉眼可见克隆集落时停止培养。甲醛固定,瑞士染液染色,显微镜下观察,以单个克隆中细胞数>50 作为克隆计数,实验重复3 次,取平均值。平板克隆形成率=(平均克隆数∕每孔加入单细胞数)×100%。
1.3.5 Transwell试验检测喉鳞状细胞癌Hep-2细胞侵袭能力 本研究参照相关文献方法,在Transwell板上进行操作。倒置显微镜观察穿过膜的细胞数,每张膜随机取5个视野,计算每个视野穿过膜微孔的细胞数,取平均值。
1.3.6 喉鳞状细胞癌Hep-2细胞增殖及侵袭相关蛋白检测 收集转染后各组培养48 h 喉鳞状细胞癌Hep-2 细胞,提取细胞总蛋白。二喹啉甲酸(BCA)测量蛋白浓度后取等量蛋白质样品(60 微克∕孔)上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳。湿转法将蛋白转至NC 膜,5%脱脂奶粉封闭,加一抗细胞周期蛋白D1(Cyclin D1)抗体1∶500;c-Myc 抗体1∶500;基质金属蛋白酶2(MMP-2)抗体1∶500;基质金属蛋白酶9(MMP-9)抗体1∶1 000;β 肌动蛋白(β-actin)抗体1∶500;4 ℃孵育过夜,洗去一抗,加入辣根过氧化物酶(HRP)标记的二抗IgG(1∶5 000)室温孵育1 h,洗去二抗,化学发光试剂(ECL)显色,以β-actin为内参,计算目的蛋白的相对表达量。
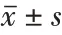
2 结果
2.1 miR-129-5p 在喉鳞状细胞癌及癌旁组织中的表达水平比较
与癌旁组织(1.03±0.14)比较,喉鳞状细胞癌组织中miR-129-5p(0.48±0.08)表达水平显著降低(t=25.977,P<0.001)。2.2 上调miR-129-5p 抑制喉鳞状细胞癌Hep-2 细胞增殖
与NC 组、mimics-NC 组比较,mimics 组miR-129-5p 表达水平、Hep-2 细胞增殖抑制率均显著增加(P<0.05)。与24 h比较,mimics组48 h miR-129-5p 表达水平、喉鳞状细胞癌Hep-2 细胞增殖抑制率显著增加(P<0.05)。与48 h 比较,mimics 组72 h miR-129-5p 表达水平、喉鳞状细胞癌Hep-2 细胞增殖抑制率增加,但差异无统计学意义(P>0.05)。不同转染时间,NC 组、mimics-NC 组miR-129-5p 表达水平、喉鳞状细胞癌Hep-2 细胞增殖抑制率比较差异无统计学意义(P>0.05)。提示48 h 转染效果最好,可用于下游试验。详见表2。2.3 上调miR-129-5p 抑制喉鳞状细胞癌Hep-2 细胞克隆形成
NC 组(98.96±10.60)%、mimics-NC 组(97.57±10.82)%平板克隆形成率比较,差异无统计学意义(t=0.334,P=0.970)。与NC 组、mimics-NC组比较,mimics组(46.91±9.03)%喉鳞状细胞癌Hep-2细胞平板克隆形成率显著降低(t=12.523、12.188,均P<0.001)。详见图1。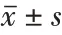
表2 上调miR-129-5p抑制喉鳞状细胞癌Hep-2细胞增殖∕

图1 miR-129-5p对喉鳞状细胞癌Hep-2细胞克隆能力的影响(每组选取了两张平板克隆)
2.4 上调miR-129-5p 抑制喉鳞状细胞癌Hep-2 细胞侵袭
与NC 组(235.62±36.18)、mimics-NC 组(227.31±35.90)侵袭细胞数比较,差异无统计学意义(t=0.645,P=0.893)。与NC组、mimics-NC组比较,mimics组喉鳞状细胞癌Hep-2细胞侵袭细胞数显著减少(t=10.955、10.310,均P<0.001)。详见图2。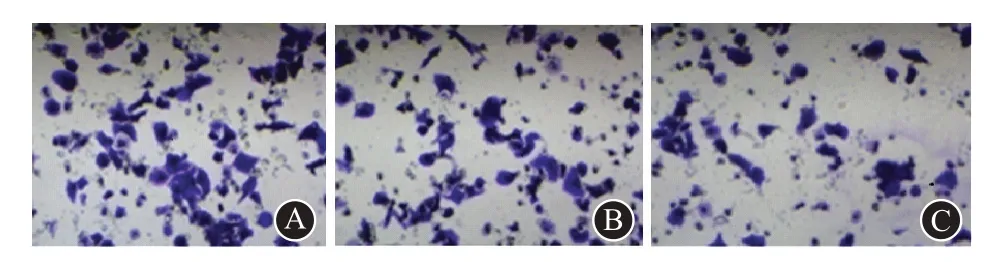
图2 显微镜下侵袭喉鳞状细胞癌Hep-2细胞数量(200×):A为空白对照组;B为miR-125-5p模拟物-空白对照组;C为miR-125-5p模拟物
2.5 上调miR-129-5p抑制喉鳞状细胞癌Hep-2细胞增殖相关c-Myc、Cyclin D1 蛋白表达
NC 组、mimics-NC 组c-Myc、Cyclin D1 蛋白表达水平比较,差异无统计学意义(P>0.05)。与NC组、mimics-NC组比较,mimics 组喉鳞状细胞癌Hep-2 细胞c-Myc、Cyclin D1表达水平显著降低(P<0.05)。详见表3、图3。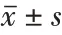
表3 喉鳞状细胞癌Hep-2细胞增殖相关c-Myc、Cyclin D1蛋白表达水平∕
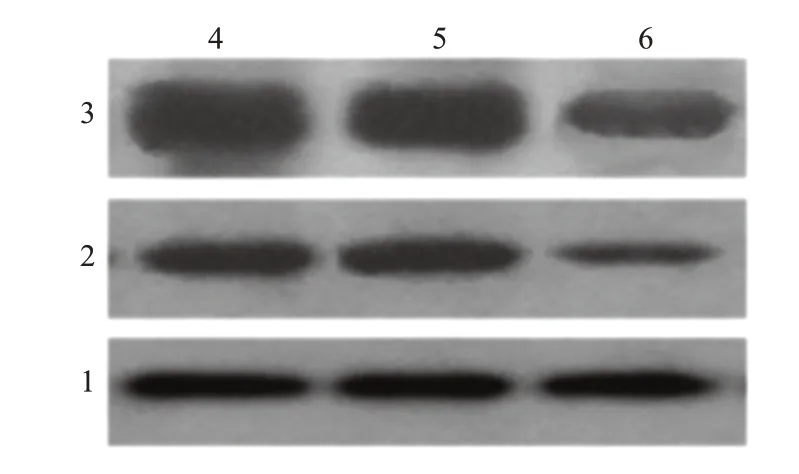
图3 WB检测喉鳞状细胞癌Hep-2细胞增殖相关c-Myc、Cyclin D1蛋白表达
2.6 下调miR-129-5p 抑制喉鳞状细胞癌Hep-2 细胞侵袭相关MMP-2、MMP-9 蛋白表达
NC 组、mimics-NC 组MMP-2、MMP-9 蛋白表达水平比较差异无统计学意义(P>0.05)。与NC 组、mimics-NC组比较,mimics组Hep-2细胞MMP-2、MMP-9蛋白表达水平显著降低(P<0.05)。详见表4、图4。3 讨论
随着近来高通量测序及芯片技术的发展,人们对miRNA 的功能研究不断深入,越来越多研究发现,miRNA异常表达与包括喉癌在内的多种恶性肿瘤发生发展密切相关。miRNA在喉癌中上调表达,可发挥促癌基因作用,miRNA下调表达,则发挥抑癌基因作用。范钰等研究报道,miR-21 在喉癌组织中上调表达,下调miR-21可抑制喉鳞状细胞癌Hep-2细胞增殖及侵袭。侯素平等研究报道,miR-1264 在喉鳞状细胞癌组织中下调表达,上调miR-1264 可抑制喉鳞状细胞癌Hep-2 细胞增殖、迁移及侵袭能力。Cheng等研究报道,miR-129-5p在肺癌组织中显著下调,miR-129-5p可通过靶向抑制血管内皮生长因子(VEFG)抑制肺癌H1299 细胞、SPSA1细胞增殖迁移和侵袭能力。Han,Wang研究报道,miR-129-5p在骨肉瘤及细胞系中显著下调,miR-129-5p 可通过直接靶向抑制Rho-相关蛋白激酶1(ROCK1)基因抑制骨肉瘤细胞增殖、迁移和侵袭。本研究结果发现,miR-129-5p在喉鳞状细胞癌组织中表达水平显著低于癌旁组织,提示miR-129-5p下调可能与喉鳞状细胞癌发生有关。
表4 喉鳞状细胞癌Hep-2细胞侵袭相关MMP-2、MMP-9蛋白表达水平∕
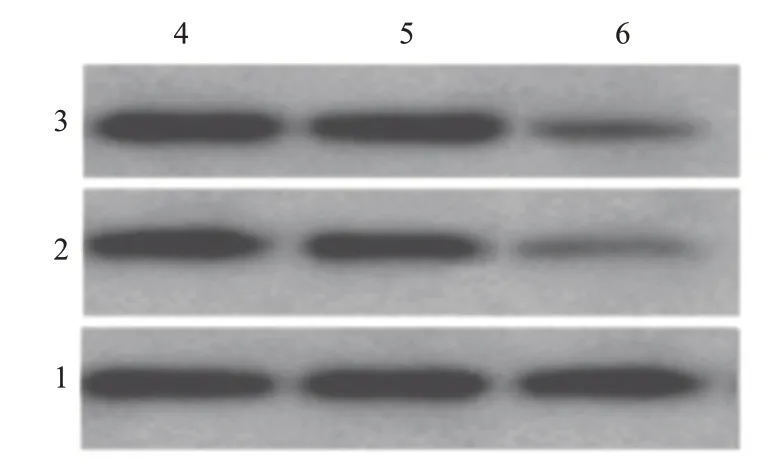
图4 WB检测喉鳞状细胞癌Hep-2细胞侵袭相关MMP-2、MMP-9蛋白表达
为进一步验证miR-129-5p 与喉鳞状细胞癌的关系,本研究以喉鳞状细胞癌Hep-2细胞为模型,采用脂质体转染miR-129-5p mimics、MTT、平板克隆、侵袭等体外细胞试验探讨miR-129-5p 多喉鳞状细胞癌Hep-2 细胞生物学行为的影响,结果发现,与NC组及mimics-NC 组比较,转染miR-129-5p mimics 48h 使miR-129-5p 显著上调4 倍以上,且对喉鳞状细胞癌Hep-2 细胞增殖抑制率达50%以上,提示转染miR-129-5p mimics 48 h 转染效率及抑制效率最佳,可用于下游试验。
侵袭和转移是恶性肿瘤的重要生物学特征,侵袭和转移能力也是癌细胞区别与正常细胞的最基本特征,是导致恶性肿瘤复发病情恶化,最终死亡的病理基础。研究发现,过表达miR-129-5p 与骨癌细胞、骨肉瘤细胞、乳腺癌细胞等多种肿瘤细胞增殖、迁移及侵袭能力有关。本研究结果发现,与NC组、mimics-NC 组比较,mimics 组喉鳞状细胞癌Hep-2细胞平板克隆形成率及侵袭细胞数目显著降低,提示过表达miR-129-5p可抑制喉鳞状细胞癌Hep-2 细胞增殖、侵袭能力。原癌基因c-Myc 和G1∕S 特异性周期蛋白Cyclin D1 在肿瘤细胞中的高表达,可加速肿瘤细胞增殖及恶化程度。MMP家族蛋白成员MMP-2、MMP-9,可破坏肿瘤细胞侵袭的组织学屏障,促进其侵袭、转移。本研究结果显示,与NC组、mimics-NC 组比较,mimics 组喉鳞状细胞癌Hep-2 细胞中c-Myc、Cyclin D1 蛋白及MMP-2、MMP-9蛋白表达显著降低,进一步验证miR-129-5p可影响喉鳞状细胞癌细胞增殖及侵袭,提示miR-129-5p 可能在喉鳞状细胞癌中发挥类似抑癌基因作用。
综上所述,miR-129-5p 在喉鳞状细胞癌组织中低表达,上调miR-129-5p 可抑制喉鳞状细胞癌Hep-2 细胞增殖、侵袭能力。但关于miR-129-5p 的靶向调控基因及影响喉鳞状细胞癌miR-129-5p 增殖、侵袭的靶向调控基因及可能相关通路尚不清楚,后期需进一步深入研究。
