强直性脊柱炎患者血小板微粒的促炎作用及其在临床诊治中的意义
2021-01-07孟磊陈习超侯丽琼陈雁飞
孟磊 陈习超 侯丽琼 陈雁飞
兰州大学第一医院,甘肃 兰州730000
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性炎症性自身免疫性疾病[1],主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节。AS 确切病因尚未完全明确,传统的抗风湿药物不能很好地控制病情进展,且药物不良反应较大[2]。研究发现,AS 患者关节滑液中TNF-α 水平升高,使用TNF-α 拮抗剂可抑制AS患者的炎性因子水平[3]。血小板微粒(platelet microparticle,PMPs)可携带血小板激活产生的大量生物活性物质,是体内促炎症分子的主要来源。研究表明,在类风湿关节炎患者的关节滑液中存在PMPs,导致关节滑液中的成纤维细胞激活,从而促进关节炎症的发生[4]。目前国内外关于PMPs 与AS 相关性的报道较少,对于PMPs 在AS 发生机制及临床治疗中的作用缺乏相关研究。本研究通过比较AS 患者与健康对照组血浆PMPs含量的差异、AS 患者治疗前后及不同治疗方法之间PMPs 变化情况,探讨PMPs 对AS 患者的临床意义。
1 资料和方法
1.1 一般资料 选取2018 年6 月至2019 年10 月于我院风湿免疫科收治确诊的AS 患者59 例,入选标准符合美国风湿病学会1984 年修订的AS 纽约分类标准[5]。排除标准:①合并心肌梗死者;②合并周围血管栓塞性疾病者;③合并其他自身免疫疾病者;④肿瘤患者;⑤发病前2 周有炎性病变史或入院时发生感染性疾病者(如严重的上呼吸道感染、肺炎、高热等);⑥有严重肝肾功能不全者。同时纳入健康对照组30 例,排除心、肝、肺、脑等器质性病变,无脑梗死、脑出血、炎症、肿瘤、血液病和免疫性疾病,1 个月内无手术史,所有对象近2 周内均未应用过免疫抑制剂及抗血小板或抗凝药物。本研究取得我院伦理委员会批准,所有受试者均签署知情同意书。两组一般资料差异无统计学意义(P>0.05)。见表1。
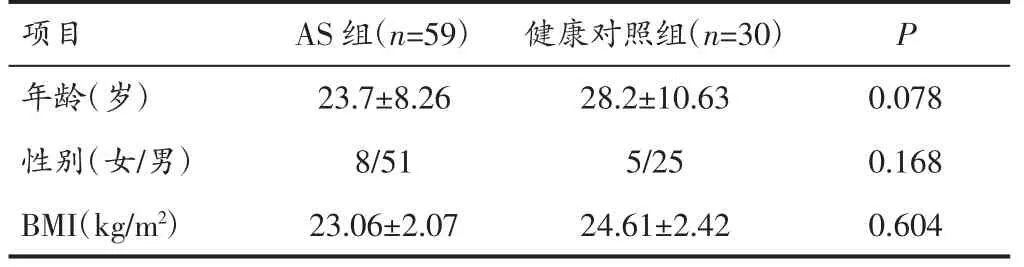
表1 两组患者一般资料比较
1.2 方法
1.2.1 临床资料。详细记录每例AS 患者及健康对照组的年龄、性别、BMI、魏氏法检测血沉(ESR),速率散色比浊法检测C 反应蛋白(CRP)。
1.2.2 药物治疗。所有AS 患者确诊后开始治疗。传统方法治疗组35 例,口服非甾体抗炎药联合柳氮磺吡啶(1.0g 2 次/日);TNF-α 拮抗剂组24 例,使用注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白(25mg 2 次/周皮下注射)。治疗3 个月后魏氏法检测ESR,速率散色比浊法检测CRP。
1.2.3 全血标本处理。取AS 患者治疗前后及健康对照组清晨空腹静脉血5mL,以枸橼酸钠抗凝,轻轻混匀后于180×g 离心10min,得到富血小板血浆(platelet rich plasma,PRP);将PRP 移至离心管,2500×g 离心10min,上清液即乏血小板血浆(platelet poor plasma,PPP),冻存于-80℃冰箱。
1.2.4 PMPs 检测。用抗原标记物CD42a+、CD42a+/CD31+标记PMPs,检测采用异硫氰酸荧光素(FITC)标记的抗CD42aIGg 单克隆抗体(购自BD 生物公司)与藻红蛋白(PE)标记的抗CD31IGg 单克隆抗体(购自BD 生物公司),流式细胞术检测CD42a、CD31 绝对数,结果用Flow jo 软件分析。
1.3 观察指标 比较两组PMPs 及CRP、ESR 差异;TNF-α 拮抗剂治疗与传统方法治疗前后PMPs 及CRP、ESR 差异。
1.4 统计学方法 使用SPSS18.0 软件进行统计学分析。计量资料采用均数±标准差(±s)表示,行正态性检验,AS 组与健康对照组间比较采用独立样本t检验,AS 治疗前后比较采用配对样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者PMPs 及CRP、ESR 比较 与健康对照组比较,AS 患者CRP、PMPs、CD42a+、CD42a+/CD31+均明显升高,差异具有统计学意义(P<0.05)。见表2。
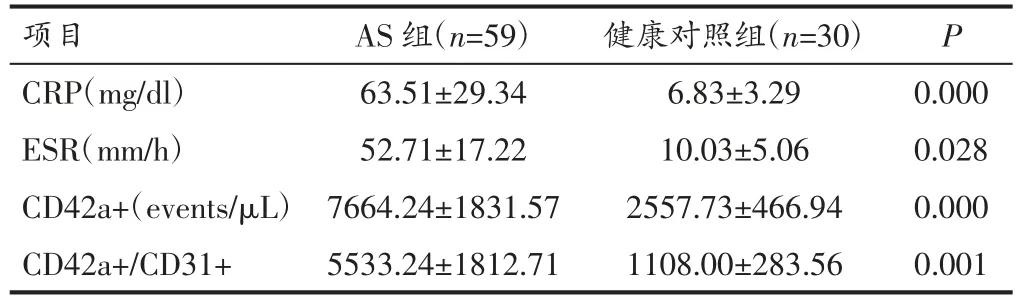
表2 两组患者PMPs 及CRP、ESR 比较
2.2 不同方法治疗前后PMPs 及CRP、ESR 比较 与治疗前相比,两种方法治疗后PMPs 降低、CRP 下降,ESR 减慢,差异均具有统计学意义(P<0.05)。与传统疗法相比,TNF-α 拮抗剂治疗后AS 患者PMPs、CRP、ESR 下降更明显,差异有统计学意义(P<0.05)。见表3。

表3 AS 患者治疗前后PMPs 及CRP、ESR 比较
3 讨论
AS 患者以男性居多且发病较早,男女发病比例约为2~3∶1,约80%患者30 岁之前发病,男性病情发展速度更快,症状更明显[6,7]。AS 病变主要以中轴关节慢性炎症为主,典型症状为骶髂关节炎,病变发展至晚期出现脊柱强直,呈“竹节”样改变,关节外症状主要表现为急性葡萄膜炎与虹膜炎、主动脉关闭不全和传导阻滞及肾脏淀粉样变等。本病致残率较高,严重影响患者的正常工作生活。CRP 是人类紧急情况下产生的一种与炎症反应相关的非特异性急性反应蛋白,CRP 升高表明体内存在炎症,且CRP 越高表明炎症越严重[8],CRP可作为AS 患者病情活动及临床疗效的评价指标之一。ESR 是一项实用的急性时相指标,可反映机体炎症和组织损伤,ESR 升高程度与疾病严重程度呈正相关[9]。本研究中AS 组CRP、ESR 相较于健康对照组均明显升高,提示AS 患者均有不同程度的炎症反应。
AS 患者是以中轴关节无菌性炎症为主要特征的慢性、进展性免疫炎性疾病。细胞因子是参与免疫炎症反应的重要分子,T、B 淋巴细胞、巨噬细胞、滑膜成纤维细胞均参与炎症的形成。PMPs 是活化或凋亡的血小板出芽脱落形成的一种超微囊泡结构,在电镜下直径介于100nm~1000nm 之间,占细胞微粒总数的70%~90%[10,11]。血小板膜上表达的40 多种糖蛋白及许多活化标志物大多可在PMPs 膜上表达,如GPIb、GPIa、GPIIa、GPIIb/IIIa、GPVI 及蛋白质二硫化物异构酶、趋化因子受体等。循环中PMPs 的含量反映了血小板的活化程度。PMPs 携带血小板激活产生的大量生物活性物质,而这些物质是体内促炎症分子的主要来源。其中分化抗原CD40 配体(CD40L)可通过活化单核巨噬细胞分泌趋化因子,使巨噬细胞聚集,促进炎症的发生,而循环中可溶性的CD40L 大部分来源于血小板及其微粒,因此,PMPs 具有显著的促炎作用[12]。另外,体外凋亡产生的PMPs 可以与单核细胞结合,诱导其在纤维粘连蛋白表面黏附并向M2 亚型转化,进而成为巨噬细胞发挥致炎作用[13]。本研究发现,AS 患者PMPs较健康对照组明显升高,表明PMPs 可能通过其促炎作用参与AS 的发生及病情活动,与王锋等[14]研究结论一致。而国外Ismail S 等[15]的研究结果发现,AS 患者组与健康对照组PMPs 浓度差异没有统计学意义,但该研究纳入病例仅限于男性,且均为轻度疾病活动的患者。因此,PMPs 与AS 的关系仍需进一步研究。
在过去的20~30 年间,尽管在减轻患者症状、减缓疾病发展等方面获得一定进展,但尚不能完全阻止AS 的进行性关节融合,同时高额的治疗费用给患者家庭带来了沉重的负担。对AS 患者的传统治疗主要以非甾体抗炎药(NSAIDs)以及缓解病情抗风湿的药物(DMARDs)为主。本研究AS 患者传统方法治疗组35例,口服NSAIDs 联合柳氮磺吡啶(1.0g 2 次/日)3 个月取得了较好的效果,患者临床症状缓解,CRP、ESR 及PMPs 较治疗前均有所下降。临床上AS 患者服用NASIDs治疗后晨僵以及腰背疼痛等症状均有所缓解,患者活动范围增加,关节肿胀减轻,但服用此类药物后患者易出现胃肠不适以及肝肾功能受损等较多不良反应。目前最常用的DMARDs 类药物为柳氮磺胺砒啶,该药物对AS 患者的外周关节症状得到良好改善,但由于该药物可引起患者消化系统不良反应、抑制造血系统的正常造血功能,部分患者甚至出现呼吸系统不良反应,影响生殖功能,难以耐受。
AS 可能与遗传、感染、免疫功能紊乱及某些生物因子相关。研究表明,TNF-α、白介素、血管内皮生长因子(VEGF)家族等均与AS 的疾病活动相关,每个细胞因子均具有多效性,效应互相重叠协同[16]。已有的针对细胞因子的拮抗剂在AS 的治疗中发挥了一定的作用[17]。TNF-α 主要由单核细胞、巨噬细胞、胸腺依赖淋巴细胞合成并分泌,主要功能为促进炎症反应的发生、发展,调节自身免疫。AS 患者体内TNF-α 升高可促进炎症瀑布反应,同时TNF-α 通过IG 对F-1、Osx 等因子的抑制作用而抑制成骨细胞分化,并刺激破骨形成,从而影响AS 患者的预后。现阶段临床上使用的TNF-α拮抗剂主要包括大分子抑制剂和小分子活性抑制剂。本研究24 例AS 患者接受抗TNF-α 生物治疗,使用注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白。研究发现,AS 患者PMPs 及CRP 均明显下降,血沉减慢,提示TNF-α 拮抗剂对于缓解AS 患者急性炎症反应有显著疗效,尤其对症状显著、CRP、ESR 提示严重炎症反应的患者治疗效果比NASIDs 及DMARDs 类药物效果更佳[18]。长期慢性炎症、免疫异常、骨破坏骨赘形成的过程会导致AS 患者体内TNF-α、IL-17 和IL-23 等炎症因子大量产生,血小板、内皮细胞和淋巴细胞等活化或凋亡,在其活化或凋亡过程中,会促进PMPs 的释放,表现为PMPs 表达升高[16]。本研究中两种治疗方法AS患者PMPs 与治疗前相比均下降,但TNF-α 拮抗剂治疗比传统治疗下降更加明显,表明TNF-α 拮抗剂可能通过抑制TNF-α 的活性进而快速的减少PMPs 的释放,降低PMPs 的表达。
综上所述,本研究发现PMPs 可能在AS 炎症的发生发展中具有重要作用,AS 患者外周血中PMPs 水平与炎症指标密切相关,在一定程度上反映了体内炎症水平,作为一种炎性指标对AS 患者诊断及治疗均有重要的临床意义,但是目前尚无法明确PMPs 影响AS发生及病情发展的具体机制,我们将在今后的工作中对这一问题进行深入研究。
