植物病原菌对SDHI类杀菌剂抗性研究进展
2021-01-07李培谦冯宝珍
李培谦,杨 瑾,冯宝珍
(运城学院 生命科学系,山西 运城 044000)
琥珀酸脱氢酶(succinate dehydrogenase,SDH)也被称为复合体II(Complex II)或琥珀酸泛醌还原酶(succinate-ubiquinone oxidoreductase,SQR),是真菌呼吸链的重要组分,该复合体由四个亚基组成,即黄素蛋白(SdhA)、铁硫蛋白(SdhB)及两个膜锚定蛋白(SdhC和SdhD)[1]。琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitor,SDHI)类杀菌剂通过覆盖线粒体复合体II辅酶Q位点,阻断电子由铁硫中心向辅酶Q传递,从而干扰真菌的呼吸作用,阻碍其能量代谢,抑制病原菌的生长,导致其死亡[1,2]。由于SDHI类杀菌剂独特的作用模式,与其他杀菌剂甲氧基丙烯酸酯类(Strobilurin)、苯并咪唑类(benzimidazoles)以及苯胺嘧啶类(anilinopyrimidines)不存在交互抗性,曾经是抗药性管理和病害防治的最佳选择[3,4]。第一代SDHI类杀菌剂于上世纪60年代末上市如萎锈灵(carboxin)主要用于防治锈病和菌核病,而对其他病原菌的防治报道很少[5]。新一代SDHI类杀菌剂主要成分诸如啶酰菌胺(boscalid)、氟吡酰菌胺(furametpyr)、吡噻菌胺(penthiopyrad)、thifluzamide、bixafen以及isopyrazam、penflufen等具有广泛的杀菌谱可用于多种作物[3,6]。但是由于作用位点单一,以及高频广泛应用促使大田病原菌群体产生选择抗性。新一代SDHI类杀菌剂,大大改善了病害防控效果,然而上市不久很多大田病原菌对其产生了抗性[7]。本文综述了植物病原真菌对SDHI类杀菌剂抗性的机制及进化情况,对此类杀菌剂的应用和开发提出建议。
1.SDHI类杀菌剂的作用方式和靶标位点
SDHI类杀菌剂的靶标是呼吸链上的琥珀酸脱氢酶复合体(即复合体II,或琥珀酸泛醌还原酶SQR)[2]。有氧呼吸过程中,琥珀酸脱氢酶复合体将线粒体基质中的琥珀酸氧化为延胡索酸,同时将线粒体膜上疏水电子载体泛醌(UQ)还原为UQH2[8]。除了在呼吸系统中起到脱氢酶作用,SDH在三羧酸循环中也起到重要作用。线粒体SDH复合物由膜周边结构域和膜锚定结构域组成(图1)。复合体的外围区域有两个亲水性的亚基组成SDHA和SDHB,形成复合体的可溶性部分并且具有琥珀酸脱氢酶活性,将琥珀酸氧化为延胡索酸。SDHA是一种黄素蛋白(Fp),具有共价的FAD共因子,是催化部位的一部分。SDHB是一种铁硫蛋白(Ip),具有三个不同的铁硫簇,为FAD与膜醌间电子传递服务(图1)[9,10]。
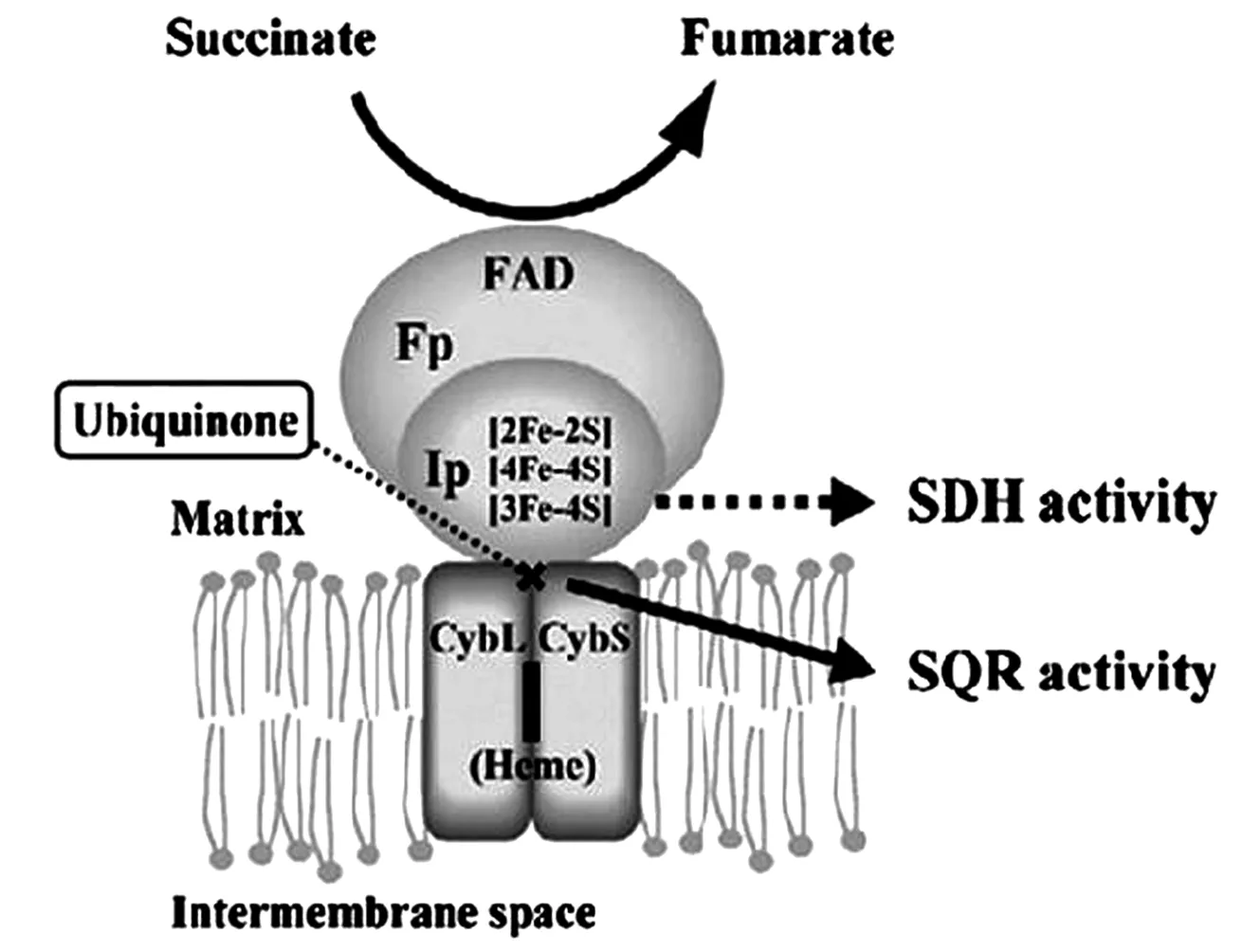
图1 复合体II亚基结构及酶活性[10]
各物种中Fp和Ip基因序列高度保守,说明是由共同的祖先基因进化而来[9]。整个膜锚定区域由两个疏水蛋白亚基SDHC和SDHD组成。除蛋白外组分外,复合体II还包含一个血红素b基团,复合于SDHC和SDHD之间[9,11]。由于血红素b含量差异和序列同源性很低,致使疏水膜域存在多样性。膜锚定区域包含泛醌还原和抑制剂的结合位点,并将催化亚单位(Fp和Ip)固定在线粒体内膜上,从而促进电子向辅酶醌的传递[12]。SDHI类杀菌剂通过覆盖泛醌位点阻断电子由[3Fe-4S]向辅酶Q传递来干扰呼吸[8,13]。
2. SDHI类杀菌剂抗性分子机制
2.1 萎锈灵抗性
多种病原物已对萎锈灵及其结构类似物产生了抗性,而且抗药性源于病原菌SDH基因突变。玉米黑粉病Ustilagomaydis对萎锈灵的抗性是由于SDHB基因上保守的257位组氨酸残基突变为酪氨酸或亮氨酸引起(9H257Y/L)[14]。对大肠杆菌Escherichia coli泛醌结合位点(Q位点)结构分析显示存在两个潜在的结合位点;其中一个潜在的Q位点与保守的组氨酸残基非常接近,表明了组氨酸在泛醌结合和还原中起作用[8]。该研究中还发现萎锈灵与泛醌在保守组氨酸(H207)附近以同样的方式结合,这些结果足以说明组氨酸残基与SDHI类杀菌剂结合的重要性。禾生球腔菌Mycosphaerellagraminicola中SDHB基因突变H267L/Y导致了对萎锈灵的抗性[15]。在Xanthomonascampestris中SDHB基因第229位组氨酸突变导致抗性产生[16]。有些报道表明,萎锈灵抗性还与膜锚定蛋白SDHC和SDHD突变有关[1]。担子菌Coprinuscinereus对氟酰胺抗性菌株的SDHC基因发生点突变,80位天冬酰胺被赖氨酸取代N80K[1],该突变株对萎锈灵表现出交叉抗性。已经从稻瘟病菌分离到萎锈灵抗性菌株,并鉴定了(SDH)B、C和D亚基的三个基因位点的突变情况,它们均与抗药性有关[17]。
2.2 啶酰菌胺抗性
大田和实验室关于丝状真菌对啶酰菌胺的抗性早有报道(见表1)。很多学者已对啶酰菌胺抗性机制进行了研究,基因测序结果表明抗性产生是sdhB、sdhC和sdhD氨基酸残基突变造成的。
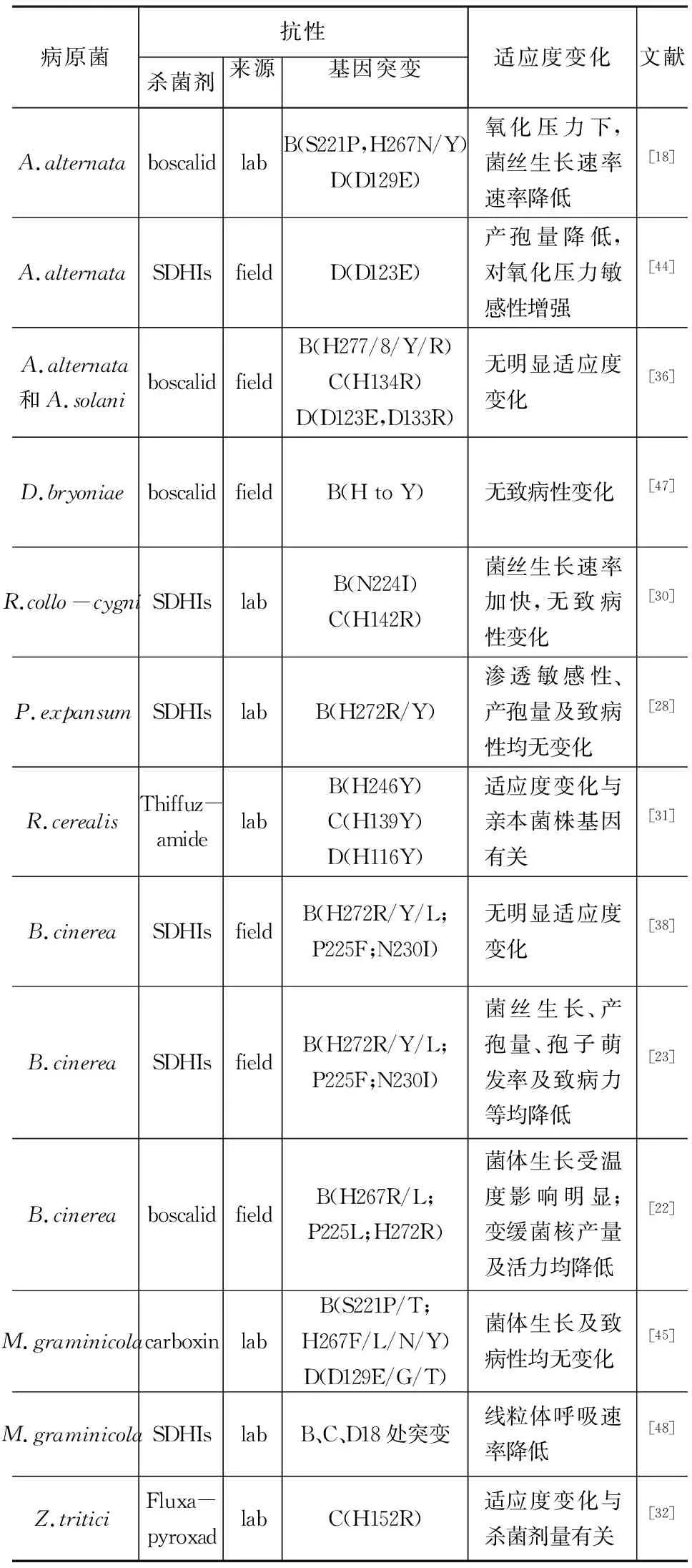
表1 对SDHI类杀菌剂抗性植物病原菌适应度变化
有研究表明Alternariaalternata对啶酰菌胺抗性源于sdhB发生S221P、H267N/Y、H272Y/R突变和sdhDD129E突变,并且对啶酰菌胺表现高抗水平性的菌株对萎锈灵存在交互抗性[18]。马铃薯早疫病(A.solali)sdhC及sdhD基因发生突变引起对啶酰菌胺的抗性的产生[19]。对黄瓜褐斑菌(Corynesporacassiicola)抗性菌株测序发现sdhB基因发生H278Y突变[20],后来的研究还发现该菌sdhC或sdhD基因突变都能导致对啶酰菌胺抗性[21]。
对大田啶酰菌胺抗性的灰葡萄孢B.cinerea菌株测序发现,sdhB基因同时存在两个位点突变,即H272Y/R和P225L/T/F。分子建模研究表明所有的突变氨基酸都位于或靠近泛醌结合位点,突变导致了与SDHI类杀菌剂亲和力的下降或丧失[3]。对大田灰霉菌(Botrytiscinerea)啶酰菌胺抗性菌株分析发现sdhB基因除了H278R突变外,还出现了H267L/R、P225F/L、N230I等多位点突变[22,23]。灰霉菌sdhD基因272位组氨酸突变为亮氨酸(H272L)、230位天冬氨酸突变为亮氨酸(N230I)以及132位组氨酸突变为精氨酸(H132R)也能导致病原菌抗性的产生[24]。林泽松等对果蔬灰霉病抗性菌株分析发现啶酰菌胺抗性菌株的琥珀酸脱氢酶B亚基发生了3处突变包括H272R、P225F和N230I,其中H272R型突变为主要类型;同时C亚基的发生了4种突变[25]。刘欣等利用AS-PCR分析了上海地区草莓灰霉菌抗性菌株发现sdhB基因发生了P225F、N230I、H272R和H272Y 4种突变类型[26]。此外,Li et al.也发现草莓灰葡萄孢啶酰菌胺抗性菌株以B亚基H272R突变为主[27]。
此外,实验室紫外诱变Penicilliumexpansum菌株对boscalid高抗,测序分析其B亚基发生了点突变H272R/Y[28]。
由于sdhB基因在生物体内高度保守,各种病原菌中突变的组氨酸残基也是保守的。比如A.alternata中His277与B.cinerea的His272、U.maydis的His257、M.graminicola中His267以及X.campestris中His229是相对应的[29]。尽管各物种锚定蛋白基因sdhC和sdhD同源性很低,但是泛醌结合位点的氨基酸却非常保守,突变的氨基酸可能参与杀菌剂的结合作用[29]。
2.3 其他
通过紫外线诱导获得了对多种SDHIs具有抗性的5个Ramulariacollo-cygni菌株,并对琥珀酸多氢酶亚基测序结果显示sdhC发生H142R突变的菌株对boscalid高抗(RF=1114),而对另外4种SDHIs(bixafen、isopyrazam、carboxin和fluopyram)表现中抗(16 杀菌剂抗性监测对于评估药效和揭示病原菌敏感性早期转变是必不可少的,也可为杀菌剂施用提供建议。 抗药性监测的第一步是建立病原菌对某一杀菌剂的敏感基线[33]。利用传统的生物测定法测定了多种病原物对SDHIs的敏感基线,并检测到多种重要病原体的抗性菌株。利用微量滴定板液体培养基中菌丝生长测定法,作为建立基线灵敏度和监测杀菌剂抗药性的方法。比如Sclerotiniasclerotiorum[3]、灰葡萄孢[34]核盘菌及Moniliniaspp.[35]等都是利用此法测定的。还可以利用含有药的平板测定菌丝生长速率和分生孢子萌发法来检测敏感性,如Alternariaspp.[36]、B.cinerea[4,37,38]、R.cerealis[31]以及P.expansum[28]等都是利用此类方法测定敏感性。敏感基线的建立不仅促进了利用单一鉴别剂量的杀菌剂进行快速体外监测程序发展,而且还适用于广泛的监测研究。 传统的杀菌剂抗性测定方法费时费力,而利用DNA分析可以快速准确地检测病原菌群体中抗性等位基因的突变情况以进行抗性风险评估。DNA检测技术的应用可以改善风险评估,优化抗性管理,以及新农药产品的推广普及。利用限制性片段长度多态性(RFLP)、等位基因特异性(AS-PCR)以及微卫星引物分析(MP-PCR)等手段都可以检测抗性菌株靶标基因突变情况。利用RFLP能够分析链格孢对啶酰菌胺抗性的不同基因突变类型H277R、H133R、H134R、D123E[18]。通过AS-PCR可以分子诊断链格孢SDHB基因发生的H277R/Y突变以及SDHC基因的H134R突变[18]。利用AS-PCR分析了抗啶酰菌胺灰葡萄孢sdhB基因序列发生的抗性突变类型[25,26]。Yin et al.利用MP-PCR区分了对啶酰菌胺抗性灰葡萄孢H272R/Y突变的菌株[37]。此外,利用同源克隆法分析啶酰菌胺抗抗性菌株sdhA、sdhB、sdhC和sdhD基因序列发现sdhB基因发生点突变[27,39]。利用分子诊断方法,对180个链格孢的啶酰菌胺抗性菌株检测,发现发生H277Y或H277R突变的菌株分别达到45%和35%。只有5个菌株C基因发生了H134R突变。并且分子诊断分析与传统分析的结果一致,更说明了作为常规检测方法,分子检测准确性和可靠性[29]。 适应度是生物个体在环境中生存的能力,这种能力能够遗传给下一代[40]。适应度既可以衡量个体在环境中的表现,也可以比较群体中不同个体的表现差异。植物病原真菌的适应度组成项目通常包括孢子的形成萌发、菌丝生长、致病性、突变类型、呼吸速率、酶活性以及种群结构等方面[22,23,41,42]。在杀菌剂选择压力下,病原菌抗药性的产生伴随着适应度代价[43]。因此,从适合度角度描述抗药菌株对于预测未来整个种群的行为和实施病害控制策略是至关重要的。目前很多学者都对病原菌适应度进行了研究,但由于试验条件差异以及评判标准不同致使实验结果迥异(见表1)。 链格孢实验室突变体sdhB(S221P、H267N、H267Y)和sdhD(D129E)类型菌丝在正常条件下生长速率无明显变化,但是在氧化压力下生长速率降低[18]。田间链格孢突变株sdhD-D123E类型产孢量下降,氧化敏感性增强,而其他类型如B-H277Y/R、C-H134R和D-H133R突变菌株无适应度变化[44]。sdhD-D123E,sdhB-H277/8 Y/R,sdhC-H134R,及sdhD-H133R突变的菌株中也没有发现菌丝生长速率及分生孢子活力变化[36]。实验室获得的Z.tritici抗性菌株线粒体呼吸速率明显降低,但在菌体生长速率及致病性方面无明显变化[45]。据报道,大田Corynesporacassiicola和D.bryoniae抗/感菌株的致病性不存在差异[29]。Ramulariacollo-cygni和P.expansum抗性突变菌株致病力无明显变化[30,46]。然而,Rhizoctoniasolan突变体菌核产量和致病力均明显下降[29]。 大田和实验室条件下对灰霉菌适应度研究结果迥异。有研究发现H272R/Y/L、P225F和N230I突变型菌株在菌丝生长速率、产孢量、菌核产量以及对渗透压敏感性方面与敏感性菌株间无明显差别[38]。而竞争分析试验研究中发现H272R/Y/L,N230I,和P225F突变型菌株的适应度均低于敏感性菌株[23]。等位基因转化试验发现H267L/R菌株在一定培养基上高温下生长较慢,但在基本培养基上的低温下生长较快;P225L/H272R型转化子菌核产量明显减少[22]。有些病原菌的sdhB突变株对氟吡菌酰胺没有交互抗性或者表现负交互抗性,但是其他的突变类型,特别是sdhC突变菌株对现有的SDHI都表现高抗[45]。实验室内分析往往检测菌体生长速率或者无性孢子产量方面明显的变化,然而对于较小的适应性差异,需要采用灵敏度更大的竞争分析法。竞争分析法更贴近自然条件,将抗性和敏感性菌株按一定比例混合侵染大田寄主,然后qPCR法测量抗性菌株等位基因含量[49]。竞争分析法更能评估病原菌群体总的适合度,对今后适合度评估具有重要现实意义[41]。然而,迄今还没有关于就抗性风险评估的适应度测定方法的统一标准。 通过了解与抗性起源、发展和传播有关的因素,可以在最大程度上实现有效的抗性预防和策略制定。尽管杀菌剂抗药性是限制药效和使用寿命的一个关键因素,但是抗性也有助于我们在分子水平上了解杀菌剂的作用机制。利用分子遗传技术,已经在病原菌的靶基因中发现与SDHI抗性相关单个核酸多态性。新的SDHI杀菌剂已经开发出来,其中一些与现有的SDHI具有不同的交互抗性模式。杀菌剂的内在活性是基于对目标位点的特异性和亲和力和结合强度。SDHI杀菌剂活性的差异可能是由于它们与抑制剂结合位点中琥珀酸脱氢酶亚基中氨基酸残基的结合亲和力或相互作用的差异所致。对真菌病原菌中SDH基因氨基酸突变情况的了解有助于对这类杀菌剂抗性机制的认识。这将促进发展快速可靠的分子诊断技术,以便在大范围内仔细监测对SDHI杀菌剂的抗性,并进一步帮助设计抗性管理策略,以及针对特定真菌病原体UQ位点的活性成分替代抑制剂。3. 抗性突变体检测方法
3.1 生物测定法
3.2 分子检测法
4.SDHI啶酰菌胺抗性菌株的适应度评估
5. 研究展望
