CircRNA进展
2021-01-07汤博艺
汤博艺
(西藏大学理学院,西藏拉萨 850012)
1976年,Sanger等[1]提出一种“共价闭合环状单链RNA”的类病毒,这是人类首次证明环状RNA(Circular RNAs,CircRNA)的存在。随后人们相继在酵母细胞、小鼠睾丸、人体成纤维细胞内发现CircRNA。自90年代末起,更多的CircRNA证明与人类的细胞色素P450基因、人类抗营养不良基因、人类细胞周期蛋白依赖性激酶4(INK4/ARF)等基因有关。这些早期的研究清楚地证明了环状RNA分子的存在,但其潜在价值尚未发掘。
自2010年起,随着RNA测序技术和生物信息学技术的进步,关于CircRNA的研究开始高速发展。使用RNase R(一种来源于大肠杆菌RNR超家族的3'~5'核糖核酸外切酶)[2]预处理,分析无聚腺苷酸富集的CircRNA文库,不仅可以富集CircRNA,还可以将真实的CircRNA与带有折叠错误的mRNA区分开来。目前,多项研究揭示了CircRNA在人类、小鼠和果蝇中以组织和发育阶段特异性的方式进行表达,并与免疫应答、癌症发生等生理病理过程相关,可以作为疾病诊断的生物靶标。
1 CircRNA的分子结构
CircRNA不具5'末端帽和3'末端poly(A)尾,是一类共价环状内源ncRNA,主要具有以下特征:(1)在真核生物的组织细胞中表达相当丰富,且表达具有组织特异性和时空选择性,CircRNA在某些人体组织中的分子总量甚至达线性RNA的10倍以上;(2)CircRNA对核酸酶具有抗性,稳定性较ncRNA更强,并且大多CircRNA的进化十分保守;(3)CircRNA通常包含完整的外显子,位于细胞质中,只有少数CircRNA由内含子环化而成,位于细胞核中。
2 CircRNA的生物起源
CircRNA由前体mRNA(pre-mRNA)产生,并由RNA聚合酶Ⅱ转录。目前,发现的CircRNA可以根据其不同的组成和循环机制简单地分为3种类型:外显子CircRNA(EcircRNA)、内含子CircRNA(CiRNA)和外显子-内含子CircRNA(EIciRNA)。
2.1 EcircRNA
EcircRNA通过外显子的反向剪接形成。目前,有3种假设模型解释EcircRNA的发生:外显子跳读、内含子配对驱动环化和RNA结合蛋白(RBP)介导的环化。如图1所示,在形成EcircRNA时,premRNA在转录过程中发生部分折叠,外显子随RNA折叠而跳跃,形成“套索结构”,在套索结构内通过剪接去除内含子序列后形成CircRNA,这种方式称为“外显子跳读”;由pre-mRNA两侧内含子上的反向互补序列配对形成CircRNA称为内含子配对驱动环化;此外,一些RNA结合蛋白被发现在环状RNA的形成中起关键作用[2]。ADAR1是一种RNA编辑修饰酶,不仅能编辑修饰RNA,还可以通过靶向定位人类细胞中的双链Alu重复序列结合双链RNA,从而具有RBP(视黄醇结合蛋白)功能,因此ADAR1可通过干扰RNA配对抑制CircRNA形成。DHX9是一种丰富的核RNA解旋酶,具有一个类似于ADAR的特殊结构域。沉默DHX9通常通过解开环状外显子侧面的RNA双链来增加环状RNA的产量。
2.2 CiRNA
多数内含子形成套索结构时迅速被去分支酶降解。然而,在Hela细胞和人胚胎干细胞中有一些包含位于5'端的GU重复序列和位于分支点的CC重复序列的内含子能逃避去分支酶的降解,形成ciRNA。
2.3 EIciRNA
两个以上的EcircRNA环化时,内含子切除不完全可产生EIciRNA。EIciRNA主要位于细胞核中。
3 CircRNA功能
3.1 CircRNA充当microRNA海绵
CeRNA假说表明,microRNA可以结合在靶基因上,在转录后水平影响mRNA的稳定性和转录;然而,microRNA自身又受到ceRNA的调控。许多CircRNA具有不同类型和数量的microRNA结合位点,从而具有microRNA海绵效应,降低microRNA活性并上调microRNA相关靶基因的表达,发挥高效ceRNA功能。例如,小脑退行性相关蛋白基因1(CDR1)的CircRNA分子(CDR1as-ciRS-7)有超过60个保守的miRNA-7结合位点。在人类和小鼠脑组织中,ciRS-7作为miR-7的分子海绵,抑制miRNA miR-7与靶基因CDR1的结合,进而正向调控miR-7靶基因。
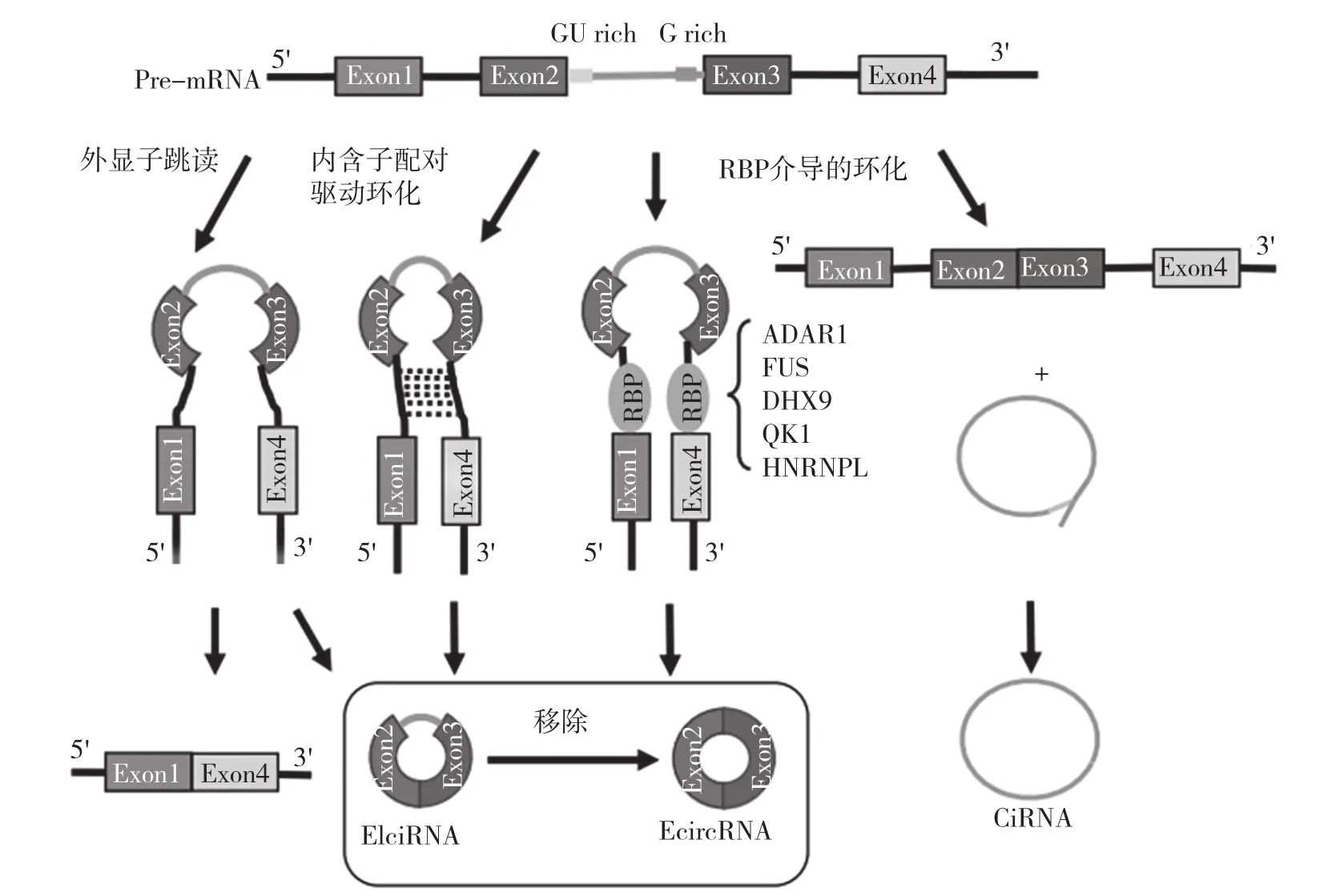
图1 Circ RNA的三种剪切方式
然而,特定CircRNA丰度(除了果蝇的MBL和人类的CDRIas)通常较低,这与经典的CircRNA-microRNA海绵假说似乎相矛盾。因为microRNA的表达十分丰富,microRNA与靶基因的结合位点也远比与CircRNA结合的位点更多,这大大降低了CircRNA与microRNA结合的可能性。因此CircRNA还可能发挥催化作用,直接激活、降解或灭活microRNAs,但此猜想尚无明显证据。
3.2 CircRNA调节基因转录
除充当MicroRNA海绵外,一些ciRNAs和EIciRNAs还可以通过转录或转录后的方式调控基因表达来调控蛋白质的产生。EIciRNAs可与U1小核核糖核蛋白(U1-small nuclear ribonucleo protein,snRNP)相互作用,通过与RNApolⅡ结合,促进亲代基因转录。此外,一项研究发现,剪切因子MBL的第2个外显子可发生环化,以CircMbⅠ的形式与premRNA通过线性剪切竞争,影响线性RNA的形成,调控相关基因的表达。
3.3 CircRNA与肿瘤相关
CircRNA对肿瘤具有抑制作用。Shang等[3]发现,hsa_circ_0005075的表达在肝癌组织和正常组织存在差异,其表达和肿瘤大小有密切关系,并展示出良好的诊断潜力。Li等[4]研究发现,hsa_circ_002059作为一种典型的circRNA在胃癌组织中低表达,与胃癌转移、TNM分期、性别和年龄等密切相关。因此,CircRNA有望作为一种新型的生物标志应用于肿瘤的诊断。
4 CircRNA研究面临的挑战
随着测序技术和生物信息学的发展,越来越多的CircRNA逐渐被发现,成为RNA领域的研究热点。然而,CircRNA的研究仍然面临许多挑战。(1)目前国际上对于CircRNA并没有统一的命名约定,极易造成混淆。(2)目前,关于CircRNA的数据库还不完善。虽然研究人员可以通过多个数据库预测CircRNA的功能,但是还没有与肿瘤预后相关的CircRNA数据库,在RNA-seq后功能CircRNA的筛选方面面临困难。
5 结语
CircRNA的发现丰富了人们对生物进化的认识,加深了对非编码RNA家族的理解,为研究肿瘤的发生发展提供了新的方向。虽然目前对于CircRNA在肿瘤中形成、转运和功能的确切机制的认识还非常有限,但是随着新技术的应用和科学家的不断努力,相信与CircRNA有关的未知之谜终将被揭晓答案。
