吡咯-2-羧酸的生物合成及生物活性研究
2021-01-07胡倩王松龄周雨付海兰
胡倩,王松龄,周雨,付海兰
(福建师范大学,福建福州 350000)
吡咯-2-羧酸(pyrrole-2-carboxylic acid),又名2-羧基吡咯、2-吡咯甲酸、吡咯-2-甲酸、2-吡咯羧酸,其结构式如图1所示。吡咯-2-羧酸具有富电子的吡咯环和提供亲核中心的2-羧酸,是生物体(包括细菌、放线菌、真菌、植物、动物和人类)产生的一种常见代谢物,在许多生物的代谢调节中起重要作用。吡咯-2-羧酸具有特殊的化学和物理电子特性,这些特性在生物环境中很容易被利用。吡咯环是平面结构且富含电子,对电子的攻击高度敏感,能够氧化并参与π-π堆积和氢键的相互作用。含有吡咯环结构的四吡咯是血红素和相关的类卟啉类辅助因子[1][如血红素b、维生素b12、叶绿素α3和因子430(图2)]的骨架,铁、钴、镁或镍原子被螯合在其大环的中心平面上。另外,吡咯-2-羧酸中的2-羧酸为与氢键结合以及与生物靶标反应提供了亲核中心。总之,吡咯-2-羧酸具有富电子的吡咯核,能够与亲电试剂反应,而其缺电子羰基转化为硫酯形式后容易受到亲核攻击。这些化学和物理电子特性,使得含吡咯的分子表现出明显的生物活性。本文根据吡咯-2-羧酸相关文献对其生物合成及生物活性研究进行分析与总结,以期为吡咯-2-羧酸的研究应用奠定基础。

图1 吡咯-2-羧酸结构式
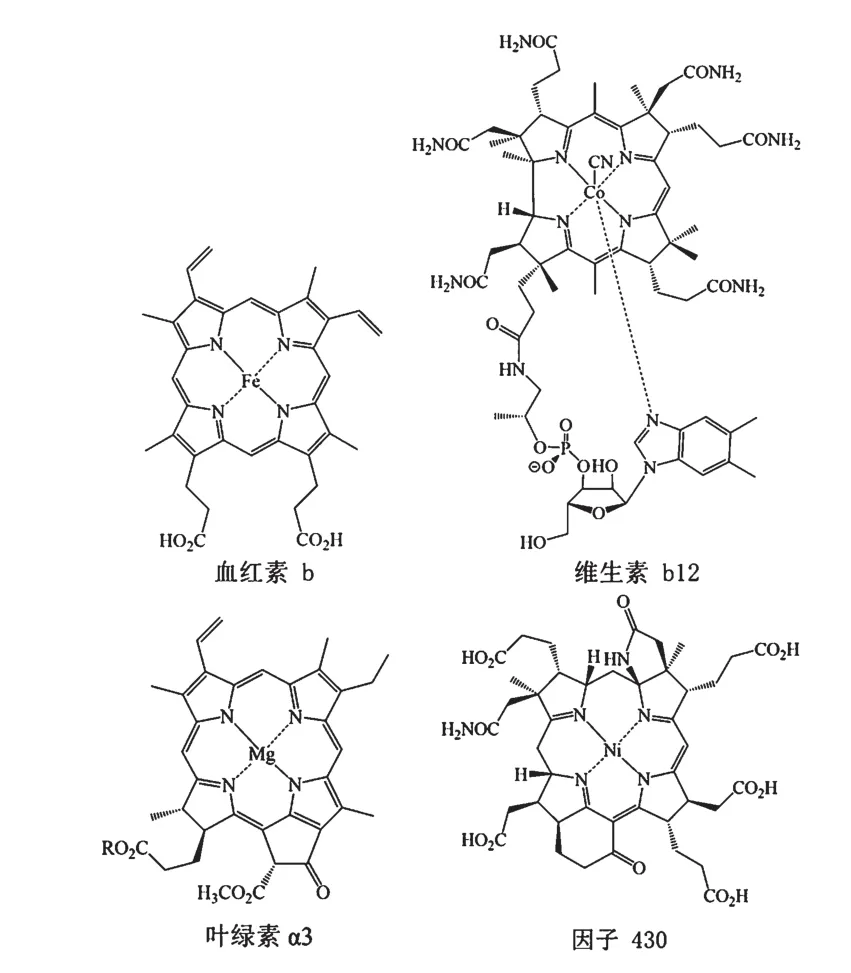
图2 血红素及类卟啉类辅助因子结构式
1 吡咯-2-羧酸的生物合成
根据相关报道,通过酶促氧化、过氧化氢对羟脯氨酸的非酶促氧化作用以及酶促和非酶促氨基转移作用都可以形成吡咯-2-羧酸。还有报道表明,CloN2家族以及NgnN4家族等一系列基因参与吡咯-2-羧基的生物合成过程[2-6]。
1949年,Hiyama用10%(W/V)氢氧化钾处理牛舌下腺黏蛋白10 h,在100 ℃下通过复杂的程序从水解液中分离出一批晶体,通过元素分析,该化合物被鉴定为吡咯-2-羧酸[7]。随后在羟脯氨酸代谢实验中,吡咯-2-羧酸被鉴定为Δ1-吡咯-4-羟基-2-羧酸的脱水产物[8](图3)。后者是由哺乳动物脯氨酸D-氨基酸氧化酶或假单胞菌的特异性异羟基-D-脯氨酸氧化酶催化羟基-D-脯氨酸[9]而形成的。
吡咯羧酸可来自D-氨基酸氧化酶对羟脯氨酸的氧化作用,该反应解释了吡咯羧酸为何会出现在施用羟脯氨酸D-异构体后的大鼠或人类的尿液中[10]。并且在羟脯氨酸代谢的实验过程中,羟脯氨酸与肾脏制剂混合培养形成了一种吡咯-2-羧酸的化合物[11]。Radhakrishnan等[12]的研究表明,肾脏D-氨基酸氧化酶将羟基-D-脯氨酸和异羟基-D-脯氨酸氧化成中间化合物Δ1-吡咯-4-羟基-2-羧酸,Δ1-吡咯-4-羟基-2-羧酸将自发转化(在pH 8.3下)为吡咯-2-羧酸,这种转化在酸性溶液中更快。另外,在碱性硫酸铜的存在下,过氧化氢对羟脯氨酸的非酶促氧化反应中主要产物为吡咯-2-羧酸。该反应中形成的中间体可能与羟脯氨酸的酶促氧化过程中存在的中间体相同[12]。
此外,吡咯-2-羧酸也是γ-羟基鸟氨酸与乙醛酸、丙酮酸或α-酮戊二酸发生转氨作用的产物[13]。有证据表明,在γ-羟基鸟氨酸的酶促和非酶促氨基转移作用下形成吡咯-2-羧酸,该反应涉及的氨基转移是α-氨基而不是δ-氨基[14-16]。

图3 羟脯氨酸产生吡咯-2-羧酸的代谢过程
一些基因涉及吡咯-2-羧基的生物合成,其衍生物已被鉴定。例如,在玫瑰色链霉菌DS 12.976中,CloN1、CloN7、CloN2及CloN6基因参与了将吡咯-2-羧基部分向氯霉素脱氧糖转移的过程[2-5]。在诺卡氏菌CS682生物合成Nargenicin A1(阿根诺卡菌素A1)的途径中,NgnN4(脯氨酸腺苷转移酶)、NgnN5(脯氨酸载体蛋白)和NgnN3(黄素依赖性酰基辅酶A脱氢酶)一系列基因用于将L-脯氨酸转化为吡咯-2-羧酸部分的过程。并且基于溶杆菌OH11基因组数据,研究人员尝试从OH11基因组中找到与吡咯-2-羧酸衍生物相关的基因[6]。
2 吡咯-2-羧酸的生物活性研究
根据吡咯-2-羧酸的吡咯环以及其2-羧酸结构的化学和物理电子特性,相关研究人员对其生物活性进行研究。吡咯-2-羧酸具有杀藻、抗有丝分裂、抑制细胞生长[17]和抗植物病原真菌[18]等作用,并含有生物杀真菌剂[19]、抗血小板物质[20]。从赤杆菌3-20A1M分离出的吡咯-2-羧酸对引起赤潮的球菌具有杀藻作用,可作为高效杀藻剂,减少对海洋初级生产者生态系统的影响[21]。吡咯-2-羧酸具有很强的抗真菌活性,其最低抑菌浓度(MIC)为4 μg/mL。在64 μg/mL的浓度下,辣椒疫霉菌的菌丝体生长几乎被抑制[19]。研究人员还发现吡咯-2-羧酸是4-羟脯氨酸-2-差向异构酶(HyPRE,是包括假单胞菌在内的各种致病细菌中表达的重要的酶[22-25])的选择性抑制剂,其半数最大抑制浓度为2.3 mmol/L[26]。吡咯-2-羧酸也是水稻幼苗叶片中植物抗毒素的引发剂[27],其对有害稻瘟病菌具有抑制作用。在血清中,吡咯-2-羧酸明显减少是因为氧化应激(ROS)反应增加而导致食管鳞状癌细胞转移,这被认为是癌症的早期预测和诊断的生物标志物[28]。另外,吡咯-2-羧酸也是果胶暴露标记[29]和乌头碱中毒的尿液生物标志物[30],其在代谢调节中起重要作用。
含吡咯的分子往往表现出明显的生物活性,如抗菌、抗真菌、抗炎或抗肿瘤作用,是生物碱、卟啉、二氢卟酚和咕啉等天然产物中的重要组分。例如,香豆素家族产生的吡咯霉素、藤黄绿脓菌素和硝吡咯菌素等(图4),都是从生物菌株中分离出来的次生代谢物,能够抑制真菌在植物表面的生长[31]。此外,吡咯-2-羧酸和羧酰胺类化合物是全合成天然产物,是片螺素(海洋软体动物活性物质)或溴吡咯生物碱(hanishin或longamide B)中经常使用的中间体。另外,吡咯-2-羧酸衍生物可作为杀虫剂,对蚜虫和朱砂叶螨有很高的抑制活性[32]。含有3个吡咯环均被完全甲基化的偏端霉素A类似物,是一种具有抗病毒和抗生素活性的吡咯寡肽[33]。
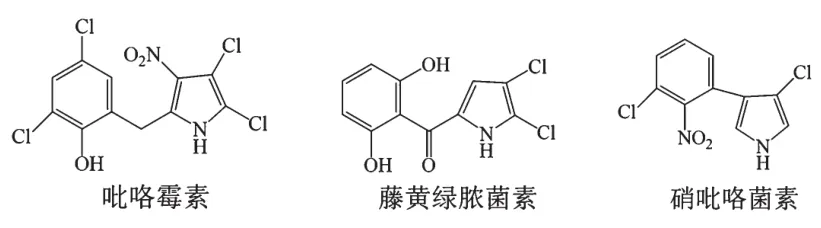
图4 香豆素家族产生的含吡咯环化合物的结构式
3 结语
含吡咯的分子表现出的抗菌、抗真菌、抗炎或抗肿瘤作用等生物活性,为吡咯-2-羧酸用于医药用途提供了可能。在环境保护方面,吡咯-2-羧酸具有杀藻作用,可作为高效杀藻剂。在农学方面,吡咯-2-羧酸具有抗植物病原真菌,作为生物杀真菌剂。另外,在医学临床研究方面,吡咯-2-羧酸明显减少的症状也可作为癌症的早期预测。对吡咯-2-羧酸相关研究的深入,可为其应用研究提供更广泛的思路。
