CPB期间静脉泵注Dex的大鼠海马CA1区神经细胞凋亡情况、脑皮质组织IL-6表达变化及其机制
2021-01-07张璐谢玉波陈燕桦卢伊芝何芳梁蓓薇
张璐,谢玉波,陈燕桦,卢伊芝,何芳,梁蓓薇
广西医科大学第一附属医院,广西南宁 530021
体外循环(CPB)技术常用于临床心内直视手术,它的使用大大降低了心脏手术后患者心肌梗死、心力衰竭等心血管不良事件的发生率及其他心脏原因相关病死率[1]。然而研究[2-3]发现,CPB会对心脏手术患者产生神经损伤,术后患者常出现认知功能障碍、谵妄、中风等现象。右美托咪定(Dex)是一种能高度选择性激动α2肾上腺素能受体的新型药物,具有一定地中枢抗交感、镇静和镇痛作用,临床上常被用做麻醉辅助剂。围手术期间泵注Dex可显著降低CPB心脏手术后患者出现中风和谵妄的概率,且具有脑保护作用[4]。心脏手术患儿CPB期间可导致脑血流自动调节功能受损,海马神经元凋亡及大量炎症因子释放,而Dex应用于心脏手术能减轻神经细胞凋亡和炎症反应[5-6],但关于其具体机制的研究尚少。Janus激酶2/信号转导子和转录激活子3(JAK2/STAT3)信号通路参与调节脑损伤后细胞存活、细胞增殖、细胞周期进展和血管生成的基因表达[7],抑制此通路可加速凋亡过程中神经细胞的恢复,减少凋亡细胞的数量,从而降低脑梗死的大小,改善神经功能[8]。2019年9月—2020年3月,我们观察了体外循环(CPB)期间静脉泵注右美托咪定(Dex)的大鼠海马CA1区神经细胞凋亡情况、脑皮质组织IL-6表达变化,并探讨其机制。
1 材料与方法
1.1 实验动物 健康雄性成年SPF级SD大鼠48只,体质量300~350 g,由广西医科大学实验动物中心提供[SCXK(桂)2016-0054],所有动物实验操作均在实验动物中心屏障动物实验设施完成[SYXK(桂)2016-0037]。本实验经广西医科大学第一附属医院伦理委员会的批准[2016(KY-E-002)],并严格按照实验动物使用的3R原则给予人道主义的关怀。
1.2 药物、试剂及仪器 Dex(批号:15011032,江苏恒瑞医药股份有限公司);IL-6 ELISA试剂盒(美国eBioscience公司),TUNEL试剂盒(美国Roche公司),BCA蛋白测定试剂盒(上海双螺旋生物科技有限公司),兔抗大鼠pJAK2、pSTAT3单克隆抗体(美国Abcam公司),红外标记的二抗(美国Cell Signaling Technology公司),Western blot一抗、二抗稀释液(上海碧云天生物科技研究所);小动物膜式氧合器(东莞科威公司),体外循环机(德国Stockert公司),电泳仪(美国Bio-Rad公司)。
1.3 实验动物分组、Dex给药方法及CPB模型制备 48只大鼠按照随机数字表法分为3组各16只。①Dex组(D组):在制模前10 min按照5 μg/kg的负荷剂量静脉泵注Dex,后制备CPB模型,即大鼠腹腔注射1%戊巴比妥钠(50 mg/kg),麻醉成功后将大鼠仰卧固定于操作台上,运用16 G静脉套管针进行经口腔气管插管,设置小动物呼吸机参数(潮气量3 mL/100 g,频率60次/分),进行机械通气。大鼠右侧颈前区,左右腹股沟区常规剪毛、消毒,后分别行1 cm左右大小切口,用玻璃分针钝性分离出大鼠右颈外静脉,右股静脉和左右股动脉,行左股动脉穿刺并置入24 G静脉套管针,用作监测实时动脉血压、血气变化和全身肝素化处理,左侧股动脉穿刺并置入24 G静脉套管针,用作连接小动物膜式氧合器出血端即CPB灌注端,右颈外静脉穿刺并置入20 G静脉套管针至右心房,右股静脉穿刺并置入22 G静脉套管针,将右颈外静脉、右股静脉联合用作连接小动物膜式氧合器入血端即CPB流出端,转机开始前经左侧股动脉注入肝素钠500 U/kg,若ACT>480 s开始转机,转机开始后,流出端依靠30 cm左右的重力差引流血液至贮血器,通过滚轴泵入氧合器经灌注端回输,灌注量为100~120 mL/(kg·min),大鼠平均动脉血压维持在75~100 mmHg,整个CPB环路无气泡产生,即模型制备成功。若动物模型制备不成功,则选取同种大鼠重新进行实验。制模后转机2 h,转流期间Dex以5 μg/(kg·h)的泵注速度维持。转机2 h后停CPB。②体外循环组(C组):建立大鼠CPB模型,模型制备方法参照“①”,制模后转机2 h,转流期间给予与D组等量生理盐水。③假手术组(S组):只作动静脉血管穿刺置管,不转机,给予与D组等量生理盐水。
1.4 大鼠海马CA1区神经细胞凋亡率测算 采用TUNEL法。各组大鼠于CPB转流2 h结束后立即随机取8只,开胸,分离出心脏,剪开心尖部和右心耳,依次经升主动脉灌注100 mL生理盐水和4 ℃、4%多聚甲醛,颈椎僵硬后立即剪断头部取出脑组织,快速于冰面上分离出海马,放入4 ℃、4%多聚甲醛中固定24 h,常规脱水,石蜡包埋后,制成5 μm厚的冠状切片。参照TUNEL试剂盒步骤进行操作,取石蜡切片,依次经脱蜡复水、蛋白酶消化、染色(TUNEL、DAB、苏木素)、脱水、中性树脂封片后,光镜下观察,凋亡细胞的细胞核呈棕褐色,且可见棕黄色颗粒。每张切片随机选取海马CA1区5个视野,计数凋亡细胞数和总细胞数,神经细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.5 大鼠大脑皮质组织匀浆上清液IL-6水平检测 采用ELISA法。CPB转流2 h结束后立即处死各组余下的8只大鼠,剪断头部,取出脑组织,快速的在冰面上分离出海马和皮质,海马组织保存于-80 ℃冰箱中(用于下述实验),皮质组织用匀浆器充分匀浆,后置于离心机,以3 000 r/min速度离心30 min,吸取上清液,按照ELISA试剂盒说明书步骤检测IL-6。
1.6 大鼠海马组织pJAK2、pSTAT3蛋白检测 Western blot法。取“1.5”已制备并保存于-80 ℃冰箱中的海马组织,加入RIPA裂解液和PMSF,使蛋白在冰上充分裂解40 min,后以12 000 r/min速度离心5 min,弃沉淀留上清液。按照BCA法进行蛋白定量。分别制备12%分离胶和5%浓缩胶,取60 μg蛋白加入上样缓冲液(与蛋白比例1∶4),100 ℃变性后,点样到SDS-PAGE凝胶中进行电泳,PVDF膜先用纯甲醇浸泡后放入平衡液中,待电泳完毕后,采用半干法使蛋白转移至PVDF膜上,膜用5%脱脂奶粉室温封闭1 h,TBST漂洗,加入兔抗大鼠pJAK2单克隆抗体(1∶1 000)、兔抗大鼠pSTAT3单克隆抗体(1∶1 000)和兔抗ACTB多克隆抗体(1∶3 000),4 ℃孵育过夜。TBST漂洗去除未结合的一抗。加入羊抗兔IgG抗体(1∶10 000),室温孵育2 h。以β-actin为内参,应用Odyssey成像系统扫膜,采用Imaga J软件测定灰度值,以目的条带与内参条带的灰度值比值表示pJAK2、pSTAT3蛋白相对表达量。
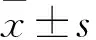
2 结果
2.1 各组大鼠海马CA1区神经细胞凋亡率比较 D、C、S组神经细胞凋亡率分别为3.93%±0.30%、14.40%±0.18%、3.11%±0.24%,D、S组分别与C组比较,P均<0.05。
2.2 各组大鼠大脑皮质组织匀浆上清液IL-6水平比较 D、C、S组IL-6水平分别为(31.04±0.70)、(47.84±1.33)、(27.99±0.80)pg/100 mg,D、S组分别与C组比较,P均<0.05。
2.3 各组大鼠海马组织pJAK2、pSTAT3蛋白相对表达量比较 海马组织pJAK2、pSTAT3蛋白相对表达量比较见表1。
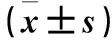
表1 各组大鼠海马组织pJAK2、pSTAT3蛋白相对表达量比较
3 讨论
CPB对全身灌注的内脏器官产生负面影响,脑损伤是CPB的常见并发症之一[9]。CPB相关脑损伤可能与炎症反应、脑灌注不足、栓塞等病理生理学机制有关,其中炎症反应神经细胞凋亡和在CPB所致脑损伤的发展过程中起重要作用,减轻细胞凋亡和抑制炎症因子释放对CPB期间脑保护有重要意义[10-11]。研究[12]表明,CPB是非生理性灌注,血液成分与非生物材料接触引发炎症反应。
大量动物实验和临床试验均证实,Dex表现出一定地脑保护作用[13-14]。已有研究报道,Dex可缓解大鼠创伤性脑损伤,其机制可能与减少神经细胞凋亡和炎症反应有关[15]。WANG等[16]通过建立大鼠脑缺血再灌注损伤模型,发现Dex使脑缺血梗死面积明显缩小,改善认知记忆功能障碍以及提高脑缺血后存活率。另外研究证实,Dex的使用可减少异丙酚诱导的发育期大鼠海马CA1区凋亡细胞数,降低活化Caspase-3表达,减轻神经毒性[17]。本研究发现,与C组比较,D组大鼠海马CA1区神经细胞凋亡率降低,大脑皮质匀浆上清液IL-6水平降低,提示Dex对大鼠CPB脑损伤有保护作用。
JAK2/STAT3通路是一条细胞内重要的信号转导通路,其可与炎症因子(如白细胞介素)间相互调节。JAK2通过磷酸化被激活,STAT3作为JAK2的下游因子在JAK2激活后发生磷酸化[18]。LI等[19]通过建立大鼠CPB循环模型,发现海马组织pJAK2、pSTAT3表达上调,使用JAK2/STAT3通路特异性拮抗剂能改善CPB大鼠术后认知功能障碍。研究证实,抑制JAK2/STAT3信号通路能减轻脑缺血再灌注损伤所致神经细胞凋亡和炎症反应[20]。本研究发现,与S组比较,C组大鼠海马组织pJAK2、pSTAT3蛋白相对表达量升高;与C组比较,D组海马组织pJAK2、pSTAT3蛋白相对表达量降低;上述结果提示,Dex可能通过抑制JAK2/STAT3信号通路的激活对CPB大鼠脑损伤发挥保护作用。
总之,CPB期间静脉泵注Dex可减轻大鼠神经细胞凋亡和脑部炎症,机制可能与其可抑制JAK2/STAT3信号通路的激活有关。
