异黄芪甲苷体外对淋巴细胞和树突状细胞免疫功能的影响
2021-01-06阮鸣,喻斌,周峰
阮 鸣,喻 斌,周 峰
异黄芪甲苷体外对淋巴细胞和树突状细胞免疫功能的影响
阮 鸣1,喻 斌2,周 峰1
1. 南京晓庄学院食品科学学院,江苏 南京 211171 2. 南京中医药大学药学院,江苏 南京 210023
研究异黄芪甲苷(6--β--葡萄糖基-环黄芪醇)对体外淋巴细胞和树突状细胞功能的影响。培养巨噬细胞,观察异黄芪甲苷对细胞吞噬中性红能力和白细胞介素-1(interleukin-1,IL-1)、IL-2、IL-6分泌功能的影响。MTT法检测异黄芪甲苷对原代培养脾淋巴细胞增殖的影响,并用流式细胞术通过检测CD3、CD19水平,明确异黄芪甲苷分别对T、B淋巴细胞增殖的影响。进一步观察异黄芪甲苷对树突细胞增殖和分泌IL-6、IL-12 p70能力的影响。异黄芪甲苷低、中、高3个剂量组可升高巨噬细胞的吞噬功能和分泌IL-6的能力,降低CD3+的比例,升高CD19+的比例,纠正T、B淋巴细胞的紊乱。中、高剂量组可显著升高IL-2水平,增加淋巴细胞的增殖,提高增殖指数(SI),促进树突状细胞(dendritic cells,DC)分泌IL-6和IL-12 p70。高剂量组还可升高巨噬细胞分泌IL-1的能力。异黄芪甲苷的免疫促进作用机制与促进非特异性免疫吞噬,促进抗原递呈、淋巴细胞增殖和树突细胞分泌能力增强有关。
异黄芪甲苷;6--β--葡萄糖基-环黄芪醇;免疫促进;淋巴细胞;树突细胞
补气药黄芪为常用中药,来源于豆科植物蒙古黄芪(Fisch.) Bunge var.(Bunge) Hsiao或膜荚黄芪(Fisch.) Bunge的干燥根。该药首载于《神农本草经》,列为上品,具有“补气升阳、益固表卫,利水消肿,托疮生肌”之功效,素有“补药之长”的美誉。现代医学研究发现黄芪具有多种药理学活性,而其对机体免疫功能的促进作用,尤其受到学者的普遍关注。已有研究表明黄芪对机体免疫的调控作用机制涉及促进抗体和免疫因子的生成[1],此外黄芪多糖和黄芪甲苷被认为是其免疫促进的主要活性成分[2]。
本课题组前期以黄芪药渣为培养基,选择灵芝为发酵菌种,进行双向固体发酵,并在发酵产物中分离得到了6--β--葡萄糖基-环黄芪醇,进一步证实该化合物是黄芪甲苷的生物转化产物[3]。6--β--葡萄糖基-环黄芪醇在结构上是黄芪甲苷脱去1分子木糖形成,为了表示2个化合物的区别和联系,将6--β--葡萄糖基-环黄芪醇命名为异黄芪甲苷(图1)。该化合物国内暂无其他报道,但国外学者在其他品种黄芪中已分离获得[4],并通过免疫学研究发现异黄芪甲苷在促进白细胞介素-2(interleukin-2,IL-2)、IL-1β和IL-8分泌方面优于黄芪甲苷[5],但至今未见该成分对其他免疫学指标影响的报道。鉴于此,为了更全面地了解异黄芪甲苷的免疫促进作用,本研究通过整体和离体实验,进一步深入研究异黄芪甲苷的作用机制。
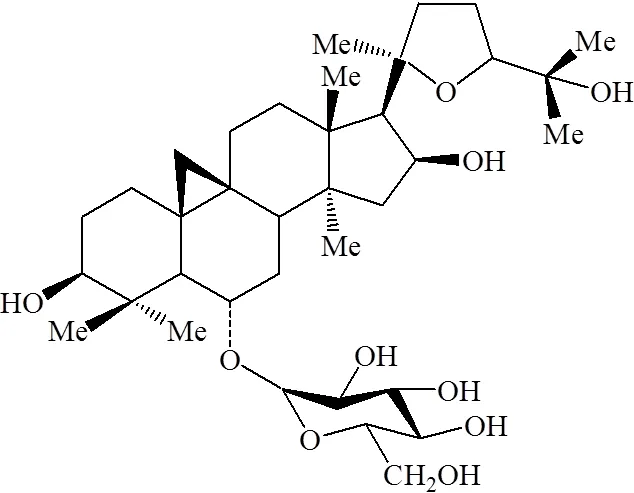
图1 异黄芪甲苷化学结构
1 材料
1.1 动物
ICR健康雄性小鼠,SPF级,体质量18~22 g,上海杰思捷实验动物有限公司,动物许可证号SCXK(沪)2013-0006。小鼠饲养在SPF级动物房中,正常饮食。本实验经南京中医药大学伦理委员会批准(编号201701A006)。
1.2 药品和试剂
异黄芪甲苷,实验室制备,质量分数>98%;环磷酰胺,江苏盛迪医药有限公司,批号15102825;无血清RPMI-1640培养液,美国Hyclone Laboratories公司,批号AB10190291;γ干扰素(interferon-γ,IFN-γ),北京晶美公司,批号171094;中性红,北京索莱宝公司,批号506C041;IL-1、IL-2、IL-6 ELISA试剂盒,欣博盛生物科技有限公司;IL-6和IL-12 p70,上海碧云天生物技术研究所;抗小鼠分化簇19-异硫氰酸荧光素(cluster of differentiation 19-fluorescein isothiocyanate,CD19- FITC)、抗小鼠分化簇3-别藻蓝蛋白(cluster of differentiation 3-allophycocyanin,CD3-APC),Biolegend公司;主要组织相容性复合体II-异硫氰酸荧光素(major histocompatibility complex II- fluorescein isothiocyanate,MHC II-FITC)试剂盒、分化簇11c-藻红素(cluster of differentiation 11c-phycoerythrin,CD11c-PE)试剂盒,Ebioscience公司。
1.3 仪器
SynergyH1型全功能微孔板检测仪(酶标仪),美国BIOTEK公司;IX71型显微镜,日本奥林巴斯公司;MCO-5AC型CO2培养箱,日本三洋公司;FC 500MPL型流式细胞仪,美国Beckman Coulter公司;Allegra 64R型冷冻离心机,美国Beckman Coulter公司。
2 方法
2.1 异黄芪甲苷对巨噬细胞免疫功能的影响
2.1.1 巨噬细胞的制备、分组及给药 取5只小鼠,ip无血清RPMI 1640培养液2 mL,15 min后颈椎脱臼处死小鼠,75%酒精浸泡15 min,收集腹腔内液,1000 r/min离心5 min收集细胞,用含10%灭活胎牛血清的RPMI 1640培养液调整细胞浓度至1×106/L。取24孔培养板每孔加细胞悬液l mL,置CO2孵箱培养2 h,倾去上清液,用无酚红RPMI 1640培养液洗去未贴壁细胞,培养孔内为巨噬细胞。实验分5组,即对照组(PBS液)、阳性对照组(1×105U/L IFN-γ)和终浓度为5、10、50 μmol/L的异黄芪甲苷组,各组分别加入1 mL含一系列浓度受试药物的无酚红RPMI 1640 10% FBS培养液。
2.1.2 中性红实验检测巨噬细胞吞噬功能 取上述培养24 h的细胞,每组设6个复孔,每孔加入中性红生理盐水,使终质量浓度为1 g/L,继续培养20 min。PBS洗细胞3次,每孔加入细胞溶解液(乙酸-无水乙醇50∶50)1 mL,室温放置2 h,待细胞溶解后,吸取上清液0.2 mL于酶标仪上540 nm处测定吸光度(),以该值表示巨噬细胞吞噬功能的强弱。
2.1.3 巨噬细胞产生IL-1、IL-2、IL-6的测定 取上述培养24 h的细胞培养上清液,每组设6个复孔,按照IL-1、IL-2、IL-6的ELISA试剂盒说明书进行指标测定。
2.2 异黄芪甲苷对脾淋巴细胞增殖的影响
取“2.1.1”项同一批5只小鼠,用75%乙醇浸泡5 min,无菌操作取脾脏,用完全RPMI 1640培养基制备2.0×106/mL的脾细胞悬液,台盼蓝染料检测细胞活力>95%以上。实验分组同“2.1.1”项,将各组100 μL脾细胞悬液分别加入96孔培养板中,再分别加入刀豆蛋白A(ConA,终质量浓度为5 μg/mL)及终浓度为5、10、50 μmol/L的异黄芪甲苷,总体积200 μL。对照组只加200 μL培养基。每组设6个复孔。加液后将培养板置于微量振荡器上振荡2 min混匀,于37 ℃含5% CO2培养箱中温育72 h,然后用MTT法于酶标仪490 nm处测。计算淋巴细胞增殖指数(SI)。
SI=异黄芪甲苷/ConA
2.3 异黄芪甲苷对淋巴细胞CD3+和CD19+比例的影响
2.3.1 分组和给药 将40只ICR小鼠按体质量随机分为对照组,模型组,异黄芪甲苷低、中、高剂量(10、20、40 mg/kg)组,每组6只。异黄芪甲苷组每日给药1次,连续ig 1周。其他组ig等体积的生理盐水,在第7天给模型组和异黄芪甲苷组小鼠ip 100 mg/kg的环磷酰胺。
2.3.2 细胞悬液制备和检测 脱颈椎处死小鼠,分离小鼠脾脏,置于盛有预冷PBS的无菌培养皿中,用研磨棒加适度力度轻轻研磨,于200目筛网滤过,收集细胞,制备单细胞悬液,以冷PBS洗涤细胞2次(1200 r/min,5 min),脾细胞以低渗法裂解红细胞,细胞计数,将细胞稀释至1×107/mL。按上述方法收集淋巴细胞悬液100 μL(1×106/mL)于流式管中,加入抗小鼠CD3、CD19单克隆抗体各0.5 μg,混匀后,4 ℃避光放置30 min。然后用PBS洗涤2次(1200 r/min,5 min),经流式细胞仪分析,检测CD3+和CD19+细胞比例。
2.4 异黄芪甲苷对小鼠树突状细胞(dendritic cells,DC)免疫功能的影响
2.4.1 DC的体外培养 取25只小鼠并采集小鼠的外周血单个核细胞5×108~5×109,加入淋巴细胞分离液,使成界面,其体积比为3∶2,1500 r/min,离心15 min,由上到下可分出4层:血清、单个核细胞、淋巴细胞分离液、红细胞。收集单个核细胞(中间云雾层)于45 mL离心管中,用生理盐水稀释,分别以1500、1000、800 r/min离心10 min,洗尽血小板后计数。以无血清RPMI 1640悬浮沉淀细胞,调整细胞密度为5×106/mL,接种于培养瓶中,置于37 ℃、5% CO2培养箱中温育2 h,轻轻吸出非贴壁细胞,贴壁细胞继续培养,用完全RPMI 1640调整细胞密度为5×106/mL后接种于6孔培养板。
2.4.2 DC的鉴定 采用流式细胞术直接免疫荧光标记法测定细胞免疫表型,在DC培养的第11天收集细胞,调整细胞密度为1×106/mL,每管取悬液100 μL,分别加入FITC标记的CD11c及PE标记的MHC II单抗各10 μL直接染色,充分混匀后置室温下暗室反应15 min。加PBS液,1000 r/min离心5 min,洗涤后以1%多聚甲醛固定进行流式细胞术检测,用CellQuest软件计算阳性细胞比率。
2.4.3 分组和给药 细胞分为5组:异黄芪甲苷低、中、高剂量(5、10、50 μmol/L)组,对照组(等体积PBS)和阳性对照组 [10 μg/mL脂多糖(LPS)],各组设6个复孔,于37 ℃、5% CO2条件下培养24 h。
2.4.4 流式细胞术检测 收集经药物处理24 h后的DC细胞,以PBS洗2遍,于4 ℃下用10%的羊血清封闭细胞表面抗体15 min,然后加入FITC标记的CD11c或MHC II单抗各10 μL直接染色,于4 ℃下温育30 min,用PBS洗2遍,然后用PBS重悬细胞置于流式细胞仪上检测。
2.4.5 DC细胞分泌功能检测 取细胞培养上清液,按照试剂盒说明书要求检测IL-6和IL-12 p70的浓度。
2.5 统计学方法
3 结果
3.1 异黄芪甲苷对巨噬细胞免疫功能的影响
由表1可见,与对照组比较,阳性对照组(IFN-γ)可见中性红值、IL-2和IL-6水平显著升高(<0.05、0.01);异黄芪甲苷低、中、高3个剂量组亦可见中性红值、IL-6水平显著升高(<0.05、0.01),中、高剂量组IL-2水平显著升高(<0.05、0.01),高剂量组IL-1水平明显升高(<0.05)。以上结果提示异黄芪甲苷的免疫促进效应与提高巨噬细胞吞噬功能,增加白介素类免疫介质的释放有关。
3.2 异黄芪甲苷对脾淋巴细胞增殖的影响
与对照组比较,ConA可显著促进淋巴细胞增殖(<0.01)。在ConA促进淋巴细胞增殖的基础上,异黄芪甲苷还可进一步促进淋巴细胞的增殖(<0.05),提高SI,其中、高剂量组可进一步增加29%。结果见表2。
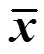
表1 异黄芪甲苷对巨噬细胞吞噬和分泌功能的影响(±s,n=6)
与对照组比较:*<0.05**<0.01
*< 0.05**< 0.01control group
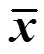
表2 异黄芪甲苷对小鼠脾淋巴细胞增殖的影响(±s,n=6)
与对照组比较:**<0.01;与ConA组比较:#<0.05
**< 0.01control group;#< 0.05ConA group
3.3 异黄芪甲苷对淋巴细胞CD3+和CD19+比例的影响
T淋巴细胞表面表达CD3,不表达CD19,而B细胞相反。由表3和图2所示,与对照组比较,模型组小鼠淋巴细胞CD3+比例显著升高,CD19+比例显著降低(<0.01),提示环磷酰胺的免疫抑制作用与抑制B淋巴细胞有关。与模型组比较,异黄芪甲苷低、中、高3个剂量组均可降低CD3+的比例,升高CD19+的比例(<0.05、0.01),使它们趋于正常,提示异黄芪甲苷具有纠正T、B淋巴细胞紊乱的作用。
3.4 异黄芪甲苷对小鼠DC免疫功能的影响
CD11c和MHC II普遍被认为是DC的表面分子标志,其高表达表明DC的增殖和成熟。由表4和图3、4可见,与对组比较,LPS处理后不仅DC表达的CD11c和MHC II显著增加,而且分泌的IL-6和IL-12 p70也显著升高(<0.05、0.01),提示LPS可明显促进DC的分化、成熟,提高其分泌功能。与对照组比较,异黄芪甲苷中、高剂量组CD11c和MHC II的表达水平差异不显著,IL-6和IL-12 p70水平显著升高(<0.05),提示异黄芪甲苷对DC的影响主要是增强其分泌功能,而不是促进其增殖和成熟。
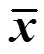
表3 异黄芪甲苷对淋巴细胞CD3+和CD19+比例的影响(±s,n=6)
与模型组比较:*<0.05**<0.01
*< 0.05**< 0.01model group
4 讨论
芝芪菌质(以黄芪药渣为培养基,灵芝为发酵菌种,双向固体发酵而成)作为本实验室的自主知识产权产品,在促进动物生长、提高机体免疫方面已证明具有显著优势。研究发现芝芪菌质作为饲料添加剂能显著促进肉鸡生长、提高肉鸡机体的免疫力,其血清禽流感H5亚型抗体的滴度和鸡新城疫抗体滴度分别比对照组升高2.5、2.4个[6]。此外,还能增加小鼠负重游泳的持续时间,提高运动后血清尿素氮水平、肝糖元含量及平均体质量,表现出较好的抗疲劳及促生长作用[7]。
1998年,异黄芪甲苷首次从分离得到[8],随后又相继在[9]、[10]、[11]、species endemic from Egypt[4]被发现,然而国内未曾从植物中分离得到。Yesilada等[5]研究报道,异黄芪甲苷和黄芪甲苷均具有显著的生物活性,如在植物血凝素(phytoheagglutinin,PHA)刺激下,它们均能显著诱导IL-2的生成,活性指数分别为80.9%和66.0%,显著高于对照组的51.1%,并且在LPS刺激下,异黄芪甲苷诱导产生IL-1β和IL-8的能力甚至强于黄芪甲苷。本实验获得的异黄芪甲苷来源于以黄芪药渣为培养基进行固体发酵获得的芝芪菌质产物。前期研究已对发酵时间进行了优化,发现发酵25 d和30 d的芝芪菌质免疫功能增强效果最为明显[12]。此外还对发酵产物的不同极性部分进行了免疫活性筛选,发现芝芪菌质水提液、水浸液和40%乙醇洗脱液对免疫功能的促进作用最为明显[13]。而本次实验不仅进一步明确了该发酵产物的免疫活性物质基础为异黄芪甲苷,还通过体内外实验证明该成分的免疫促进作用机制。研究发现异黄芪甲苷低、中、高3个剂量组可提高巨噬细胞吞噬功能和分泌IL-6的能力,降低CD3+的比例,升高CD19+的比例;中、高剂量组可显著提高IL-2含量,增加淋巴细胞的增殖,提高SI;高剂量组还可提高巨噬细胞分泌IL-1的能力。免疫低下往往与T、B淋巴细胞比例密切相关。最近有研究发现免疫抑制剂环磷酰胺和氢化可的松均可导致CD19+与CD3+的比值降低[14],这与本实验结果一致,而异黄芪甲苷3个剂量均可使它们的比值恢复,通过纠正淋巴细胞比例,展示了其较好的特异性免疫促进作用。

图2 流式细胞术检测CD3+、CD19+比例
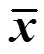
表4 异黄芪甲苷对小鼠DC增殖和分泌功能的影响(±s,n=6)
与对照组比较:*<0.05**<0.01
*< 0.05**< 0.01control group

图3 流式细胞术检测CD11c含量

图4 流式细胞术检测MHCII含量
1973年Steinman和Cohn首次发现DC,其对抗原的摄取、加工和递呈作用对于特异性免疫的形成至关重要[15]。CD11c和MHC II是DC的生物标志物,并且成熟后表达进一步增加,故常常用于检测DC的增殖和成熟状态[16]。
由于DC有许多突起结构,后者大大增加了表面积,从而允许其与周围大量细胞(如T细胞、自然杀伤细胞、中性粒细胞、上皮细胞等)密切接触。DC活性极大,一个成熟的DC可刺激100~3000个T细胞,并且即使没有明显的感染或炎症,它们也可以通过上皮细胞的紧密连接来实现对抗原的捕获[17]。而其通过Toll样受体(Toll-like receptors,TLRs)分泌的IL-6和IL-12对T细胞活化的诱导具有重要意义,也是反映其活化功能的关键指标之一[18-19]。本实验发现异黄芪甲苷虽然对DC的增殖没有显著促进作用,但中、高剂量组可显著促进DC分泌IL-6和IL-12 p70,从而促进T细胞活化,提高特异性免疫功能。
利益冲突 所有作者均声明不存在利益冲突
[1] 王玲丽, 丰华玲, 杨柯, 等. 黄芪生物学及化学成分研究进展 [J]. 基因组学与应用生物学, 2017, 36(6): 2581-2585.
[2] Fu J, Wang Z, Huang L,. Review of the botanical characteristics, phytochemistry, and pharmacology of(Huangqi) [J]., 2014, 28(9): 1275-83.
[3] 阮鸣, 张李阳, 喻斌, 等. 黄芪双向性固体发酵过程中黄芪甲苷的转化 [J]. 中药材, 2010, 33(3): 339-343.
[4] Verotta L, Guerrini M, El-Sebakhy N A,. Cycloartane and oleanane saponins from Egyptianspp. as modulators of lymphocyte proliferation [J]., 2002, 68(11): 986-994.
[5] Yesilada E, Bedir E, Calis I,. Effects of triterpene saponins fromspecies oncytokine release [J]., 2005, 96(1-2): 71-77.
[6] 许秀平, 周业飞, 储瑞华, 等. 芝芪菌质增强肉鸡免疫力和促进生长的试验报告 [J]. 中国家禽, 2007, 29(15): 57-58.
[7] 陈玉胜, 张李阳, 马桂芳, 等. 芝芪菌质水提物对小鼠抗疲劳及促生长效应 [J]. 江苏农业科学, 2008, (5): 197-199.
[8] Karimov R, Umarova R U, Saatov Z,. Cyclosiversi-genin 3--β--glucopyranoside from[J]., 1998, 34(6): 672-675.
[9] Bedir E, Calis I, Aquino R,. Cycloartane triterpeneglycosides from the roots ofand[J]., 1998, 61: 1469-1472.
[10] Bedir E, Calis I, Aquino R,. Trojanoside H: A cycloartane-type glycoside from the aerial parts of[J]., 1999, 51(8): 1071-1020.
[11] Sukhina I A, Agzamova M A, Imomnazarov B A,. Triterpene glycosides ofand their genins. LXVII. structure of cycloexoside B [J]., 2000, 36(4): 373-376.
[12] 阮鸣, 喻斌, 霍光明, 等. 不同发酵天数的芝芪菌质对免疫抑制小鼠免疫功能的影响 [J]. 食品工业科技, 2017, 38(19): 289-292.
[13] 阮鸣, 喻斌, 霍光明, 等. 芝芪菌质提取物免疫活性研究 [J]. 安徽医药, 2018, 22(10): 1869-1873.
[14] 田嘉军, 黄聘和, 岳茜岚, 等. 免疫力低下小鼠动物模型建立及快速检测研究 [J]. 中国比较医学杂志, 2020, 30(3): 77-82.
[15] Rowley D A, Fitch F W. The road to the discovery of dendritic cells, a tribute to Ralph Steinman [J]., 2012, 273(2): 95-98.
[16] 闫静静, 张晓燕. 树突细胞的特征及其生物学功能的研究进展 [J]. 微生物与感染, 2012, 7(2): 126-131.
[17] Howard C J, Charleston B, Stephens S A,. The role of dendritic cells in shaping the immune response [J]., 2004, 5(2): 191-195.
[18] Ugele I, Cárdenas-Conejo Z E, Hammon K,.-2-hydroxyglutarate and-2-hydroxyglutarate inhibit IL-12 secretion by human monocyte-derived dendritic cells [J]., 2019, 20(3): E742.
[19] 唐蓓, 李影. GEFH1在LPS诱导树突细胞IL-6和IL-12a表达中的作用 [J]. 现代免疫学, 2016, 36(1): 32-35.
Effect of iso-astragaloside VI on immunologic function of lymphocytesand dendritic cells
RUAN Ming1, YU Bin2, ZHOU Feng1
1. School of Food Science, Nanjing Xiaozhuang University, Nanjing 211171, China 2. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
To study the effect of iso-astragaloside VI (6--β--glucosyl-cycloastragenol) on the function of lymphocytesand dendritic cells.The macrophages were cultured, and the effects of iso-astragaloside VI on helping to devour neutral red and secrete IL-1, IL-2 and IL-6 were also observed. Its effects on proliferating of primary cultured spleen lymphocytes were measured, along with the measurements of CD3 and CD19 by flow cytometry to determine its effects on T and B lymphocytes proliferations. In addition, its effects on promoting the proliferation and secretion of IL-6 and IL-12 p70 in dendritic cells (DC) were also observedThe three groups (low, medium and high doses) of iso-astragaloside VI increased the abilities of macrophages on phagocytosis and secretion of IL-6, improved T and B lymphocytes ratios by decreasing CD3+and enhancing CD19+. Medium and high doses of iso-astragaloside VI elevated IL-2 level, lymphocyte proliferation and SI and promoted secretion of IL-6 and IL-12 p70 from DC. Additionally, the high dose group had the ability to increase the production of IL-1.The potential mechanisms of iso-astragaloside VI on immunoenhancement can promote nonspecific immune phagocytosis, antigen presentation, lymphocyte proliferation and DC secretion.
iso-astragaloside VI; 6--β--glucosyl-cycloastragenol; immunoenhancement; lymphocyte; dendritic cells
R285
A
0253 - 2670(2021)01 - 0196 - 07
10.7501/j.issn.0253-2670.2021.01.023
2020-03-15
国家重点研发计划项目(2019YFC1605800);国家自然科学基金项目(81973726);江苏省自然科学基金项目(BK20150088)
阮 鸣(1979—),女,博士,副教授,主要从事中药物质基础研究。Tel: (025)86178311 E-mail: 1169195814@qq.com
[责任编辑 潘明佳]
