经典名方大秦艽汤HPLC指纹图谱及含量测定方法研究
2021-01-06李海伦谢媛媛梁生旺王淑美
李海伦,李 恒,孙 飞,谢媛媛,梁生旺,王淑美*
经典名方大秦艽汤HPLC指纹图谱及含量测定方法研究
李海伦1, 2, 3,李 恒1, 2, 3,孙 飞1, 2, 3,谢媛媛1, 2, 3,梁生旺1, 2, 3,王淑美1, 2, 3*
1. 广东药科大学中药学院,广东 广州 510006 2. 广东省中药质量工程技术研究中心,广东 广州 510006 3. 国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州 510006
制备10批大秦艽汤标准煎液,建立其HPLC指纹图谱并计算指标成分含量、转移率等数据,为建立大秦艽汤的质量控制标准提供参考。依据古方要求还原至现代煎煮方式制备大秦艽汤标准煎液。采用岛津Inertsil ODS-3 C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱;体积流量为1.0 mL/min;柱温为30 ℃;检测波长为237 nm;进样量为10 μL。建立10批大秦艽汤HPLC指纹图谱,使用中药色谱指纹图谱相似度评价系统软件(2012A版)进行相似度分析,最后对共有峰进行鉴定和药材归属,并定量测定大秦艽汤中马钱苷酸、龙胆苦苷、升麻素苷的含量。建立了10批大秦艽汤的指纹图谱,相似度介于0.902~0.953,确认36个共有峰,指认出7、15、18~21、23、27、31、33、35号峰分别为马钱苷酸、龙胆苦苷、芍药苷、升麻素苷、阿魏酸、甘草苷、5--甲基维斯阿米醇苷、黄芩苷、黄芩素、甘草酸、汉黄芩素共11个成分;其中4~8、10~12、15号峰归属于秦艽,19、23号峰归属于防风,17、18号峰归属白芍,30号峰归属于独活,21、25、33号峰归属于甘草,22、27~29、35号峰归属于黄芩,1号峰归属于当归和独活,2号峰归属于秦艽、当归和细辛,3号峰归属于川芎和白芍,13号峰归属于甘草和独活,16号峰归属于秦艽和白芍,20号峰归属于川芎、当归和羌活;以马钱苷酸、龙胆苦苷、升麻素苷3项指标建立其质量控制标准,10批次样品中马钱苷酸、龙胆苦苷、升麻素苷质量分数分别为0.158~0.103、0.475~0.373、0.029~0.012 mg/g。所建立的汤剂制备方法稳定可行,质量控制方法简单、专属性强,结果准确,可用于大秦艽汤的质量评价。
大秦艽汤;经典名方;HPLC;指纹图谱;质量控制;马钱苷酸;龙胆苦苷;芍药苷;5--甲基维斯阿米醇苷;升麻素苷;阿魏酸;甘草苷;黄芩苷;黄芩素;甘草酸;汉黄芩素
经典名方是有着悠久的药用历史、确切的临床疗效及目前仍广泛应用的传统中药方剂。2018年5月,国家药品监督管理局发布《古代经典名方中药复方制剂简化注册审批管理规定》明确了经典名方复方制剂开发的研究原则,经典名方复方制剂开发必须首先进行物质基准研究,为其后的制剂开发提供依据。由此可见,建立经典名方的质量控制评价方法是其制剂开发的基础。
大秦艽汤(Daqinjiao Decoction)入选为国家中医药管理局发布的《古代经典名方目录(第一批)》的方剂,出自金朝刘完素《素问病机气宜保命集》,初刊于公元1251年[1]。书中处方原文内容为“秦艽三两,甘草二两,川芎二两,当归二两,白芍药二两,细辛半两,川羌活、防风、黄芩各一两,石膏二两,吴白芷一两,白术一两,生地黄一两,熟地黄一两,白茯苓一两,川独活二两。右十六味剉,每服一两。”确定大秦艽汤为16味中药组成的中药煮散剂[2]。查阅关于金元时期经方剂量问题研究[3]及《中药临床处方用量控制》[4]进行剂量折算,确定金代的一两为41.25 g。
该方以祛风散邪为主,兼以补血、活血、益气、清热的药物,疏养结合,邪正兼顾,共同发挥祛风清热、养血通络的功效,主治风邪初中经络证[5]而现代临床多用于治疗中风先兆、中风[6]、脑梗死[7]、脑血管出血性后遗症[8]等脑血管疾病及痛风性、风湿性关节炎[9],配合西药治疗周围性面神经麻痹[10],联合小针刀治疗肩周炎[11]。
目前,关于大秦艽汤的研究较少且多是药理作用与临床应用方面,未见其质量控制方面的报导。由于本方中药味比较多,药材的产地、批次均有差别,使煎液质量不稳定影响其临床疗效,故需要有能反映大秦艽汤化学成分的整体性、复杂性及其质量差异的质量控制方法。本研究以古籍记载的煎煮方法为依据,用3个不同产区,每个产区各5批药材,共15批药材随机组合,采用HPLC法建立大秦艽汤标准煎液指纹图谱,并建立外标法测定龙胆苦苷,马钱苷酸及升麻素苷的含量,以达到更好控制大秦艽汤标准煎液的质量。
1 仪器与材料
Waters e2695型高效液相色谱仪,美国Waters公司,配备四元泵、柱温箱、自动进样器、2998二极管阵列检测器、empower 3色谱工作站;DFY-200C高速摇摆多功能粉碎机,温岭市大德中药机械有限公司;SQP电子天平,赛多利斯科学仪器(北京)有限公司;ME104电子分析天平,梅特勒-托利多仪器(上海)有限公司;JJ500分析电子天平,常熟市双杰测试仪器厂;KQ-300DZ超声波清洗机,昆山市超声仪器有限公司;HWS26恒温水浴锅,上海一恒科学仪器有限公司;H1650-W台式高速离心机,湖南湘仪实验室仪器开发有限公司。
对照品马钱苷酸(批号111865-201704,质量分数为97.4%)、龙胆苦苷(批号110770-201716,质量分数为97.6%)、升麻素苷(批号111522- 201712,质量分数为96.2%)、芍药苷(批号110736- 201741,质量分数为95.7%)、阿魏酸(批号110773- 201614,质量分数为99.0%)、甘草苷(批号111610- 201607,质量分数为93.1%)、甘草酸铵(批号110731-201619,质量分数为96.2%)、黄芩苷(批号110715-200212,质量分数为96.2%)、黄芩素(批号111595-201607,质量分数为96.2%)、汉黄芩素(批号111514-201605,质量分数为96.2%)均购自中国食品药品检定研究院;对照品5--甲基维斯阿米醇苷(批号CHB160903,质量分数为98.0%)购自成都克洛玛生物科技有限公司。甲醇、乙腈,色谱纯,质量分数99.9%,瑞典Oceanpak公司;冰乙酸,色谱纯,质量分数99.9%,上海麦克林生化科技有限公司;磷酸,色谱纯,质量分数99.9%,上海阿拉丁生化科技股份有限公司;水为蒸馏水,屈臣氏集团有限公司;其余试剂均为分析纯。
大秦艽汤中各药材均产自3个产地,信息见表1,经广东药科大学刘基柱教授鉴定,各药材均符合《中国药典》2020年版一部相关项下的性状规定,鉴定结果依次为秦艽为龙胆科龙胆属植物秦艽Pall.的干燥根,川芎为伞形科藁本属植物川芎Hort.的干燥根茎,独活为伞形科当归属植物重齿毛当归Maxim. f.Shan et Yuan的干燥根,当归为伞形科当归属植物当归(Oliv.) Diels的干燥根,白芍为毛茛科芍药属植物芍药Pall.的干燥根,石膏为硫酸盐类矿物硬石膏族石膏,甘草为豆科甘草属植物甘草Fisch.的干燥根,羌活为伞形科羌活属植物羌活Ting ex H. T. Chang.的干燥根茎及根,防风为伞形科防风属植物防风(Turcz.) Schischk.的干燥根,白芷为伞型科当归属植物白芷(Fisch. ex Hoffm. ) Benth. et Hook. f.的干燥根,黄芩为唇形科黄芩属植物黄芩Georgi的干燥根,白术为菊科苍术属植物白术Koidz.的干燥根茎,茯苓为多孔菌科茯苓属真菌茯苓(Schw.) Wolf的干燥菌核,生地黄为玄参科地黄属植物地黄Libosch.的干燥块根,熟地黄为生地黄的炮制加工品,细辛为马兜铃科细辛属植物北细辛Fr. Schmidt var.(Maxim.) Kitag.的干燥全草。

表1 10批次大秦艽汤中药材的产地信息
2 方法
2.1 大秦艽汤的制备
将表1中3个产地,15味药材随机取样组合成S1~S10,共10个不同批次的大秦艽汤方剂。取秦艽10.54 g,甘草7.02 g,川芎7.02 g,当归7.02 g,白芍药7.02 g,细辛1.76 g,羌活、防风、黄芩各3.51 g,石膏7.02 g,白芷3.51 g,白术3.51 g,生地黄3.51 g,熟地黄3.51 g,茯苓3.51 g,独活7.02 g。制得二号筛(24目)粗粉末样品,加水1000 mL,浸泡10 min,包煎,先武火,沸腾后转文火煎煮至药液体积80%,挤渣,60 ℃条件下恒温减压干燥,研细,即得干粉样品。
2.2 指纹图谱研究
2.2.1 色谱条件 色谱柱为岛津Inertsil ODS-3 C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~5 min,9%~10%乙腈;5~10 min,10%~11%乙腈;10~22 min,11%~15%乙腈;22~30 min,15%~17%乙腈;30~34 min,17%~20%乙腈;34~42 min,20%~27%乙腈;42~53 min,27%乙腈;53~60 min,27%~32%乙腈;60~90 min,32%~74%乙腈;检测波长为237 nm;体积流量为1.0 mL/min;柱温为30 ℃;进样量10 μL。
2.2.2 供试品溶液制备 精密称取0.4 g样品干粉,置于具塞锥形瓶中,加甲醇10 mL,称定质量,超声(500 W,40 kHz)处理30 min,放至室温,补足减失的质量,5000 r/min离心(离心半径62 mm)离心10 min,取上清液,过0.45 μm滤膜,即得供试品溶液。
2.2.3 对照品溶液制备 精密称取马钱苷酸、龙胆苦苷、芍药苷、升麻素苷、阿魏酸、甘草苷、5--甲基维斯阿米醇苷、黄芩苷、黄芩素、甘草酸铵、汉黄芩素对照品适量,置于10 mL量瓶中,加甲醇制成分别含1.022、1.010、1.079、1.020、1.067、1.016、1.028、1.030、1.038、1.024、1.040 mg/mL的对照品溶液。
2.2.4 精密度试验 按“2.2.2”项下方法制备供试品溶液(S1)1份,按“2.2.1”项下色谱条件测定,分别连续平行进针6次,记录色谱图。除去溶剂峰的影响,以龙胆苦苷色谱峰为参照(S),计算各共有峰相对保留时间及相对峰面积,结果显示,各共有峰的相对保留时间和相对峰面积RSD分别为0~0.20%和0~2.94%,均<5%,结果说明仪器精密度良好,符合要求。
2.2.5 稳定性试验 按“2.2.2”项下方法制备供试品溶液(S1)1份,按“2.2.1”项下色谱条件,分别在0、2、4、6、8、12、24 h时测定,记录色谱图。除去溶剂峰的影响,以龙胆苦苷色谱峰为参照,计算各共有峰相对保留时间及相对峰面积。结果显示,各共有峰的相对保留时间和相对峰面积RSD分别为0~0.42%和0~2.74%,均<3%,说明供试品溶液在24 h内稳定性良好,符合要求。
2.2.6 重复性试验 取同一批样品S1干粉,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.2.1”项下色谱条件,分别测定,记录色谱图。除去溶剂峰的影响,以龙胆苦苷色谱峰为参照,计算各共有峰相对保留时间及相对峰面积。结果显示,各共有峰的相对保留时间和相对峰面积RSD分别为0~1.99%和0~2.75%,均<3%,说明该方法重复性良好,符合要求。
2.2.7 指纹图谱的建立 根据中药经典名方复方制剂开发的要求,使用3个不同产地药材,每个产地5批,共15个不同批次的药材进行随机组合成10剂药方,按“2.2.2”项下方法分别制备10批大秦艽汤(干粉)样品S1~S10,再按“2.2.1”项下色谱条件分别测定,记录HPLC图,见图1。

图1 10批大秦艽汤样品HPLC指纹图谱及对照指纹图谱(R)
利用中药指纹图谱相似度系统评价软件(2012A)对“2.2.7”项下制得大秦艽汤样品S1~S10的HPLC色谱图进行分析。以S1样品图谱为参照图谱,时间窗为0.1 min,采用平均数法、经多点校正进行峰匹配,生成对照指纹图谱(R),结果见图1,进行相似度计算,结果见表2。
2.2.8 主要色谱峰的鉴定 分别取“2.2.3”项下各对照品储备液适量,加甲醇分别稀释成一定质量浓度的对照品稀释液,在相同的色谱条件下进样,将生成的色谱峰与大秦艽汤S1样品指纹图谱相应峰进行对比。如图2所示。结果发现7、15、18~21、23、27、31、33、35号色谱峰分别与各对照品峰相对应,其紫外光谱也分别相吻合。因此,大秦艽汤样品指纹图谱中7、15、18~21、23、27、31、33、35号峰分别鉴定为马钱苷酸、龙胆苦苷、芍药苷、升麻素苷、阿魏酸、甘草苷、5--甲基维斯阿米醇苷、黄芩苷、黄芩素、甘草酸铵、汉黄芩素。
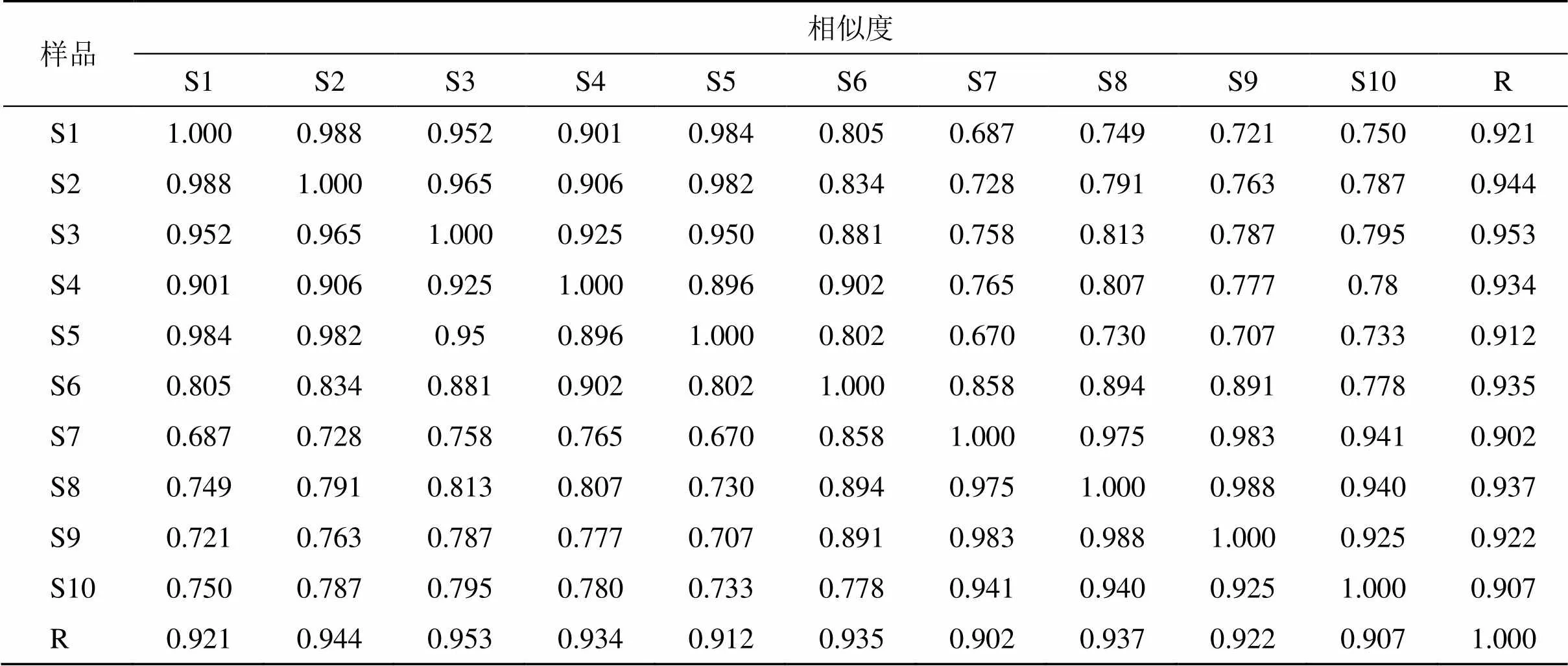
表2 10批大秦艽汤样品相似度比较
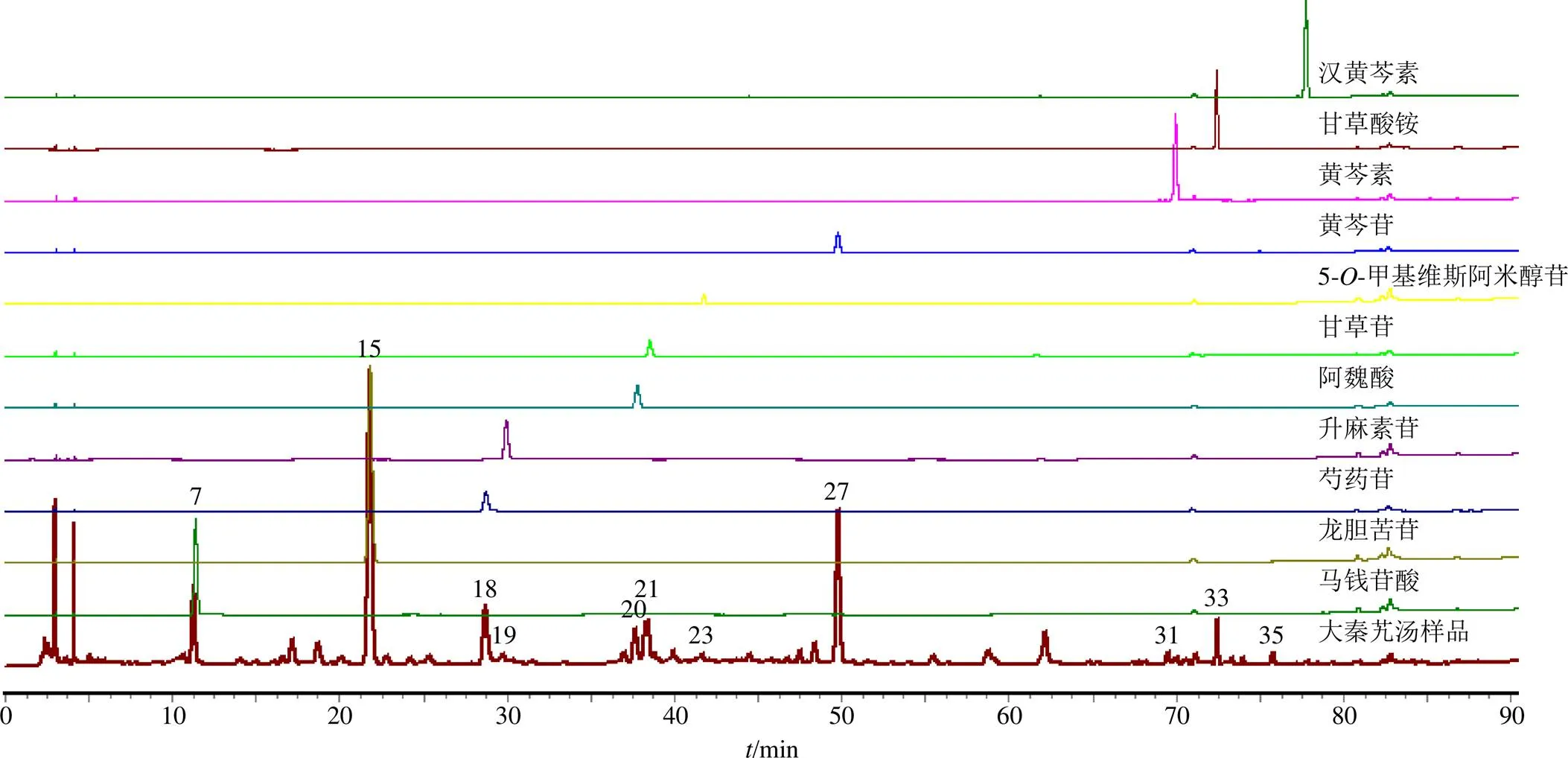
7-马钱苷酸 15-龙胆苦苷 18-芍药苷 19-升麻素苷 20-阿魏酸 21-甘草苷 23-5-O-甲基维斯阿米醇苷 27-黄芩苷 31-黄芩素 33-甘草酸铵 35-汉黄芩素
2.2.9 主要色谱峰的归属 分别制备秦艽、甘草、川芎、当归、白芍、石膏、独活、羌活、防风、黄芩、白芷、白术、生地黄、熟地黄、茯苓、细辛各单味药样品,缺秦艽、缺甘草、缺川芎、缺当归、缺白芍、缺石膏、缺独活、缺羌活、缺防风、缺黄芩、缺白芷、缺白术、缺生地黄、缺熟地黄、缺茯苓、缺细辛的阴性样品,分别制备各单味药样品溶液和各阴性样品溶液,在相同的色谱条件下进样,并与大秦艽汤S1样品指纹图谱进行对比分析。如图3、4,以各峰保留时间、紫外光谱图为鉴定标准,进行色谱峰的指认。结果发现,4~8、10~12、15号色谱峰为秦艽的特征峰,19、23号色谱峰为防风的特征峰,17、18号色谱峰为白芍的特征峰,30号色谱峰为独活的特征峰,21、25、33号色谱峰为甘草的特征峰,22、27~29、35号色谱峰为黄芩的特征峰,1号色谱峰为当归和独活所共有,2号色谱峰为秦艽、当归和细辛所共有,3号色谱峰为川芎和白芍所共有,13号色谱峰为甘草和独活所共有,16号峰为秦艽和白芍所共有,20号峰为川芎、当归和羌活所共有。
2.3 大秦艽汤标准煎液中指标成分马钱苷酸、龙胆苦苷和升麻素苷的转移率及含量测定
2.3.1 色谱条件 色谱柱为岛津Inertsil ODS-3 C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱程序见表3;检测波长为237 nm;体积流量为1.0 mL/min;柱温为30 ℃;进样量10 μL。
2.3.2 对照品溶液的制备 取马钱苷酸、龙胆苦苷、升麻素苷适量,精密称定,加甲醇分别制成含马钱苷酸1.026 mg/mL、龙胆苦苷2.489 mg/mL和升麻素苷1.050 mg/mL的对照品储备液。分别精密吸取马钱苷酸、龙胆苦苷、升麻素苷各储备液2.0、4.0、0.2 mL,加甲醇定容至10 mL量瓶,制得混合对照品稀释液,摇匀,备用。
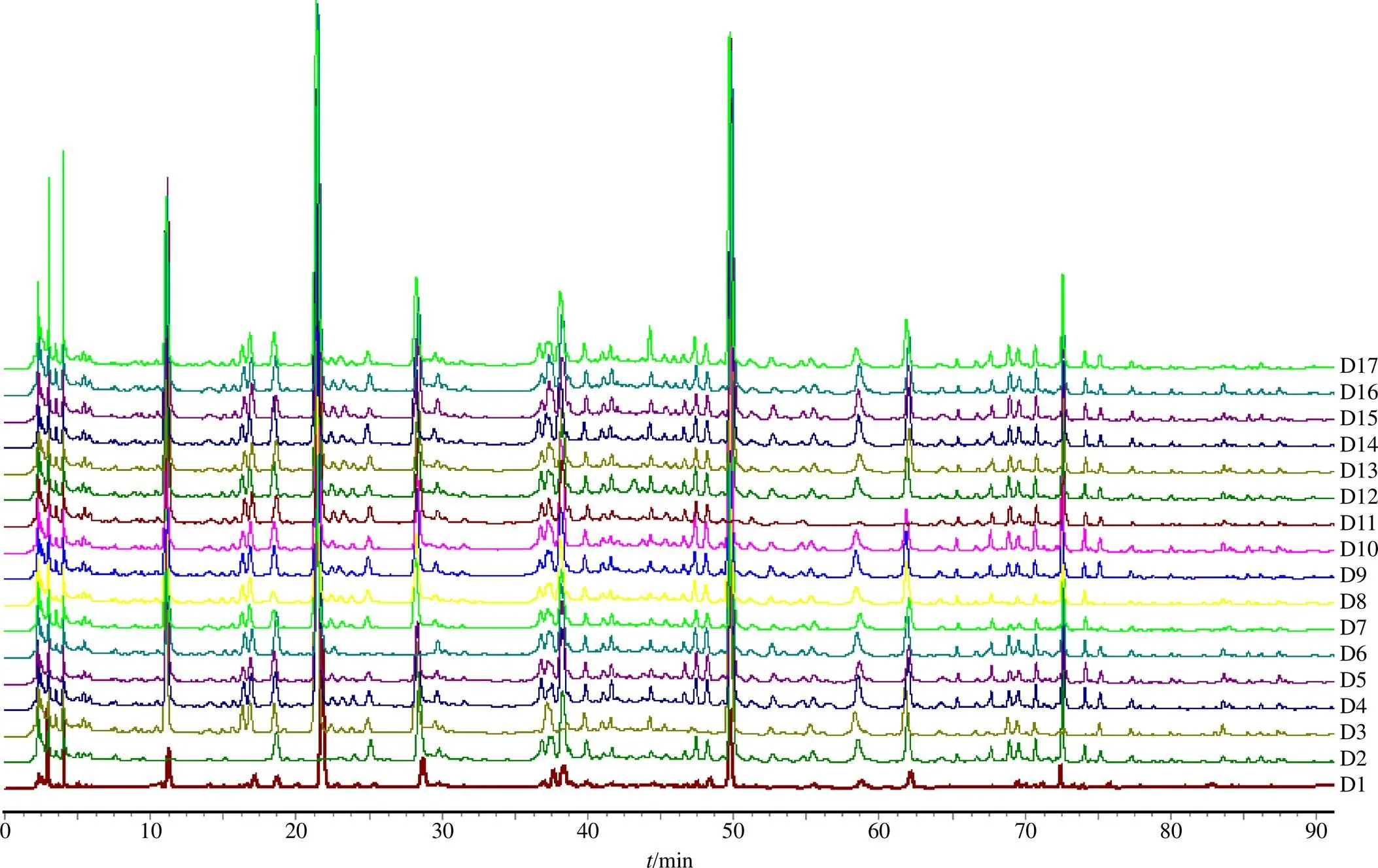
D1-大秦艽汤样品 D2-缺秦艽阴性样品 D3-缺甘草阴性样品 D4-缺川芎阴性样品 D5-缺当归阴性样品 D6-缺白芍阴性样品 D7-缺石膏阴性样品 D8-缺独活阴性样品 D9-缺羌活阴性样品 D10-缺防风阴性样品 D11-缺黄芩阴性样品 D12-缺白芷阴性样品 D13-缺白术阴性样品 D14-缺生地黄阴性样品 D15-缺熟地黄阴性样品 D16-缺茯苓阴性样品 D17-缺细辛阴性样品

A1-大秦艽汤样品 A2-秦艽单味样品 A3-甘草单味样品 A4-川芎单味样品 A5-当归单味样品 A6-白芍单味样品 A7-石膏单味样品 A8-独活单味样品 A9-羌活单味样品 A10-防风单味样品 A11-黄芩单味样品 A12-白芷单味样品 A13-白术单味样品 A14-生地黄单味样品 A15-熟地黄单味样品 A16-茯苓单味样品 A17-细辛单味样品
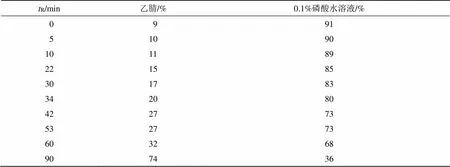
表3 流动相梯度
2.3.3 供试品溶液制备 精密称取0.4 g样品干粉,置于具塞锥形瓶中,加甲醇10 mL,称定质量,超声(500 W、40 kHz)处理30 min,放至室温,补足减失的质量,5000 r/min离心(离心半径为62 mm)10 min,取上清液,过0.45 μm滤膜,即得供试品溶液。
2.3.4 线性关系考察 分别精密吸取“2.3.2”项下混合对照品稀释液各0.1、0.2、0.4、0.6、0.8、1.0 mL置于1 mL量瓶中,加甲醇稀释至刻度,摇匀,得稀释10、5、2.5、1.67、1.25、1倍系列对照品溶液,按“2.3.1”项下色谱条件进样测定,得峰面积积分值,以质量浓度为横坐标(),对照品峰面积积分值为纵坐标(),并绘制标准曲线,建立回归方程,结果分别为马钱苷酸=6 860.7-24 681,²=0.999 8,线性范围20.52~205.2 μg/mL;龙胆苦苷=11 759-199 787,²=0.999 4,线性范围99.56~995.6 μg/mL;升麻素苷=20 760- 9 227.4,²=0.999 5,线性范围2.10~21.00 μg/mL。
2.3.5 精密度试验 按“2.3.3”项下方法制备供试品溶液1份,按“2.3.1”项下色谱条件进样测定,连续进样6次,测定马钱苷酸、龙胆苦苷和升麻素苷的峰面积,计算峰面积RSD。结果显示,马钱苷酸、龙胆苦苷和升麻素苷的峰面积RSD分别为0.25%、0.24%、0.96%,表明仪器精密度良好,符合要求。
2.3.6 稳定性试验 按“2.3.3”项下方法制备供试品溶液1份,按“2.3.1”项下色谱条件,分别于0、2、4、6、8、12、24 h进样测定,测定马钱苷酸、龙胆苦苷和升麻素苷的峰面积,计算峰面积RSD。结果显示,马钱苷酸、龙胆苦苷和升麻素苷的峰面积RSD分别为0.58%、0.39%、0.55%,表明供试品溶液在24 h内稳定性良好。
2.3.7 重复性试验 精密称取同一批大秦艽汤S1干粉6份,按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,测定马钱苷酸、龙胆苦苷和升麻素苷的峰面积,分别计算3种成分的质量分数和RSD。结果显示,马钱苷酸、龙胆苦苷和升麻素苷的质量分数RSD分别为1.82%、1.22%、2.80%,表明此方法的重复性良好。
2.3.8 加样回收率试验 精密称取同一批大秦艽汤S1干粉6份,每份约0.2 g,精密称定,分别精密加入对照品马钱苷酸、龙胆苦苷和升麻素苷相当于样品中各成分含量的100%,按“2.3.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,计算回收率,结果显示,马钱苷酸、龙胆苦苷和升麻素苷的平均加样回收率分别为99.97%、97.43%、91.27%,RSD分别为2.75%、0.69%、1.97%,表明此方法的准确度良好。
2.3.9 出膏率 测定10批大秦艽汤的出膏率,即大秦艽汤干粉质量(2)与药材总质量(1)的比值。
出膏率=2/1
2.3.10 指标成分的含量分数及转移率测定 对10批大秦艽汤干粉按“2.3.1”项含量测定所建立的质量评价方法进行指标成分含量测定,并计算指标成分转移率,结果见表4。
转移率=汤剂中含量/药材中含量

表4 10批大秦艽汤出膏率及含量测定结果
3 讨论
3.1 大秦艽汤标准煎液的制备工艺探讨
大秦艽汤标准煎液的制备工艺需要以古籍记载的煎煮方法为依据,参考《中药精准煮散饮片》[12]考察了饮片粉碎粒度(0.7、5 mm粒度)、浸泡时间(5、10、15、20 min)以及加水量(800、1000、1200 mL)[13]。结果显示,5 mm粒度粗末样品的出膏率、指标成分的转移率均低于二号筛(24目)粗末样品,浸泡10 min饮片基本处于吸水饱和状态,指标成分转移率及出膏率在加水量至1000 mL时达到最大值。故最终确定大秦艽汤标准煎液的制备工艺为饮片制得二号筛(24目)粗末样品,加水1000 mL,浸泡10 min,包煎,先武火,沸腾后转文火煎煮至药液体积80%,挤渣即得[14]。
3.2 指标成分确定
本方共有16味中药组成,根据中药复方君、臣、佐、使的配伍原则,优先选择方中君药(秦艽)及臣药(羌活、独活、防风)的指标成分作为质量控制的指标[15]。马钱苷酸和龙胆苦苷属于环烯醚萜苷类成分,环烯醚萜苷类成分是秦艽的主要活性成分及质量评价指标[16],具有抗炎[17]、镇痛作用;升麻素苷和5--甲基维斯阿米醇苷属于色原酮类成分,色原酮类成分是防风的主要活性成分及质量评价指标[18],具有镇痛、镇静、抗炎药理作用。同时结合大秦艽汤现代临床功效针对脑血管疾病及痛风性、风湿性关节炎、面神经麻痹方面。选择方中君药秦艽环烯醚萜苷类成分龙胆苦苷、马钱苷酸和臣药防风色原酮类成分升麻素苷成分作为评价指标。
3.3 指纹图谱相似度
本研究建立10批大秦艽汤的指纹图谱,进行共有峰标定和相似度评价[19]。结果10批样品共有峰有36个,相对保留时间RSD为0.05%~0.35%,相对峰面积RSD为4.69%~59.69%,相似度为0.902~0.953,说明10批大秦艽汤之间存在较多共有成分,但共有成分含量差异较大,可能原因与各药味确定了相同的基原但来源于3个不同产地共15个批次药材,共有成分相似但各批号产地间含量存在差异,最终导致相对峰面积RSD差异较大有关。
根据中药经典名方新药开发政策的相关要求,进行大秦艽汤质量控制研究[20],据古方要求还原至现代煎煮方式,制备了10批大秦艽汤标准煎液,建立其HPLC指纹图谱并计算指标成分含量和转移率,为后续建立经典名方大秦艽汤的质量控制标准提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 边文静. 《素问病机气宜保命集》作者与学术思想研究 [D].石家庄: 河北医科大学, 2011.
[2] 傅延龄, 宋佳, 张林. 宋政府推广普及煮散剂的原因 [J]. 中国中医基础医学杂志, 2015, 21(1): 88-90.
[3] 宋延强. 金元四大家对经方50味常用药物的临床用量研究 [D].北京:北京中医药大学, 2011.
[4] 傅延龄, 王倩, 王振宇. 论中药临床处方用量控制 [J]. 中医杂志, 2015, 56(16): 1351-1354.
[5] 鲁赛, 杨桢, 胡红林, 等. 从“中风”探讨大秦艽汤证治内涵 [J]. 中国中医基础医学杂志, 2015, 21(2): 143-144.
[6] 洪霞. 大秦艽汤加减治疗急性缺血性中风的临床研究 [D].北京: 中国中医科学院, 2012.
[7] 李华兴, 刘爱武, 丘伟贤, 等. 阿替普酶与大秦艽汤治疗急性脑梗死疗效研究 [J]. 北方药学, 2019, 16(10): 86-87.
[8] 陈琳, 徐守宇. 大秦艽汤联合早期综合康复治疗脑卒中后上肢痉挛性瘫痪临床观察 [J]. 新中医, 2018, 50(7): 68-71.
[9] 李昌勤, 张倩, 康文艺. 大秦艽汤临床应用概述 [J]. 中成药, 2010, 32(6): 1029-1032.
[10] 郭冬丽, 周哲屹, 徐宏, 等. 大秦艽汤联合西药治疗周围性面神经麻痹 [J]. 吉林中医药, 2019, 39(8): 1044-1047.
[11] 张志刚. 分析小针刀联合大秦艽汤加减治疗肩周炎患者的临床疗效 [J]. 名医, 2018(11): 226.
[12] 陈士林, 黄志海, 丘小惠, 等. 中药精准煮散饮片 [J]. 世界科学技术—中医药现代化, 2016, 18(9): 1430-1440.
[13] 杨蓉, 郑虎占. 中药煎煮法的现代研究概况 [J]. 中国医药科学, 2012, 2(17): 44-46.
[14] 邢丹, 贺莹, 郑虎占. 从《太平惠民和剂局方》论中药煮散技术规范 [J] . 中国临床医生, 2012, 40(11): 73-75.
[15] 唐慧青, 滕晶, 刘丽丽, 齐向华. 论大秦艽汤的病机新探 [J]. 四川中医, 2015, 33(2): 47-48.
[16] 聂安政, 林志健, 王雨, 等. 秦艽化学成分及药理作用研究进展 [J]. 中草药, 2017, 48(3): 597-608.
[17] 赵勤, 胡锐, 葛明娟, 等. 大秦艽汤抗炎作用研究 [J]. 中药药理与临床, 2012, 28(3): 21-22.
[18] 刘双利, 姜程曦, 赵岩, 等. 防风化学成分及其药理作用研究进展 [J]. 中草药, 2017, 48(10): 2146-2152.
[19] 关洪月, 李林, 刘晓, 等.中药指纹图谱相似度计算方法探析 [J]. 中国实验方剂学杂志, 2011, 17 (18): 282-287.
[20] 李艳, 白明, 宋亚刚, 等.中药标准汤剂的研究与思考 [J]. 中草药, 2018, 49(17): 3977-3980.
HPLC fingerprint and content determination method of classical prescriptions Daqinjiao Decoction
LI Hai-lun1, 2, 3,LI Heng1, 2, 3,SUN Fei1, 2, 3,XIE Yuan-yuan1, 2, 3,LIANG Sheng-wang1, 2, 3,WANG Shu-mei1, 2, 3
1. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. Research Center for Traditional Chinese Medicine Quality Engineering Technology in Guangdong Universities, Guangzhou 510006, China 3. State Administration of Traditional Chinese Medicine Key Laboratory of Traditional Chinese Medicine Digitalization Quality Evaluation, Guangzhou 510006, China
To establish fingerprints and calculate index component content, transfer rate and other data of 10 batches of Daqinjiao Decoction (DD) by HPLC, in order to provide reference for establishing the quality control standard of DD.According to the requirements of the ancient recipe, the standard decoction of DD was prepared by the modern decoction method. Using Shimadzu inertsil ODS-3 C18column (250 mm × 4.6 mm, 5 μm) for gradient elution with acetonitrile-0.1% phosphoric acid aqueous solution; Flow rate 1.0 mL/min, column temperature 30 ℃, and detection wavelength 237 nm; The injection volume is 10 μL.The HPLC fingerprint of 10 batches of DD were established and evaluated by the similarity evaluation system of the Chinese medicine chromatographic fingerprint similarity evaluation system software (version 2012A), identify and assign the common peaks, and quantitatively determine the content of loganic acid, gentiopicroside, and prim--glucosylcimifugin in DD.HPLC fingerprint of 10 batches of DD were established. The similarity was ranged from 0.902 to 0.953 and 36 commonpeaks were identified as 11 chemical components: loganic acid, gentiopicroside, paeoniflorin, prim--glucosylcimifugin, ferulic acid, liquiritin, 4--beta-glucopyranosyl-5--methylvisamminol, baicalin, baicalein, glycyrrhizic acid, and wogonin (corresponding to peaks 7, 15, 18, 19, 20, 21, 23, 27, 31, 33, and 35), peaks 4—8, 10—12, and 15 belonged to(GMR), peaks 19 and 23 belonged to(SR), peaks 17 and 18 belonged to(PRA), peak 30 belonged to(APR), peaks 21, 25, and 33 belonged toet(GRR), peaks 22, 27—29, and 35 belonged to, peak 1 belonged to(ASR) and APR, peak 2 belonged to GMR, ASR andet(ARR), peak 3 belonged to(CR) and PRA, peak 13 belonged to GRR and APR, peak 16 belonged to GMR and PRA, peak 20 belonged to CR, ASR andet(NRR). Among them, three indicators of loganic acid, gentiopicroside and prim--glucosylcimifugin were used to establish theirs quality control standards, the results of content determination respectively were 0.158—0.103, 0.475—0.373, and 0.029—0.012 mg/g.The preparation method of established decoction is stable and feasible, and the quality control method is simple, specific and accurate. It can be used for the quality evaluation of DD.
Daqinjiao Decoction; classical prescriptions; HPLC; fingerprint; quality control; loganic acid; gentiopterin; paeoniflorin; 4--beta-glucopyranosyl-5--methylvisamminol; prim--glucosylcimifugin; ferulic acid; liquiritin; baicalin; baicalein; glycyrrhizic acid; wogonin
R286.02
A
0253 - 2670(2021)01 - 0099 - 09
10.7501/j.issn.0253-2670.2021.01.013
2020-08-14
国家自然科学基金面上项目(81773884);神威药业经典名方《大秦艽汤》基准物质研究(2017HSW-KF121);十三五重大新药创制(2017ZX09301077)
李海伦,硕士,研究方向为中药质量分析与评价。Tel: 17818528462 E-mail: 1060020768@qq.com
王淑美,博士,教授,研究方向为中药质量控制。Tel: (020)39352173 E-mail: 2395903468@qq.com
[责任编辑 郑礼胜]
