麻杏石甘汤对流感病毒感染小鼠肠道菌群及趋化因子CCL5、CXCL10的影响
2021-01-06卢芳国张香港陈纯静田维毅
王 平,赵 澄,卢芳国*,吴 涛,张香港,陈纯静,肖 荣,宁 毅,魏 科,李 玲,蔡 琨,田维毅
麻杏石甘汤对流感病毒感染小鼠肠道菌群及趋化因子CCL5、CXCL10的影响
王 平1, 2,赵 澄1,卢芳国1*,吴 涛1,张香港1,陈纯静1,肖 荣1,宁 毅1,魏 科1,李 玲1,蔡 琨2,田维毅2
1. 湖南中医药大学,湖南 长沙 410208 2. 贵州中医药大学,贵州 贵阳 550025
探索麻杏石甘汤(Maxing Shigan Decoction)通过影响小鼠肠道菌群组成及趋化因子产生而防治流感病毒感染的潜在机制。通过鼻腔接种法建立A型流感病毒感染小鼠模型,经ig给药3 d和7 d后,观察小鼠体质量等一般情况;HE染色检测结肠组织病理变化;免疫组化检测结肠组织趋化因子CCL5、CXCL10的表达;酶联免疫法检测结肠组织中CCL5、CXCL10含量,并取小鼠肠内容物进行16S rRNA基因V3~V4可变区测序、物种注释及聚类,进行Alpha多样性和Beta多样性分析,线性判别式分析 [linear discriminant analysis(LDA)effect size,LEfSe] 筛选组间差异物种,冗余分析及Spearman等级相关系数分析肠道菌群与CCL5、CXCL10的关联性。给药3 d后,模型组小鼠体质量下降(<0.01),肠黏膜固有层中炎性细胞明显浸润且高表达CCL5和CXCL10(<0.01),结肠组织匀浆中CCL5和CXCL10含量增加(<0.01);与模型组比较,各药物组小鼠体质量明显增加,炎性细胞浸润减少,CCL5、CXCL10阳性表达细胞减少,肠组织匀浆中CCL5、CXCL10含量降低,以奥司他韦组和麻杏石甘汤组差异显著(<0.05、0.01)。菌群多样性分析和物种差异分析结果显示,给药3 d后,模型组小鼠肠道菌群组成与对照组及各药物组存在明显差异。模型组小鼠变形菌门、埃希菌属相对丰度较对照组明显增加(<0.05),厚壁菌门、乳杆菌属、粪球菌属相对丰度明显降低(<0.05、0.01);与模型组比较,各药物组变形菌门、埃希菌属相对丰度降低(<0.05),奥司他韦组和麻杏石甘汤组厚壁菌门相对丰度显著增加(<0.01),抗病毒颗粒组颤螺旋菌属相对丰度增加(<0.05),麻杏石甘汤组乳杆菌属、粪球菌属相对丰度增加(<0.05、0.01)。给药7 d后,模型组小鼠结肠组织病变减轻,趋化因子表达下降,变形菌门、埃希菌属相对丰度较给药3 d后明显降低(<0.01);与模型组比较,各药物组疣微菌门相对丰度明显降低(<0.05、0.01),拟杆菌门相对丰度明显升高(<0.05)。关联性分析显示,小鼠结肠组织中CCL5、CXCL10含量与埃希菌属、克雷伯菌属、梭菌属、粪球菌属等相对丰度显著相关(<0.05、0.01)。A型流感病毒感染可引起小鼠肠道菌群结构紊乱及免疫功能失衡,麻杏石甘汤通过调节肠道菌群结构并影响趋化因子的产生,对流感病毒引起的肠道免疫损伤有一定的保护作用。
A型流感病毒;麻杏石甘汤;肠道菌群;趋化因子;CCL5;CXCL10
流行性感冒(以下简称流感)是由流感病毒(influenza virus)引起的一种急性呼吸道传染病。A型流感病毒(influenza A virus,IAV)是引起人和动物感染的主要病原体。流感临床表现多样,常见的症状包括发热、咳嗽、头痛、乏力,并常伴有恶心、呕吐、腹泻、腹痛等消化道症状。有研究报道,流感患者胃肠道症状发生率为30.9%[1]。流感病毒感染致肠道菌群失调及黏膜局部免疫功能紊乱可能是流感容易出现消化道症状的重要原因[2]。
肠道菌群从生命早期开始逐步有序地定植在消化道内,形成稳定的肠道微生态系统。肠道菌群及其代谢产物与宿主的能量代谢、免疫稳态以及健康状况密切相关。越来越多的证据表明,肠道菌群种类和比例改变对流感病毒感染的结局可能产生积极影响或负面作用,这与肠道菌群及其代谢产物对宿主免疫功能的影响密不可分[3]。研究发现,流感病毒感染后,肠道菌群结构组成发生改变,并且肠上皮细胞可以释放过量的趋化因子和促炎细胞因子,肠道菌群与黏膜局部炎症因子之间相互作用,进而影响流感的进程[2,4]。Wang等[2]研究发现,流感病毒感染可促进肺源性CCR9+CD4+T细胞进入肠道,分泌γ干扰素(interferon-γ,IFN-γ)干扰肠道微生物群稳态,引起肠道菌群失调,而紊乱的肠道菌群又可促进小肠上皮细胞分泌白细胞介素-15(interleukin-15,IL-15),诱导Th17细胞极化,促进IL-17等细胞因子的产生,进而加重肠组织损伤。Li等[4]研究发现,流感病毒感染可促进肠道中变形菌门肠杆菌科细菌生长,破坏黏膜屏障功能,诱导肠上皮细胞过度表达IL-22、IFN-α、IL-17A等促炎细胞因子,引起炎症反应和肠组织损伤。趋化因子CCL5(CC chemokine ligand 5)和CXCL10(C-X-C motif chemokine ligand 10)是引起流感免疫病理损伤的重要炎症因子,能强烈趋化炎症细胞向病灶部位聚集,与流感病毒感染引起的炎症损伤程度呈正相关[5-6]。研究发现大肠埃希菌或肺炎克雷伯菌等可以促进CCL5及CXCL10等趋化因子的表达,从而加重炎性损伤程度[7-8]。因此,修复肠道微生态失衡,改善黏膜局部微环境对于防治流感有重要意义。源自汉代张仲景《伤寒论》的麻杏石甘汤(Maxing Shigan Decoction,MXSGD)是常用的防治流感的中药经方。本课题组前期研究发现,该方具有干预病毒吸附、抑制病毒增殖、抑制趋化因子及炎症介质释放等作用[9-11]。本研究以流感病毒感染BALB/c小鼠为模型,探讨流感病毒对小鼠肠道菌群及肠黏膜局部趋化因子的影响,及MXSGD的干预作用,以期为肠道菌群作为流感防控新策略中的重要靶点提供依据,并进一步揭示MXSGD防治流感的可能机制,为拓展其临床应用提供理论支持和实验数据。
1 材料
1.1 动物
6~8周BALB/c雄性小鼠60只,体质量(18±2)g,购于湖南斯莱克景达实验动物有限公司 [许可证号SCXK(湘)2016-0002,动物批号43004700062561],于湖南中医药大学实验动物中心[许可证号SCXK(湘)2015-0003] 饲养。饲养条件:温度(23±1)℃,湿度(65±5)%。所有实验符合湖南中医药大学动物实验伦理学规定。
1.2 病毒株
流感病毒小鼠肺适应株(A型,IAV,A/PR/8/34),由湖南师范大学病毒研究室惠赠。10日龄鸡胚尿囊腔接种培养传代,血凝效价1∶640以上者用于实验。正式实验前根据文献方法[12],测定小鼠病毒半数致死量(LD50)为1×10−3.77,每0.1 毫升病毒液用灭菌生理盐水稀释成50 LD50,置于冰袋中备用。
1.3 药物与试剂
MXSGD(麻黄9 g、杏仁9 g、石膏18 g、炙甘草6 g):麻黄(批号1901029)、杏仁(批号2019032702)、石膏(碎,棉裹,批号1905250032)、炙甘草(批号1806004),购自湖南中医药大学附属第一医院门诊药房,经湖南中医药大学第一附属医院药学部戴冰教授鉴定为正品,符合《中国药典》2020年版的要求;磷酸奥司他韦胶囊(规格75 mg/粒,批号M1050,意大利Roche S.p.A. 公司生产,上海罗氏制药有限公司分装)购自中南大学湘雅二附院门诊药房,用蒸馏水充分溶解,制成质量浓度为2.165 mg/mL的混悬液;抗病毒颗粒(规格9 g/袋,批号1906311,四川光大制药有限公司)购自湖南中医药大学附属第一医院门诊药房,用蒸馏水充分溶解,制成质量浓度为0.39 g/mL的溶液。以上实验用药4 ℃避光保存备用。兔抗小鼠RANTES抗体(批号ab189841)、CXCL10多克隆抗体(批号ab9938);驴抗兔IgG荧光二抗(批号ab175772)均购于Abcam公司;通用二步法试剂盒(批号PV-9000,北京中杉金桥生物技术有限公司);小鼠CXCL10/IP-10 ELISA试剂盒(批号F10933,上海西唐生物科技有限公司)、CCL5/ Rantes ELISA试剂盒(批号F11450,上海西唐生物科技有限公司)。
1.4 主要仪器
BSC-1300 IIA2生物安全柜(苏州安泰空气技术有限公司);SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);Axioscope 5光学扫描显微镜+Axiocam 503 color 显微镜摄像头 [蔡司科技(苏州)有限公司];BBY24M高通量组织细胞破碎仪(美国Next Advance公司);Spark多功能酶标仪(瑞士Tecan公司);TP-200D电子分析天平(湘仪天平仪器设备有限公司);RMZ135精密轮转切片机(德国LEICA公司);TGL 20M高速冷冻离心机(长沙湘智离心机仪器有限公司);IlluminaMiseq测序仪(美国Illumina公司)。
2 方法
2.1 动物分组
实验设对照组、模型组、奥司他韦组(化学药对照组)、抗病毒颗粒组(中药对照组)和MXSGD组,每组12只小鼠。
2.2 MXSGD水煎液的制备
参照文献方法[13-14],采用麻黄先煎方法制备MXSGD水煎液。按其组成比例分别称量5剂药的药材量。先取麻黄45 g,加入药材总量10倍体积的蒸馏水,武火煎煮,待沸腾后,调整为文火煎煮25 min,去沫,再加入石膏90 g、杏仁45 g、炙甘草30 g,继续文火煎煮30 min,煎煮完毕后滤过;二煎加入7倍体积蒸馏水武火煮沸后再文火煎煮20 min,煎煮完毕后滤过,合并2次滤液,水浴浓缩至含生药0.605 g/mL,4 ℃避光保存备用。
2.3 模型制备及给药
实验动物适应性饲养2~3 d后称质量。除对照组外,各组小鼠按照本课题前期研究已建立的方法建立A型流感病毒感染模型[15]。用乙醚轻度麻醉小鼠后,每只小鼠鼻孔内均匀滴入50 LD50流感病毒液0.05 mL,建立模型。对照组小鼠隔离饲养在同等条件下的房间,并按同样方法鼻腔接种0.9%氯化钠溶液0.05 mL。
按临床等效剂量(临床等效剂量按动物每千克体质量占人体表面积的比值计算[16])于感染后24 h开始ig给药,每天1次,每次0.2 mL,连续给药3 d和7 d。奥司他韦、抗病毒颗粒、MXSGD的给药剂量分别为20.14 mg/(kg∙d)、4.03 mL/(kg∙d)、5.22 g/(kg∙d)。对照组和模型组均ig等量生理盐水。
2.4 标本采集
分别于感染后第4天和第8天(给药后第3天和第7天),禁水禁食8 h后,每组随机选取6只小鼠,称质量后,摘眼球放血法处死小鼠,转移至超净工作台内解剖,用无菌镊子将部分结肠段内容物取下,置于EP管中,冻存于−80 ℃冰箱。收集一部分结肠组织置于4%多聚甲醛中固定;另一部分称重后,液氮迅速冷冻保存备用。
2.5 结肠组织病理学观察
苏木素-伊红(HE)染色检测结肠组织病理变化,用4%多聚甲醛固定结肠组织、石蜡包埋、切片(4~5 μm)、HE染色后,在光学显微镜下(×200)观察病理变化。
2.6 免疫组织化学检测趋化因子CCL5、CXCL10在肠黏膜表达
PV-9000通用二步法检测肠组织中趋化因子CCL5、CXCL10蛋白表达水平。石蜡切片常规脱蜡,水化,抗原修复,阻断内源性过氧化物酶,与CCL5、CXCL10一抗37 ℃孵育60 min,阴性对照组用PBS缓冲液代替一抗,PBS缓冲液冲洗后滴加反应增强液,室温孵育20 min,滴加增强酶标山羊抗兔IgG聚合物,室温孵育20 min,加DAB显色剂处理5~8 min,苏木素复染1 min,流水冲洗30 min,氨水返蓝,脱水、透明、封片,镜下观察结果。细胞膜和细胞质棕褐色或者棕黄色着色为阳性细胞,以细胞不着色为阴性。用Axiocam 503 color采集图像,选取结构完整的1张切片,在高倍镜下(×200),每张切片任选5个视野,用Image-proplus分析软件进行阳性显色的平均积分光密度测定(阳性区域面积阳性强度),代表阳性细胞目的蛋白的表达量,然后求其平均值,作为该样本的相对表达量。
2.7 ELISA法检测CCL5、CXCL10在肠组织匀浆中的含量
从液氮中取出冻存结肠标本,标本融化后,剪碎,加入一定量预冷的PBS(pH 7.4),将标本充分匀浆(制备成10%匀浆),离心20 min(4 ℃、2000 r/min),严格按ELISA试剂盒说明书进行操作,运用酶标仪进行检测。
2.8 16S rRNA基因V3~V4区测序
采用Macherey-Nagel Kit试剂盒抽提肠内容物DNA,通过Qubit Fluorometer对DNA浓度进行定量,并通过琼脂糖凝胶电泳对DNA完整性进行评价,DNA质量符合的样本进行文库构建。取30 ng DNA样品及融合引物(341F:5’-ACTCCTACGGGA- GGCAGCAG-3’;806R:5’-GGACTACHVGGGTWT- CTAAT-3’)进行PCR扩增(16S rRNA基因V3~V4区)。纯化后溶于Elution Buffer,贴上标签,文库构建完成。采用IlluminaMiseqPE 300高通量测序平台对检测合格的文库进行双末端(paired-end,PE)测序,获得PE读段(reads)。16S rRNA基因测序分析由武汉华大医学检验所有限公司高通量实验室完成。
2.9 生物信息学分析
下机数据经过数据过滤,去除低质量的reads,使用FLASH(Fast Length Adjustment of Short reads,v1.2.11)软件,利用重叠关系将双末端测序得到的成对reads拼接成原始序列(raw tags);raw tags经进一步去除嵌合体、短序列后得到优质序列(clean tags)。利用UPARSE软件在97%相似度下将优质序列进行聚类,获得操作分类单元(operational taxonomic units,OTUs),通过RDP classifer软件将OTU代表序列与数据库Greengene比对,得到每个样本的物种分类信息,并在各个水平(门,纲,目,科,属,种)进行物种注释。基于聚类结果,进行Alpha多样性分析 [Chao1指数()、Ace指数(Ace)、香农指数(Shannon index)、辛普森指数()]和Beta多样性分析 [层级聚类树分析(hierarchical clustering tree analysis)和主成分分析(principal component analysis,PCA)]。采用线性判别式分析 [linear discriminant analysis(LDA)effect size,LEfSe] 找到组间在丰度上有差异的物种,结果用LDA值分布柱状图及进化分支图表示,LDA值(log 10)>2的物种被认为具有显著性差异[17]。使用冗余分析(redundancy analysis,RDA)及Spearman系数分析肠道菌群与趋化因子水平的相关性。
2.10 统计学方法处理
3 结果
3.1 一般情况观察
给药3 d后,对照组小鼠食欲旺盛、外观肥满、被毛光泽、行动敏捷、呼吸均匀、大小便正常、体温正常、体质量无明显变化。模型组食欲减退、被毛杂乱、竖毛明显、弓背、扎堆、精神萎靡、倦怠懒动、呼吸短促、腹式呼吸明显,小便正常,大便稀软不成形,体温降低、体质量下降。与对照组比较,模型组小鼠体质量差异有统计学意义(<0.01,图1)。各药物治疗组小鼠呼吸渐平稳,被毛光泽度良好,大便湿润成型,体质量减轻后渐恢复。与模型组比较,各药物治疗组体质量差异有统计学意义(<0.01,图1)。给药7 d后,对照组和各药物组小鼠一般情况良好,模型组小鼠精神状态好转,大便渐成形,体质量增加,但与对照组和MXSGD组比较,差异仍有统计学意义(<0.05,图1)。
3.2 小鼠结肠组织病理变化
光学显微镜下观察各组小鼠结肠组织病理切片,结果见图2。给药3 d后,对照组结肠组织结构完整,黏膜排列整齐,腺体无萎缩,黏膜下未见明显炎性细胞浸润。模型组结肠黏膜上皮水肿,部分腺体萎缩,黏膜固有层可见大量炎性细胞浸润。经药物干预后,结肠组织损伤得到不同程度改善,固有层细胞浸润明显减轻。给药7 d后,炎性细胞浸润程度较给药3 d后有所减轻,各药物组结肠黏膜结构完整,层次清晰,与对照组结构相似。
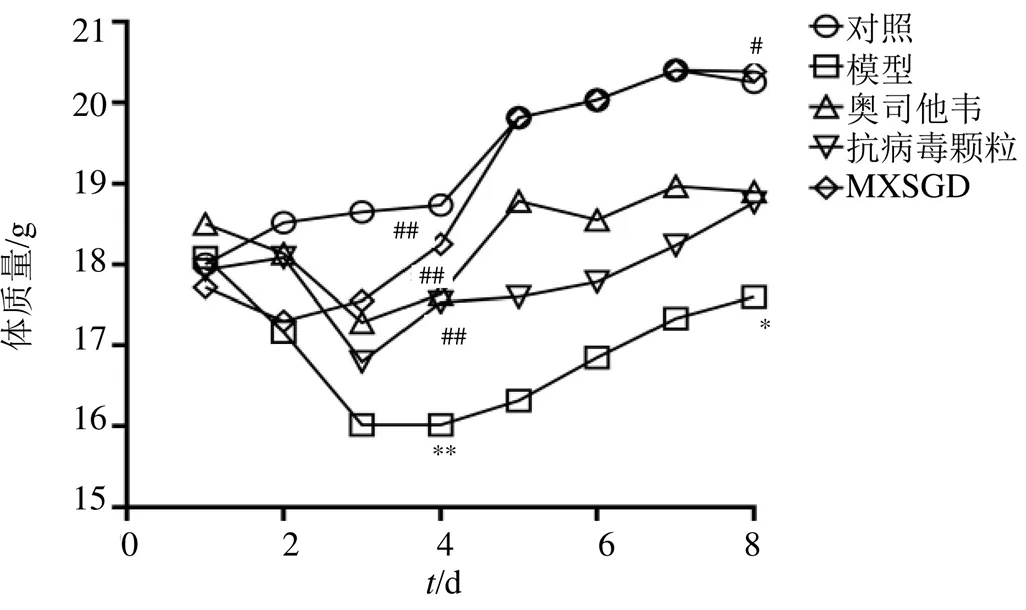
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.3 小鼠结肠组织CCL5、CXCL10蛋白表达
由图3、4可见,CCL5和CXCL10主要表达于胞浆或胞膜上。模型组结肠黏膜固有层中可见大量阳性表达细胞,对照组和各药物组小鼠肠黏膜中也可见少量阳性表达细胞,尤其以CCL5表达更广泛。由表1可知,给药3 d后,模型组CCL5表达量较对照组显著升高(<0.01),奥司他韦组、MXSGD组CCL5表达量较模型组显著降低(<0.01);模型组CXCL10表达量较对照组显著升高(<0.01),奥司他韦组、MXSGD组CXCL10表达量较模型组显著降低(<0.01)。给药7 d后,模型组CCL5表达量较对照组明显升高(<0.05),MXSGD组CCL5表达量较模型组明显降低(<0.05);各组CXCL10表达无显著差异。由上述结果可知,正常情况下,小鼠结肠组织中少量表达CCL5和CXCL10。流感病毒感染可致结肠组织CCL5和CXCL10过量表达。经药物治疗后,CCL5和CXCL10表达均有不同程度下降,与抗病毒颗粒比较,奥司他韦与MXSGD能更好地降低CCL5和CXCL10表达水平。给药7 d后,模型组CCL5仍高于对照组(<0.05),MXSGD组CCL5表达低于模型组(<0.05)。

图2 各组小鼠结肠组织病理变化 (HE染色,×200)

图3 CCL5在各组小鼠结肠组织中的表达 (PV-9000通用二步法,×200)
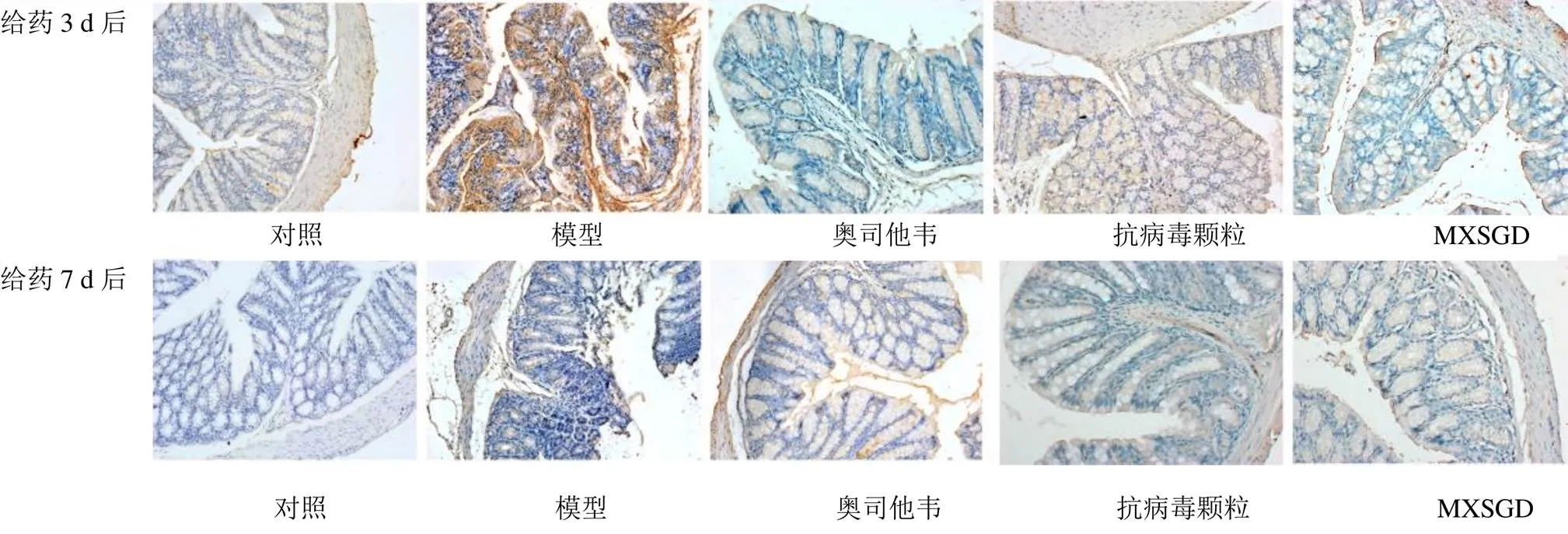
图4 CXCL10在各组小鼠结肠组织中的表达 (PV-9000通用二步法,×200)

表1 各组小鼠结肠组织CCL5、CXCL10平均光密度值(±s, n = 6)
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01,图5同
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group, same as Figure 5
3.4 小鼠结肠组织中CCL5、CXCL10的含量
结果见图5。给药3 d后,模型组小鼠结肠组织中CCL5含量明显高于对照组(<0.01);奥司他韦组、MXSGD组CCL5含量明显低于模型组(<0.05);给药7 d后,各组小鼠结肠组织中CCL5含量无显著差异。给药3 d后,模型组小鼠结肠组织中CXCL10含量明显高于对照组(<0.01);奥司他韦组、抗病毒颗粒组、MXSGD组CXCL10含量明显低于模型组(<0.05、0.01);给药7 d后,各组小鼠结肠组织中CXCL10含量无显著差异。

图5 各组小鼠结肠组织匀浆CCL5和CXCL10含量
3.5 OTU聚类分析
5组小鼠2个时间点共收集30个结肠内容物样品(每组每个时间点3个样品),全部建库合格,共获得1 086 473条高质量的tags,以97%相似度聚类,共获得483个OTU,测序覆盖深度(覆盖指数)0.998 8,平均每个样品288个OTU,归属于9个门、50个属。
3.6 物种分布——微生物群落结构分析
3.6.1 门(Phylum)水平分布 给药治疗后,各组小鼠的肠道优势菌门构成及相对丰度如图6和表2所示。肠道菌群优势菌门以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主。给药3 d后,与对照组比较,模型组厚壁菌门相对丰度显著降低(<0.01),变形菌门(Proteobacteria)相对丰度明显增加(<0.05),厚壁菌门与拟杆菌门比值(F/B)降低,但差异不显著;与模型组比较,奥司他韦组和MXSGD组厚壁菌门相对丰度显著增加(<0.01),F/B值明显增加(<0.05);各药物组变形菌门相对丰度明显降低(<0.05)。给药7 d后,模型组疣微菌门(Verrucomicrobia)相对丰度较对照组明显增加(<0.05);与模型组比较,奥司他韦组、抗病毒颗粒组、MXSGD组疣微菌门相对丰度明显降低(<0.05、0.01),拟杆菌门相对丰度明显升高(<0.05)。与给药3 d后比较,给药7 d后,模型组变形菌门相对丰度显著下降(<0.01),F/B值明显增加(<0.05)。
3.6.2 属水平分布 各组小鼠肠道菌群优势菌属构成及相对丰度如图7及表3所示。给药3 d后,正常菌群优势菌属包括:(10.97%)、颤螺旋菌属(6.76%)、艾克曼菌属(6.27%)、(5.29%)、拟杆菌属(2.62%)、乳杆菌属(1.90%)、粪球菌属(1.11%)、瘤胃球菌属(3.46%)等;与对照组比较,模型组粪球菌属、乳杆菌属、普雷沃菌属相对丰度明显降低(<0.05),埃希菌属()相对丰度明显增加(<0.05);与模型组比较,奥司他韦组、抗病毒颗粒组和MXSGD组埃希菌属相对丰度明显降低(<0.05),抗病毒颗粒组颤螺旋菌属相对丰度明显增加(<0.05),MXSGD组粪球菌属、乳酸杆菌属相对丰度明显增加(<0.05、0.01)。给药7 d后,对照组优势菌属包括:普雷沃菌属(11.19%)、颤螺旋菌属(8.01%)、乳杆菌属(5.84%)、瘤胃球菌属(2.00%)等;与对照组比较,模型组颤螺旋菌属相对丰度明显下降(<0.05);与给药3 d后比较,给药7 d后,模型组埃希菌属相对丰度显著下降(<0.01)。
3.7 Alpha多样性指数分析
常用的Alpha多样性指数包括Chao1指数、ACE指数、Shannon指数和Simpson指数。Chao1指数和ACE指数用来评价菌群的丰富度,数值越大,说明该菌群丰富度越高。Shannon指数和Simpson指数主要用来评价菌群多样性,Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高。给药3 d和7 d后各组小鼠肠道菌群Alpha多样性指数见表4。给药3 d后,与对照组比较,模型组Chao1、ACE、Shannon指数降低,Simpson指数增高(<0.05、0.01);与模型组比较,抗病毒颗粒组Chao1、ACE指数升高,差异有统计学意义(<0.05)。奥司他韦组、抗病毒颗粒组、MXSGD组Shannon指数均显著增高,Simpson指数均显著降低(<0.01);给药7 d后,与对照组比较,模型组Shannon指数明显降低(<0.05);与模型组比较,抗病毒颗粒组Shannon指数明显增高(<0.05)。上述结果提示,流感病毒感染4 d后(给药3 d后),模型组小鼠肠道菌群丰富度和多样性明显降低,抗病毒颗粒能增加小鼠肠道菌群丰富度和多样性;奥司他韦、MXSGD能增加小鼠肠道菌群多样性;流感病毒感染8 d后(给药7 d后),模型组小鼠肠道菌群多样性仍低于对照组,抗病毒颗粒可以增加小鼠肠道菌群多样性。

图6 各组小鼠肠道菌群在门水平上分布

表2 各组小鼠肠道菌群门水平相对丰度 (±s, n = 3)
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01;与给药3 d后比较:^<0.05 ^^<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group; ^< 0.05 ^^< 0.01corresponding groups after 3 d of administration
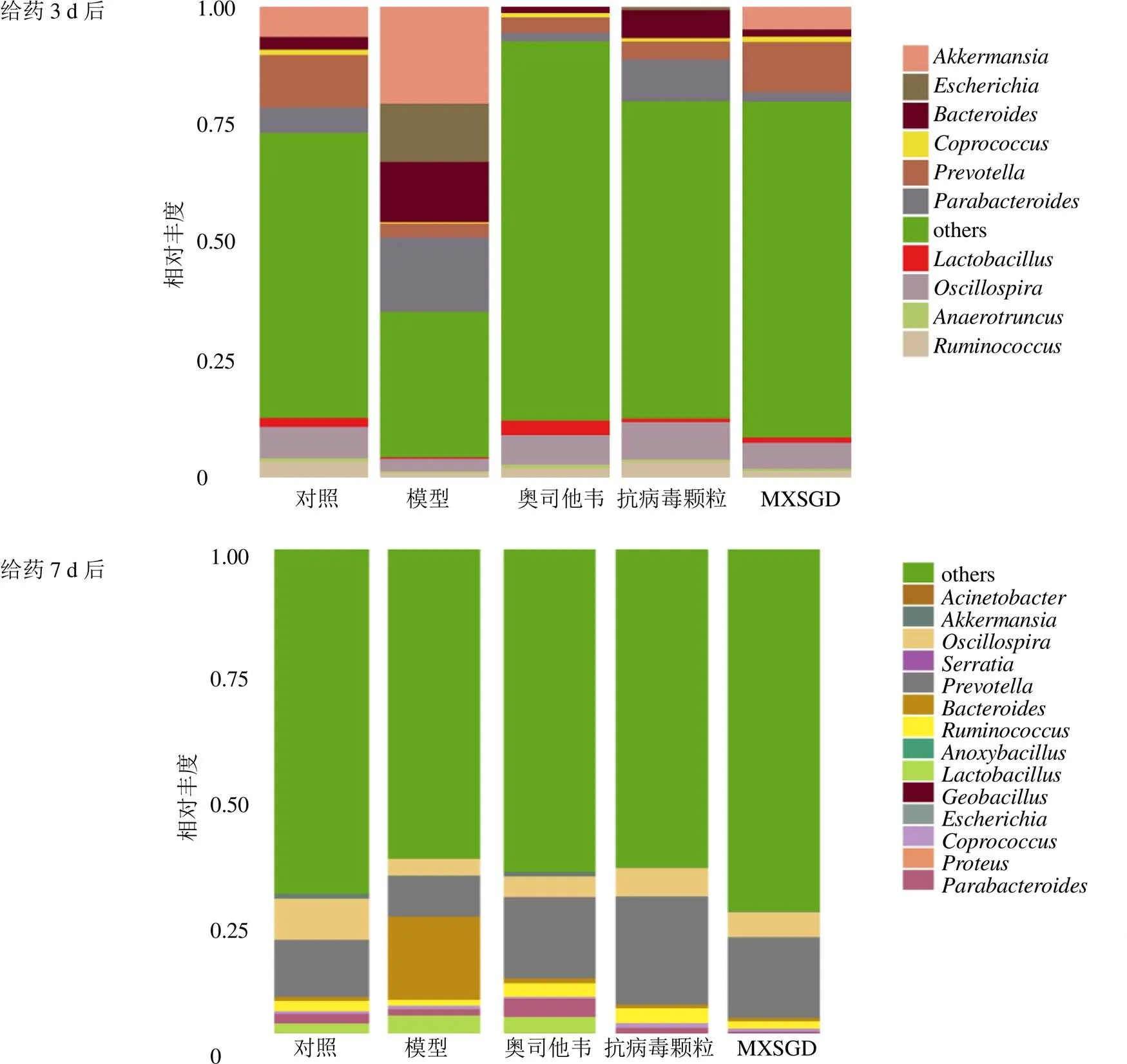
图7 各组小鼠肠道菌群在属水平分布

表3 各组小鼠肠道菌群属水平相对丰度(±s,n=3)
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01;与给药治疗3 d比较:^<0.05 ^^<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model control group; ^< 0.05 ^^< 0.01corresponding groups after 3 d of administration
3.8 Beta多样性分析
Beta多样性分析主要对不同样品/不同组间样品微生物群落构成进行比较分析,常用PCA和层级聚类树分析。PCA是常用的一种降维分析方法,通过将方差进行分解,将多组数据的差异反映在二维坐标图上,图中两样品点距离越近,表示它们的物种组成越相似,反之亦然。层级聚类树可以清楚看出每个样品的距离远近,根据树枝的距离可以划分出不同的分组。PCA结果(图8-a)提示,给药3 d后,模型组各样品点与对照组样品点距离较远,表明两组样品之间细菌群落组成存在明显差异,说明流感病毒感染可以影响正常小鼠肠道菌群的组成和结构。药物治疗组各样品点与对照组各样品点距离接近,且明显偏离于模型对照组各样品点,提示药物组群落组成与对照组更相似。层级聚类树分析结果(图8-b)提示,模型组细菌群落结构与其他各组有明显差异。说明奥司他韦、抗病毒颗粒和MXSGD均可以调节流感病毒感染后小鼠肠道菌群组成结构。给药7 d后,各组PCA与层级聚类树分析结果(图8-c、d)提示,PCA结果显示模型组样品点仍然偏离于其余各组样品点,各药物组样品点与对照组样品点间距离较给药3 d后更接近。层级聚类树分析结果显示,MXSGD组与对照组肠道菌群组成更相似。

表4 各组小鼠肠道菌群Alpha多样性指数统计分析结果(±s,n=3)
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group

a、c-PCA b、d-层级聚类树分析 A1~A3、F1~F3-对照组 B1~B3、G1~G3-模型组 C1~C3、H1~H3-奥司他韦组 D1~D3、I1~I3-抗病毒颗粒组 E1~E3、J1~J3-MXSGD组
3.9 组间差异物种的筛选
采用LEfSe筛选组间具有显著差异的物种。LDA值超过设定值(常以>3.5为筛选标准)的物种,即被认为是组间具有统计学差异的生物标记物(biomarker),并根据差异物种绘制物种进化分支图。在进化分支图中,由内至外辐射的圆圈代表由界至属(或种)的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比。无显著差异的物种统一着色为黄色,差异物种生物标记物跟随组进行着色。图9-a~h显示,给药3 d后,模型组与其他各组比较具有显著差异的优势物种为变形菌门、γ-变形杆菌纲(Gammaproteobacteria)、肠杆菌目(Enterobacteriales)、肠杆菌科(Enterobacteriaceae)、埃希菌属、克雷伯菌属、沙雷氏菌属、变形杆菌属,疣微菌门、疣微菌纲(Verrucomicrobiae)、脱铁杆菌目(Deferribacterales)、脱铁杆菌属、多拉菌属等;与模型组比较,对照组具有显著优势的物种为厚壁菌门、梭菌纲(Clostridia)、瘤胃菌科(Ruminococcaceae)、瘤胃菌属、颤螺旋菌属、毛螺菌科(Lachnospiraceae)、粪球菌属、红蝽菌纲(Coriobacteriia)、红蝽菌目(Coriobacteriales)、红蝽菌科(Coriobacteriaceae)、罗斯氏菌属等;奥司他韦组具有显著优势的物种为厚壁菌门、梭菌纲、瘤胃球菌科、颤螺旋菌属、乳杆菌目(Lactobacillales)等;抗病毒颗粒组具有显著优势的物种为厚壁菌门、梭菌纲、瘤胃球菌科、颤螺旋菌属;MXSGD组具有显著优势的物种为普雷沃菌科(Prevotellaceae)、普雷沃菌属、厚壁菌门、梭菌纲、瘤胃球菌科、颤螺旋菌属、乳杆菌目、乳杆菌科(Lactobacillaceae)、乳杆菌属、毛螺菌科、粪球菌属、丁酸梭菌属等。给药7 d天后,各组间显著差异物种不明显(LDA值<3.5)。
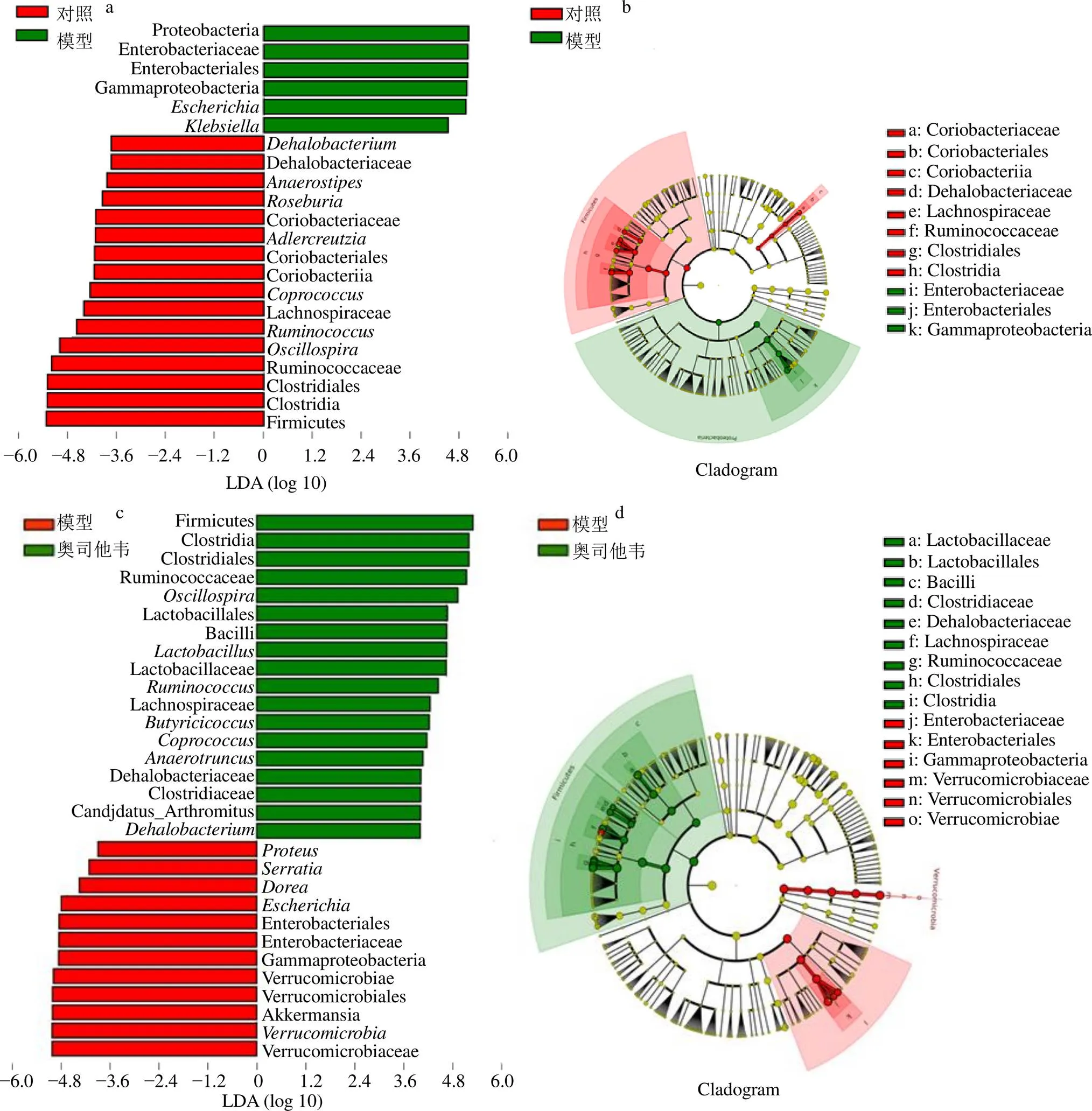
a-对照组和模型组LDA值分布柱状图 b-对照组和模型组进化分支图 c-模型组和奥司他韦组LDA值分布柱状图 d-模型组和奥司他韦组进化分支图 e-模型组和抗病毒颗粒组LDA值分布柱状图 f-模型组和抗病毒颗粒组进化分支图 g-模型组和MXSGD组LDA值分布柱状图 h-模型组和MXSGD组进化分支图
a-histogram of LDA scores in normal control group and model control group b-cladogram in normal control group and model control group c- histograms of LDA scores in model control group and oseltamivir group d-cladogram in model control group and oseltamivir group e-histograms of LDA scores in model control group and antivirus granule group f-cladogram in model control group and antivirus granule group g-histograms of LDA scores in model control group and MXSGD group h-cladogram in model control group and MXSGD group
图9 各组小鼠肠道菌群LEfSE差异分析结果
Fig. 9 LEfSE difference analysis in various groups
3.10 肠道菌群与趋化因子关联性分析
通过RDA及Spearman等级相关系数分析各组小鼠结肠组织中趋化因子CCL5、CXCL10与肠道菌群的关联性。结果(图10)显示,小鼠肠道菌群的分布与肠黏膜趋化因子CCL5和CXCL10含量的相关性具有显著性差异。在门水平上:变形菌门、疣微菌门、脱铁杆菌门、拟杆菌门与CCL5和CXCL10含量呈正相关;厚壁菌门、放线菌门(Actinobacteria)与CCL5和CXCL10含量呈负相关。在属水平上:埃希菌属、梭菌属、变形杆菌属、克雷伯菌属、沙雷氏菌属、拟杆菌属、属与CCL5和CXCL10含量呈正相关;乳杆菌属、厌氧棒状菌属、粪球菌属、颤螺旋菌属、普雷沃菌属、瘤胃球菌属、丁酸梭菌属、低嗜盐细菌属与CCL5和CXCL10含量呈负相关。其中,埃希菌属、克雷伯菌属、梭菌属、变形菌属、沙雷氏菌属、粪球菌属、厌氧棒状菌属与CCL5和CXCL10相关性显著(<0.05、0.01);低嗜盐细菌属、拟杆菌属、乳杆菌属与CCL5相关性显著(<0.05、0.01);颤螺旋菌属与CXCL10相关性显著(<0.05)。
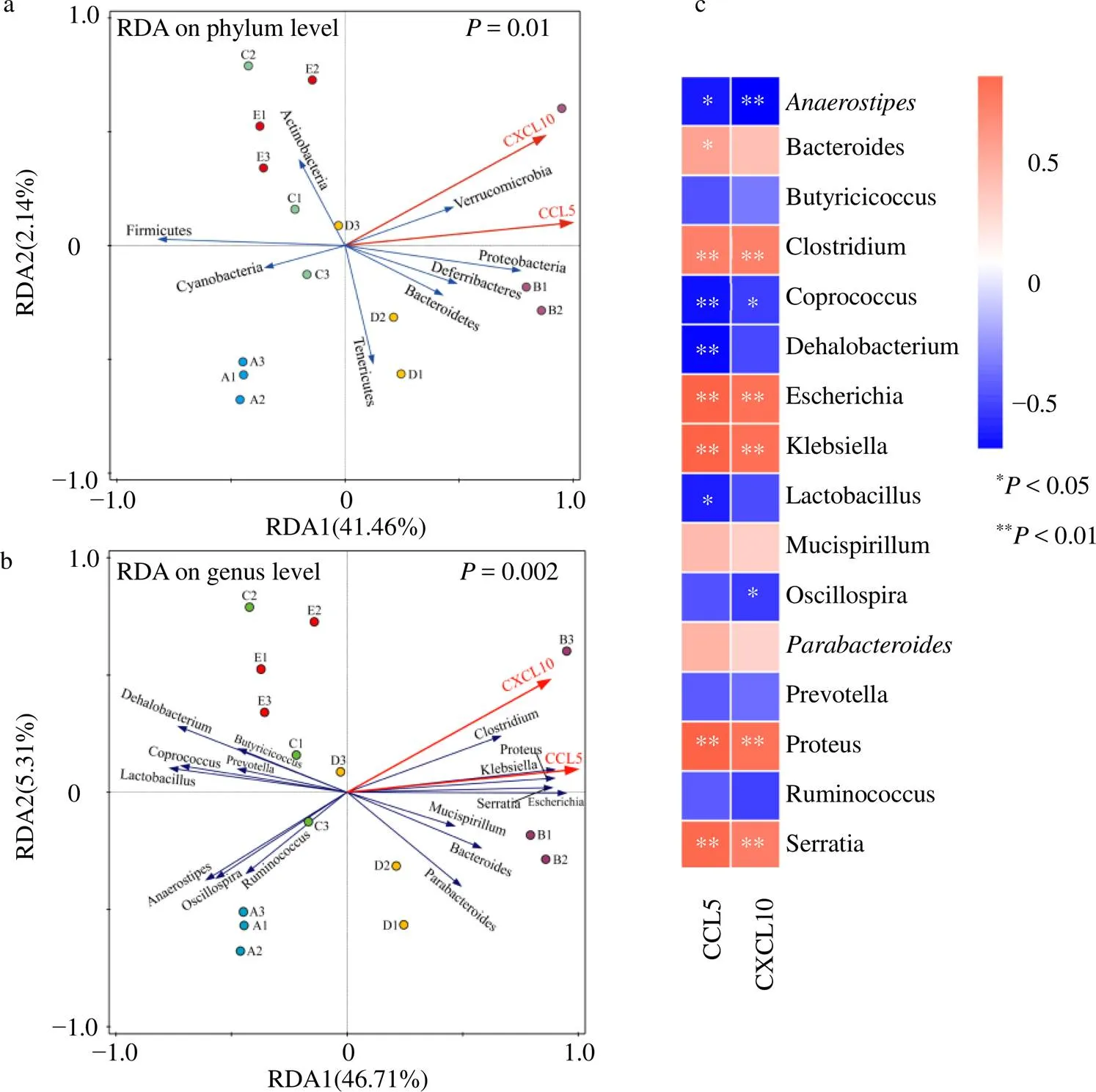
a-RDA分析(门水平) b-RDA分析(属水平) c-Spearman相关热图 A1~A3-对照组 B1~B3-模型组 C1~C3-奥司他韦组 D1~D3-抗病毒颗粒组 E1~E3-MXSGD组
4 讨论
MXSGD为汉代张仲景《伤寒论》名方,具有宣肺平喘、祛除寒湿、通腑泻热兼燥湿健脾之功效,是治疗证属热毒袭肺和热毒壅肺流感的基本方[18]。2019年12月以来爆发的新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染肺炎(corona virus disease 2019,COVID-19)疫情中,MXSGD是国家及各地方卫生管理部门发布的诊疗方案中被推荐使用频次最高的中药方剂之一[19],是国家卫生健康委员会发布的系列《新型冠状病毒的肺炎诊疗方案》中推荐在临床治疗期使用的“清肺排毒汤”的重要组成部分[20]。
前期研究发现,趋化因子可能是流感“肺病及肠”的物质基础之一[11]。流感病毒感染的单核/巨噬细胞可迅速产生CC家族趋化因子(如CCL5),以及CXC家族趋化因子(如CXCL10),这些趋化因子的急剧升高与流感病毒感染引起的炎症病理损伤密切相关。CCL5也被命名为RANTES(regulated upon activation normal T cell expressed and secreted),由上皮细胞、CD8+T、CD4+T、单核巨噬细胞产生,对单核细胞、嗜碱性粒细胞和T细胞有强烈的趋化作用,能促进白细胞向炎症部位迁移和浸润。CXCL-10又被称作γ干扰素诱导蛋白(interferon-gamma-induced protein,IP-10),是一种属于CXC趋化因子家族的小分子蛋白质,与流感病毒感染引起的肺部损伤的严重程度密切相关,由IFN-γ、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、病毒RNA等诱导上皮细胞、内皮细胞、单核巨噬细胞、成纤维细胞和淋巴细胞产生,可趋化T淋巴细胞、自然杀伤细胞和单核细胞聚集,促进IFN-γ、IL-6、IL-8等多种促炎细胞因子分泌[21]。因此,抑制CCL5和CXCL10过表达,对于控制流感病毒感染引起的炎症反应有重要意义。
已有研究发现,肠道菌群及其代谢产物可影响宿主局部或全身免疫功能。短链脂肪酸(short chain fatty acids,SCFAs)是肠道有益菌发酵膳食纤维的重要产物,主要包括乙酸、丙酸、丁酸等。已有研究发现,厚壁菌门是丁酸盐的重要来源,丁酸盐是细胞的主要能量底物,厚壁菌门和拟杆菌门比值降低可以直接影响肠道菌群对膳食纤维代谢,使SCFAs浓度降低,厚壁菌门减少可诱发或加重局部炎症反应[22]。变形菌门是肠道的4个主要菌门(厚壁菌门、拟杆菌门、变形菌门、放线菌门)中随时间变化最不稳定的菌门,变形菌门丰度增加被视为反映肠道菌群紊乱的一个标志及潜在的疾病诊断指标[23]。变形菌门能够有效利用炎症反应产生的硝酸盐作为电子受体,进行厌氧呼吸,因此在炎症环境中,比依赖发酵生长的厚壁菌门和拟杆菌门更具增殖优势,其过度生长可进一步加重局部炎症反应[23]。研究发现,SCFAs可以诱导调节性T细胞(regulatory cells,Tregs)的产生和分化,从而促进抑炎细胞因子IL-10产生,并且可以强烈减少促炎趋化因子CCL3、CCL4、CCL5、CXCL9、CXCL10、CXCL11的释放,从而抑制白细胞迁徙,具有很强的抗炎作用[24]。普雷沃菌属、瘤胃球菌属、粪球菌属、丁酸梭菌属、乳酸杆菌属均可增加肠道内SCFAs含量,诱导小鼠肠道中Treg细胞的产生和分化,促进IL-10的产生,发挥炎症抑制作用[25-27]。颤螺旋菌属在炎症疾病中丰度降低,与健康呈正相关,对人体健康具有潜在的重要性[28]。而过度生长的大肠埃希菌或肺炎克雷伯菌等可以促进CCL5及CXCL10等趋化因子的表达,从而加重炎性损伤程度[7-8]。
研究发现,流感病毒感染后模型组小鼠肠黏膜出现明显病理变化,黏膜下层和固有层中见大量炎性细胞浸润,炎性细胞胞浆和胞膜上有大量趋化因子CCL5和CXCL10表达。Alpha多样性分析结果显示模型组小鼠肠道菌群丰富度和多样性明显降低。Beta多样性分析结果显示模型组小鼠肠道菌群组成结构与对照组和各药物组明显不同。病毒感染后第4天,与对照组比较,模型组厚壁菌门相对丰度明显下降,厚壁菌门与拟杆菌门比值(F/B)明显降低,变形菌门相对丰度显著增加,埃希菌属相对丰度增加,粪球菌属、乳杆菌属、普雷沃菌属丰度下降。LEfSe分析结果显示,克雷伯菌属也是模型组的优势菌属。经药物治疗3 d后,各药物组肠黏膜炎性细胞浸润明显减少,CCL5及CXCL10表达明显降低;Alpha多样性分析结果显示各药物组肠道菌群多样性增加,抗病毒颗粒组菌群丰富度增加;Beta多样性分析结果显示,在各药物组中,MXSGD组小鼠肠道菌群组成更接近对照组;与模型组比较,各药物组变形菌门、埃希菌属相对丰度均降低,奥司他韦组和MXSGD组厚壁菌门相对丰度及F/B值明显增加,MXSGD组乳杆菌属和粪球菌属相对丰度显著增加;此外,LEfSe分析的结果提示,MXSGD组的优势物种还包括瘤胃球菌科、颤螺旋菌属、毛螺菌科、丁酸梭菌属等。通过相关性分析进一步发现,埃希菌属、克雷伯菌属、变形杆菌属等与CCL5和CXCL10含量呈显著正相关,粪球菌属、厌氧棒状菌等与CCL5和CXCL10含量呈显著负相关,乳杆菌属与CCL5含量呈显著负相关,颤螺旋菌属与CXCL10含量呈显著负相关。CCL5和CXCL10表达下调,也可能会影响抗病毒细胞因子IFN-γ产生,从而影响机体抗病毒感染免疫。但前期研究[29]发现,MXSGD可以促进细胞因子IL-2产生,IL-2可以刺激T细胞快速增殖分化产生IFN-γ。可见,MXSGD可以通过调节复杂的细胞因子网络,减少炎症因子表达下调对机体抗感染免疫带来的负面影响。
综上所述,流感病毒感染后,小鼠肠道菌群组成结构明显紊乱,且结肠组织中趋化因子CCL5和CXCL10的表达明显增强。相关性分析结果显示,肠道菌群与趋化因子CCL5和CXCL10表达显著相关。奥司他韦、抗病毒颗粒和MXSGD均能够不同程度修复流感病毒感染后紊乱的肠道菌群,并降低结肠组织中趋化因子CCL5和CXCL10的表达。与其他药物组比较,MXSGD组肠道菌群结构更接近对照组水平,MXSGD能更好促进乳杆菌属和粪球菌属益生菌生长,且对流感病毒诱导的CCL5和CXCL10过表达均有一定的抑制作用。因此,肠道菌群可以作为MXSGD防治流感的一个潜在靶点,MXSGD可能通过调节菌群结构进而下调趋化因子水平,缓解流感病毒感染所致免疫炎症损伤,其具体作用机制值得进一步深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Laetitia M, Charrel R N, Pierre-Emmanuel C,. Prevalence of gastrointestinal symptoms in patients with influenza, clinical significance, and pathophysiology of human influenza viruses in faecal samples: what do we know? [J]., 2015, 12: 215-224.
[2] Wang J, Li F, Wei H,. Respiratory influenza virus infection induces intestinal immune injury via microbiota-mediated Th17 cell-dependent inflammation [J]., 2014, 211(12): 2397-2410.
[3] 刘雨琪, 朱俊萍, 何秋水. 流感病毒与肠道菌群的相互作用对感染结局的影响 [J]. 医学综述, 2019, 25(14): 2746-2758.
[4] Li H, Liu X, Chen F,. Avian influenza virus subtype H9N2 affects intestinal microbio-ta, barrier structure injury, and inflammatory intestinal disease in the chicken ileum [J]., 2018, 10(5): 270-284.
[5] Tavares L P, Garcia C C, Gonçalves A,. ACKR2 contributes to pulmonary dysfunction by shaping CCL5: CCR5-dependent recruitment of lymphocytes during influenza A infection in mice [J]., 2020, 318(4): L655-L670.
[6] 胡艮娣, 王晓泉, 陈祥, 等. 趋化因子IP-10在介导病毒感染性疾病中的研究进展 [J]. 病毒学报, 2019, 35(4): 672-678.
[7] Karlsson I, Hagman R, Guo Y,. Pathogenicand lipopolysaccharide enhance the expression of IL-8, CXCL5, and CXCL10 in canine endometrial stromal cells [J]., 2015, 84(1): 34-42.
[8] 杨明, 麻雅婷, 何赏, 等. LIF和RANTES在单病原菌性血流感染小鼠模型中的表达及意义 [J]. 临床检验杂志, 2018, 36(1): 53-56.
[9] 李玲, 魏科, 卢芳国, 等. 基于TLR4-MyD88-TRAF6信号通路的麻杏石甘汤抗A型流感病毒感染小鼠所致的病毒性肺损伤研究 [J]. 中草药, 2017, 48(8): 1591-1596.
[10] 张世鹰, 何谷良, 卢芳国, 等. 基于TLR7/8介导的IFN-α/β蛋白表达水平探讨麻黄先煎之麻杏石甘汤抗流感病毒的机制 [J]. 中华中医药杂志, 2019, 34(3): 1188-1193.
[11] 邹莉, 何谷良, 卢芳国, 等. 麻杏石甘汤对流感病毒肺部感染模型肺、结肠组织MCP-1蛋白表达水平的影响 [J]. 中国实验方剂学杂志, 2018, 24(5): 100-106.
[12] 郭元吉, 程小雯. 流行性感冒病毒及其试验技术 [M]. 北京: 中国三峡出版社, 1997: 129-130.
[13] 葛资宇, 童骄, 那婧婧, 等. 不同煎煮方法的麻杏石甘汤及其含药血清对A型流感病毒神经氨酸酶活性的影响 [J]. 中国中西医结合杂志, 2016, 36(9): 1119-1123.
[14] 饶毅, 张五萍, 魏惠珍, 等. 不同煎煮方法对麻杏石甘汤中成分变化研究 [J]. 中成药, 2014, 36(2): 337-341.
[15] 李玲, 卢芳国, 伍参荣, 等. 麻杏石甘汤对A型流感病毒感染小鼠免疫保护作用的研究 [J]. 中医药学报, 2010, 38(2): 25-28.
[16] 贺石林, 王键, 王净净. 中医科研设计与统计学 [M]. 长沙: 湖南科学技术出版社2013: 48-49.
[17] Segata N, Izard J, Waldron L,. Metagenomic biomarker discovery and explanation [J]., 2011, 12(6): R60.
[18] 赵静, 郭洪涛, 韩经丹, 等. 中医药治疗流行性感冒文本挖掘结果与诊疗方案的比较分析 [J]. 中医杂志, 2014, 55(7): 612-616.
[19] 王哲义, 怿泽, 曲稔栋, 等. 基于网络药理学的麻杏石甘汤治疗新型冠状病毒肺炎(COVID-19)作用机制探讨 [J]. 中草药, 2020, 51(8): 1996-2003.
[20] 李修洋, 宋斌, 雷烨, 等.《新型冠状病毒肺炎诊疗方案(试行第六版)》中医诊疗方案解读 [J]. 吉林中医药, 2020, 40(6): 701-708.
[21] Wang W, Yang P, Zhong Y,. Monoclonal antibody against CXCL-10/IP-10 ameliorates influ enza A (H1N1) virus induced acute lung injury [J]., 2013, 23(4): 577-580.
[22] Kho Z Y, Lal S K. The human gut microbiome-A potential controller of wellness and disease [J]., 2018, doi: 10.3389/fmicb.2018.01835.
[23] Shin N R, Whon T W, Bae J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota [J]., 2015, 33(9): 496-503.
[24] Nastasi C, Candela M, Bonefeld C M,. The effect of short-chain fatty acids on human monocyte-derived dendritic cells [J]., 2015, 5: 16148.
[25] Koh A, De Vadder F, Kovatcheva-Datchary P,. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites [J]., 2016, 165(6): 1332-1345.
[26] Louis P, Hold G L, Flint H J. The gut microbiota, bacterial metabolites and colorectal cancer [J]., 2014, 12(10): 661-672.
[27] 俞昊男, 刘志华. 肠道微生物与黏膜免疫研究的前沿进展 [J]. 中国免疫学杂志, 2019, 35(16): 1921-1930.
[28] Konikoff T, Gophna U. Oscillospira: A central, enigmatic component of the human gut microbiota [J]., 2016, 24(7): 523-524.
[29] 李玲, 吴佳敏, 欧阳建军, 等. 抗流感病毒性肺炎的有效中药复方筛选及机制研究 [J]. 中国免疫学杂志, 2018, 34(8): 1168-1173.
Effects of Maxing Shigan Decoction on intestinal flora and chemokines CCL5 and CXCL10 in mice infected with influenza virus
WANG Ping1, 2, ZHAO Cheng1, LU Fang-guo1, WU Tao1, ZHANG Xiang-gang1, CHEN Chun-jing1, XIAO Rong1, NING Yi1, WEI Ke1, LI Ling1, CAI Kun2, TIAN Wei-yi2
1. Hunan University of Chinese Medicine, Changsha 410208, China 2. Guizhou University of Chinese Medicine, Guiyang 550025, China
To investigate the potential mechanism of Maxing Shigan Decoction (MXSGD, 麻杏石甘汤) by affecting the intestinal flora and chemokines in mice in order to prevent and treat the influenza virus infection.The infected mice model of influenza A virus was established by intranasal inoculation. After 3 and 7 d of gavage administration or saline, the state of mice was observed. Colon tissue was detected by HE staining. The expressions and contents of chemokines CCL5 and CXCL10 were detected by immunohistochemistry and enzyme-linked immunosorbent assay, respectively. The bacteria in colonic contents was sequenced, annotated and clustered by using the V3—V4 variable region of 16S rRNA. The Alpha diversity, Beta diversity, and the species difference among groups were analyzed by linear discriminant analysis (LDA) effect size, LEfSe. Redundancy analysis and Spearman’s rank correlation coefficient were used for correlation analysis between intestinal flora and CCL5, CXCL10.Compared with the normal group, the weight of mice in the model control group was decreased (< 0.01), the inflammatory cell infiltration in the lamina propria of intestinal mucosa was obvious and the expression of CCL5 and CXCL10 was upregulated (< 0.01), the levels of CCL5 and CXCL10 in the colon tissue were both increased (< 0.01) after 3 d treatment. Compared with the model control group, the weight of mice was increased in each treatment group. Inflammatory cell infiltration, CCL5 and CXCL10 positive cells, the contents of CCL5 and CXCL10 in intestinal mucosa were all decreased, especially in oseltamivir group and MXSGD group (< 0.01,< 0.05). There were significant differences in the composition of the gut microbiota among groups according to the analysis of flora diversity and the species differences. The composition of intestinal flora in the model control group was significantly different from the normal control group and each drug group. The relative abundances of Proteobacteria andin the model control group were significantly higher than the normal control group (< 0.05), while Firmicutes,andwere significantly lower (< 0.05). Compared with the model control group, the relative abundances of Proteobacteria andin each drug group were significantly lower (< 0.05), the relative abundance of Firmicutes in oseltamivir group and MXSGD group were increased significantly (< 0.01), the relative abundance ofin antiviral granule group was increased (< 0.05), and the relative abundance ofandin MXSGD group was increased significantly (< 0.01,< 0.05). After 7 d, pathological changes of colon tissue, the expression of chemokines and the abundance of Proteobacteria andspecies (< 0.01) in the model control group were all decreased. Compared with the model control group, the relative abundances of Verrucomicrobia in each drug group were significantly lower (< 0.01,< 0.05) and the relative abundance of Bacteroidetes were increased significantly (< 0.05). Correlation analysis showed that CCL5 and CXCL10 contents in the colon of mice were significantly correlated with the abundance of,,and(< 0.01,< 0.05).The infection of influenza A virus can make the intestinal flora structure disorganized and immune function in mice unbalanced. MXSGD may regulate the intestinal flora structure and then affect the production of chemokines, which has a certain protective effect on the intestinal immune damage caused by influenza virus.
influenza A virus (IAV); Maxing Shigan Decoction; intestinal flora; chemokines; CCL5; CXCL10
R285
A
0253 - 2670(2021)01 - 0160 - 16
10.7501/j.issn.0253-2670.2021.01.020
2020-04-20
国家自然科学基金资助项目(81774126);国家自然科学基金资助项目(82074250);湖南省自然科学基金项目(2020JJ4063);湖南省教育厅创新平台开放基金项目(17K067);湖南中医药大学中西医结合一流学科开放基金(2018ZXYJH11);湖南中医药大学研究生创新课题立项项目(2019CX05);湖南中医药大学研究生创新课题立项项目(2019CX22);贵州省科技创新人才团队(黔科合平台人才 [2020] 5010)
王 平(1977—),女,贵州毕节人,副教授,湖南中医药大学在读博士,研究方向为感染性疾病的中医药防治研究。
卢芳国,女,教授,博士研究生导师,研究方向为感染性疾病的中医药防治研究。E-mail: lufangguo0731@163.com
[责任编辑 潘明佳]
