左金丸醇提物抑制人胃癌SGC-7901细胞糖酵解的作用机制
2021-01-06吴秋雪孙梦瑶汤庆丰
吴秋雪,孙梦瑶,许 博,张 辉,汤庆丰*
左金丸醇提物抑制人胃癌SGC-7901细胞糖酵解的作用机制
吴秋雪1,孙梦瑶1,许 博1,张 辉2*,汤庆丰1*
1. 上海中医药大学附属普陀医院,上海 200062 2. 上海中医药大学,上海 200135
研究左金丸醇提物对人胃癌细胞SGC-7901增殖和糖酵解的作用及机制。采用CCK-8法检测左金丸醇提物(5、10、25、50、100、200 μg/mL)对SGC-7901细胞增殖的影响;检测左金丸醇提物对SGC-7901细胞葡萄糖摄取量、乳酸和三磷酸腺苷(adenosine triphosphate,ATP)含量的影响,评价左金丸醇提物对SGC-7901细胞糖酵解的作用;采用qRT-PCR和Western blotting法检测左金丸醇提物对细胞糖酵解途径相关蛋白Rhotekin(RTKN)表达的影响;采用shRNA干扰慢病毒感染SGC-7901细胞,检测左金丸醇提物对SGC-7901细胞葡萄糖摄取、乳酸和ATP含量的影响。左金丸醇提物对SGC-7901细胞增殖具有显著抑制作用(<0.001),呈剂量、时间相关性;左金丸醇提物显著降低SGC-7901细胞葡萄糖摄取、乳酸和ATP含量(<0.01、0.001);左金丸醇提物显著降低SGC-7901细胞中mRNA和RTKN蛋白表达(<0.001);干扰抵消了左金丸醇提物对SGC-7901细胞葡萄糖摄取、乳酸和ATP含量的抑制作用(<0.001)。左金丸醇提物可显著抑制SGC-7901细胞增殖、降低细胞糖酵解水平,其机制与下调RTKN表达相关。
左金丸;胃癌;细胞增殖;糖酵解;Rhotekin
胃癌是全球最常见的消化道恶性肿瘤之一。我国每年新增胃癌病例约40万,其中死亡病例35万[1]。胃癌发病率在我国恶性肿瘤中居第2位,死亡率居第3位[2]。糖代谢是细胞获取能量的主要方式,葡萄糖是细胞糖代谢的主要能量来源。近年来研究发现,肿瘤细胞中广泛存在以有氧糖酵解为主的代谢重编程现象,以满足肿瘤细胞增殖与能量供给的需求,从而促进恶性肿瘤的增殖、转移等[3]。左金丸是中药经典方剂,出自元代医家朱丹溪的《丹溪心法》,由黄连6两、吴茱萸1两组成,常用于治疗胃部疾病[4-5]。现代药理学研究表明左金丸对胃癌有较好的防治作用[6],但左金丸治疗胃癌的作用机制尚不明确。Rhotekin(RTKN)是一种Rho效应蛋白,在细胞骨架重组、细胞分化、细胞周期进展和细胞迁移等多种生物学过程中起着关键作用[7]。研究表明,与正常组织相比,RTKN在肝癌[8]、胃癌[9]、结肠癌[10-11]、乳腺癌[12]等多种癌组织中呈高表达状态[13],且敲除后可抑制人胃癌细胞SGC-7901和MKN-45中的乳酸、三磷酸腺苷(adenosine triphosphate,ATP)水平[10]。本研究以SGC-7901细胞为研究对象,探究左金丸醇提物对SGC-7901细胞增殖和糖酵解水平的影响及其潜在的分子机制,为左金丸应用于临床胃癌的治疗提供理论依据。
1 材料
1.1 细胞
人胃癌细胞株SGC-7901,购自上海生命科学研究院细胞资源中心。
1.2 药物
黄连(批号HY2014050601)、吴茱萸(批号LY1408074)购自上海华宇药业有限公司,经上海中医药大学中药研究所吴大正教授鉴定分别为毛茛科植物黄连Franch. 的干燥根茎、芸香科植物吴茱萸(Juss.) Benth. 的干燥近成熟果实。
1.3 试剂
RPMI 1640培养基(批号01-100-1ACS),购自以色列BI公司;胎牛血清(FBS,批号10099-141)、双抗(批号15240-062)、0.25% EDTA-胰蛋白酶(批号25200-072),购自美国Gibco公司;CCK-8试剂盒(批号CK04),购自日本同仁化学研究所;葡萄糖检测试剂盒(批号K682-50),购自美国Biovision公司;乳酸检测试剂盒(批号A019-2-1),购自南京建成生物工程研究所;蛋白酶抑制剂混合物(批号P1045-1)、磷酸酶抑制剂混合物(批号P1045-2)、ATP检测试剂盒(批号S0026)、BCA蛋白浓度测定试剂盒(批号P0011)、辣根过氧化物酶(HRP)标记的山羊抗小鼠/兔IgG抗体(批号A0208),购自上海碧云天生物技术有限公司;PVDF膜(批号ISEQ00010),购自美国Millipore公司;蛋白预染Marker(批号26619),购自加拿大Fermentas公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔单克隆抗体(批号D16H11),购自美国CST公司;RTKN抗体(批号ab154954),购自英国Abcam公司;干扰慢病毒(批号PIEL248033167)、嘌呤霉素(批号REVG1001)、HiTrans G病毒感染液(批号REVG005),购自上海吉凯基因公司;RIPA组织细胞快速裂解液(批号89900)、Trizol裂解液(批号15596018),购自美国Ambion公司;逆转录试剂盒(批号K1622)、qRT-PCR试剂盒(批号K0222),购自Thermo Fisher Scientific公司;、基因引物,购自生工生物工程股份有限公司。
1.4 仪器
Heraceii 2401 CO2恒温培养箱、Presco 21 Muitifuge XIR离心机、Varioskan LUX Flash酶标仪,购自美国Thermo公司;DMi1倒置相差显微镜、DFC450 C荧光显微镜,购自德国Leica公司;PowerPac Basic电泳仪、MIini Protean®Tetra Cell垂直板电泳槽、MIini Trans-Blot®Cell转膜仪、CDT94547 ChemiDocTMTouch Imaging Western blotting成像系统,购自美国Bio Rad公司。
2 方法
2.1 左金丸醇提物的制备
取吴茱萸300 g和黄连1800 g,加8倍量75%乙醇,回流提取2次,每次1 h。合并提取液,减压干燥,得干粉565 g,提取率为26.9%。左金丸醇提物中活性成分黄连碱、表小檗碱、小檗碱、巴马汀、吴茱萸碱、吴茱萸次碱的质量分数分别为7.120%、4.150%、31.400%、8.400%、0.053%、0.051%[14],符合《中国药典》2015年版的质量控制标准。左金丸醇提物以培养基配制成相应质量浓度的溶液用于后续实验。
2.2 细胞培养
SGC-7901细胞用含10% FBS、1%双抗的RPMI 1640培养基,于5% CO2、37 ℃的恒温培养箱培养。
2.3 左金丸醇提物对细胞活性的影响
取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为1×105个/mL,接种于96孔板中。培养12 h后,加入左金丸醇提物(5、10、25、50、100、200 μg/mL),对照组加入不含药物的培养基,培养24、48、72 h后,每孔加入110 μL含10% CCK-8的无血清培养基,孵育1 h。采用酶标仪测定450 nm处各孔的吸光度()值,并计算细胞存活率。
细胞存活率=给药/对照
2.4 左金丸醇提物对细胞糖酵解的影响
2.4.1 左金丸醇提物对葡萄糖摄取的影响 取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于24孔板,培养24 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,加入左金丸醇提物(25、50、100 μg/mL),对照组加入不含药物的培养基,于5% CO2、37 ℃的恒温培养箱培养1 h。400×离心5 min,弃上清,加入葡萄糖混合物和左金丸醇提物(25、50、100 μg/mL),孵育30 min,PBS洗涤2次,采用荧光显微镜拍照,结果采用Image J软件分析。
2.4.2 左金丸醇提物对乳酸含量的影响 取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,培养12 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,加入左金丸醇提物(25、50、100 μg/mL),对照组加入不含药物的培养基,培养24 h后,收集细胞上清液,采用乳酸检测试剂盒检测细胞上清液中的乳酸含量。以蒸馏水作空白,于530 nm处测定值,并计算乳酸含量。
2.4.3 左金丸醇提物对ATP含量的影响 取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,培养12 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,加入左金丸醇提物(25、50、100 μg/mL),对照组加入不含药物的培养基,培养24 h后,加入200 μL ATP裂解液,于冰上裂解10 min,11 269×、4 ℃离心10 min,收集上清液,采用BCA蛋白定量试剂盒进行定量,采用酶标仪于562 nm处检测值,根据标准曲线计算每孔蛋白质量浓度,采用ATP检测试剂盒检测每单位细胞所产生的ATP,并计算ATP含量。
2.5 左金丸醇提物对细胞RTKN mRNA水平的影响
取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,培养12 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,加入左金丸醇提物(25、50、100 μg/mL),对照组加入不含药物的培养基,培养24 h。加入1 mL Trizol裂解液裂解细胞,收集细胞,加入200 μL氯仿剧烈振荡15 s,室温静置5 min后11 269×、4 ℃离心10 min;取400 μL上层水样层,加入等量异丙醇,室温静置10 min,11 269×、4 ℃离心10 min;弃上清,加入1 mL 75%乙醇洗涤沉淀,4402×、4 ℃离心5 min;室温晾干沉淀,采用逆转录试剂盒逆转录为cDNA。以为内参基因,qRT-PCR反应体系:SYBR Green 12.5 μL、水10 μL、cDNA产物1 μL、上下游引物各0.75 μL、总体积为25 μL。反应条件:95 ℃,10 min,循环1次;95 ℃,15 s,60 ℃,1 min,循环40次。上游引物序列:5’-AATCCCATCACCATCTTC-3’,下游引物序列:5’-AGGCTGTTGTCATACTTC-3’;上游引物序列:5’-GCCGCTGCTTACTATTGC-3’,下游引物序列:5’-GTGCTTCCCGACTTTCTG-3’。
2.6 左金丸醇提物对细胞RTKN蛋白表达的影响
取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,培养12 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,加入左金丸醇提物(25、50、100 μg/mL),对照组加入不含药物的培养基,培养24 h。以PBS洗涤2次,每孔加入200 μL含2%蛋白酶抑制剂的RIPA裂解液,于冰上裂解10 min;收集细胞,11 269×、4 ℃离心15 min,收集上清液;采用BCA蛋白定量试剂盒测定蛋白质量浓度,于95 ℃煮沸10 min进行蛋白变性。蛋白样品经10%聚丙烯酰胺凝胶电泳分离,电转至PVDF膜。加入5% BSA于37 ℃封闭1~2 h,TBST洗涤3次,每次10 min;分别加入GAPDH(1∶1000)、RTKN(1∶8000)抗体于4 ℃孵育过夜;TBST洗涤3次,加入HRP标记的山羊抗小鼠/兔IgG抗体(1∶1000),于室温孵育1 h;TBST洗涤3次,按ECL试剂盒说明书进行显影曝光。采用Image J软件对蛋白灰度值进行分析。
2.7 干扰RTKN后左金丸醇提物对细胞糖酵解的影响
取处于对数生长期的SGC-7901细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,培养24 h。分别加入10 μL shNC(对照短发夹RNA)或sh(短发夹RNA)慢病毒(sh 10-1、sh 11-1、sh 12-1序列分别为GCTGCTTACTATTGCTGTCAA、TGGC- AGCAGTGCAAGATGGAT、GAGCAATGTGCTCTT- CGCTGA),12 h后换成正常培养基,感染72 h后每孔加入嘌呤霉素(2 μg/mL)筛选细胞,3 d后再次加入嘌呤霉素,共重复3次,构建稳定干扰的胃癌细胞株。取处于对数生长期的SGC-7901细胞、shNC细胞和3组sh细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,接种于6孔板,24 h后收样,分别用qRT-PCR和Western blotting法检测细胞中mRNA和RTKN蛋白表达,筛选出干扰效率最高的sh11-1组细胞进行后续实验。
设置对照组、左金丸醇提物(50 μg/mL)组、sh(sh11-1)组、sh+左金丸醇提物组。对照组、左金丸醇提物组取处于对数生长期的SGC-7901细胞,sh组、sh+左金丸醇提物组取sh细胞,胰蛋白酶消化后吹打均匀制成单细胞悬液,以培养基将细胞密度调整为2.5×105个/mL,分别接种于6孔板,培养12 h。将培养液更换为含0.5% FBS的RPMI 1640培养基,除对照组和sh组加入不含药物的培养基,其余组加入50 μg/mL左金丸醇提物,检测葡萄糖摄取量、乳酸和ATP含量。
2.8 统计学分析

3 结果
3.1 左金丸醇提物对SGC-7901细胞活性的影响
如表1所示,与对照组比较,左金丸醇提物作用24、48、72 h后,细胞存活率显著降低(<0.001),呈时间、剂量相关性。提示左金丸醇提物对SGC-7901细胞增殖有显著的抑制作用。
3.2 左金丸醇提物对SGC-7901细胞糖酵解的影响
如图1所示,与对照组比较,不同质量浓度(25、50、100 μg/mL)左金丸醇提物组细胞的葡萄糖摄取、乳酸和ATP含量均显著降低(<0.01、0.001),呈剂量相关性。提示左金丸醇提物可显著抑制SGC-7901细胞的糖酵解水平。
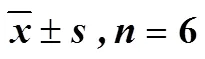
表1 左金丸醇提物对SGC-7901细胞活性的影响()
与同时间对照组比较:***<0.001
***< 0.001control group at same time
与对照组比较:**P<0.01 ***P<0.001
3.3 左金丸醇提物对SGC-7901细胞RTKN mRNA和RTKN蛋白表达的影响
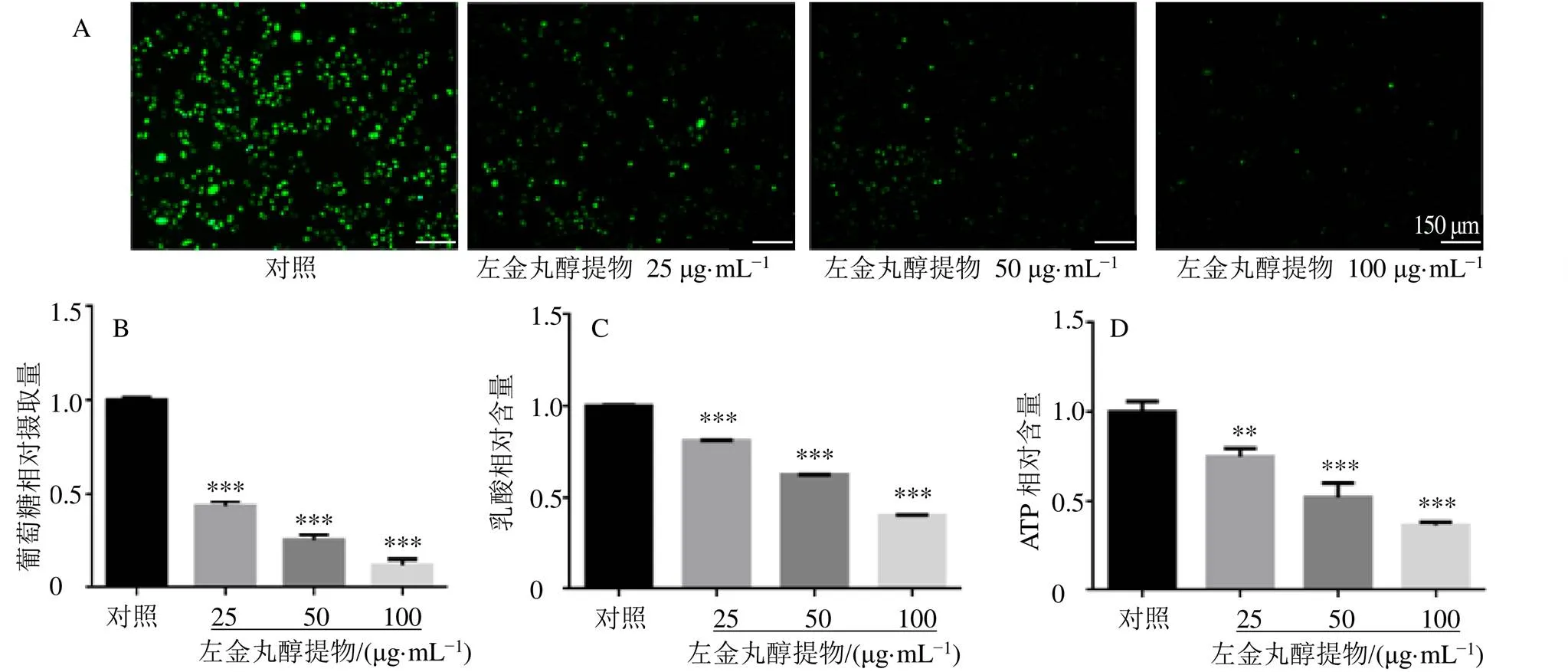
如图2所示,与对照组比较,不同质量浓度(25、50、100 μg/mL)左金丸醇提物组mRNA和RTKN蛋白表达显著降低(<0.001),呈剂量相关性。提示左金丸醇提物可显著下调SGC-7901细胞mRNA和RTKN蛋白表达。
3.4 干扰RTKN后左金丸醇提物对SGC-7901细胞糖酵解的影响
为了进一步探讨左金丸醇提物对胃癌细胞SGC-7901糖酵解水平的影响,采用sh慢病毒感染SGC-7901细胞,并采用qRT-PCR和Western blotting验证干扰效率,如图3-A、B所示。选取干扰效率最强的一个位点(sh 11-1)进行后续实验。
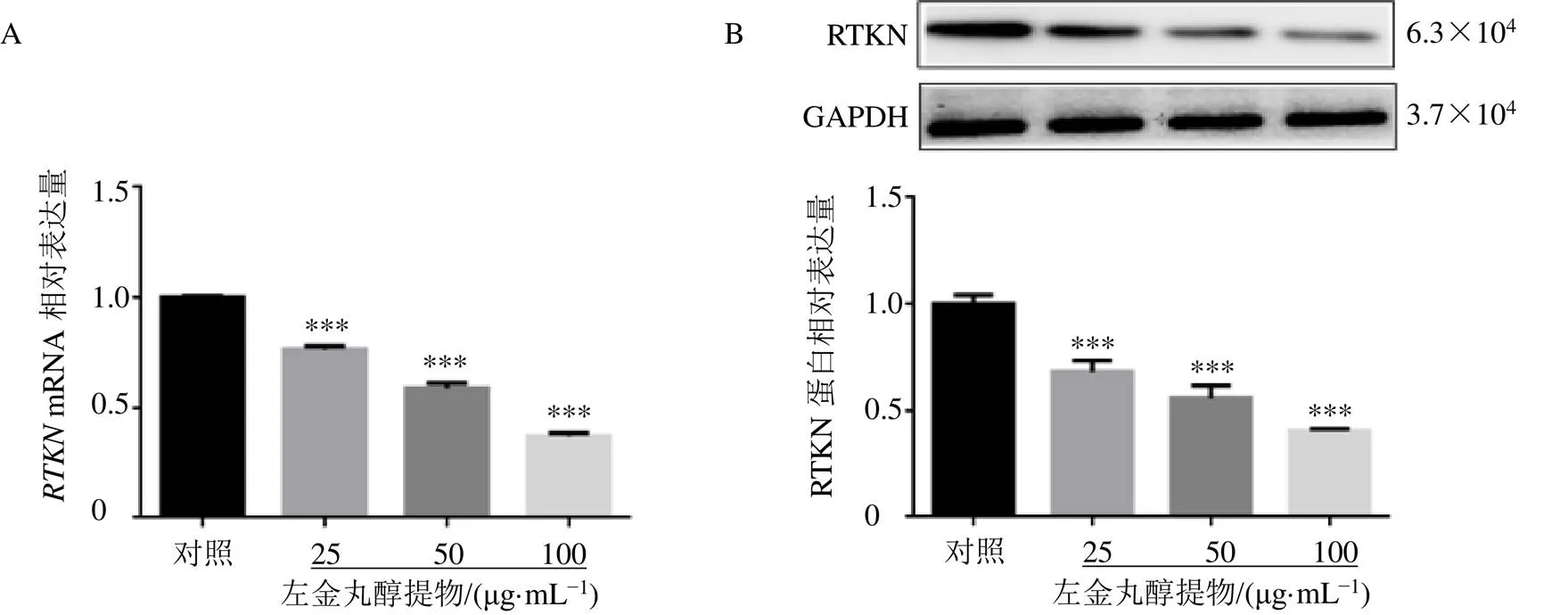
与对照组比较:***P<0.001

与对照组比较:***P<0.001
如图4所示,与对照组比较,sh组细胞葡萄糖摄取、乳酸和ATP含量均明显降低(<0.001);与sh组相比,左金丸醇提物+sh组葡萄糖摄取量、乳酸和ATP含量无明显差异,表明干扰抵消了左金丸醇提物对SGC-7901细胞糖酵解的抑制作用,提示左金丸醇提物通过下调mRNA和RTKN蛋白表达抑制SGC-7901细胞糖酵解。
4 讨论
目前,胃癌的治疗主要以外科手术为主,辅以化疗、靶向治疗、支持治疗,部分早期胃癌可内镜下切除。胃癌起病隐匿,多数患者确诊时已处于晚期,无法进行早期手术根治,且化疗药物不良反应严重[15-16]。中药复方具有多成分、多靶点的优势,临床上对肿瘤的疗效突出[17]。左金丸具有泻火、疏肝、和胃、止痛的功效,常用于治疗肝火犯胃、脘胁疼痛、口苦嘈杂、呕吐酸水、不喜热饮等症[18-20]。研究表明,左金丸有显著的抗肿瘤作用,可通过上调B淋巴细胞瘤-2基因相关X蛋白(Bcl-2 associated X protein,Bax)、B淋巴细胞瘤相关X蛋白(Bcl-2 assciated protein X,Bak)表达,同时下调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、B淋巴细胞瘤-xl(B-cell lymphoma-xl, Bcl-xl)蛋白表达,增加半胱氨酸蛋白酶-3(cystein-dependent aspartate- specefic programed 3,Caspase-3)、半胱氨酸蛋白酶-9(cystein-dependent aspartate-specefic programed 9,Caspase-9)的活性,诱导人肝癌细胞SMMC-7721、人肺癌细胞A549和人结肠癌细胞HCT-116线粒体调亡[21];左金丸可抑制SGC-7901细胞增殖[22]。本研究发现,左金丸醇提物可显著抑制SGC-7901细胞的增殖,且呈时间和剂量相关性,与文献报道一致。
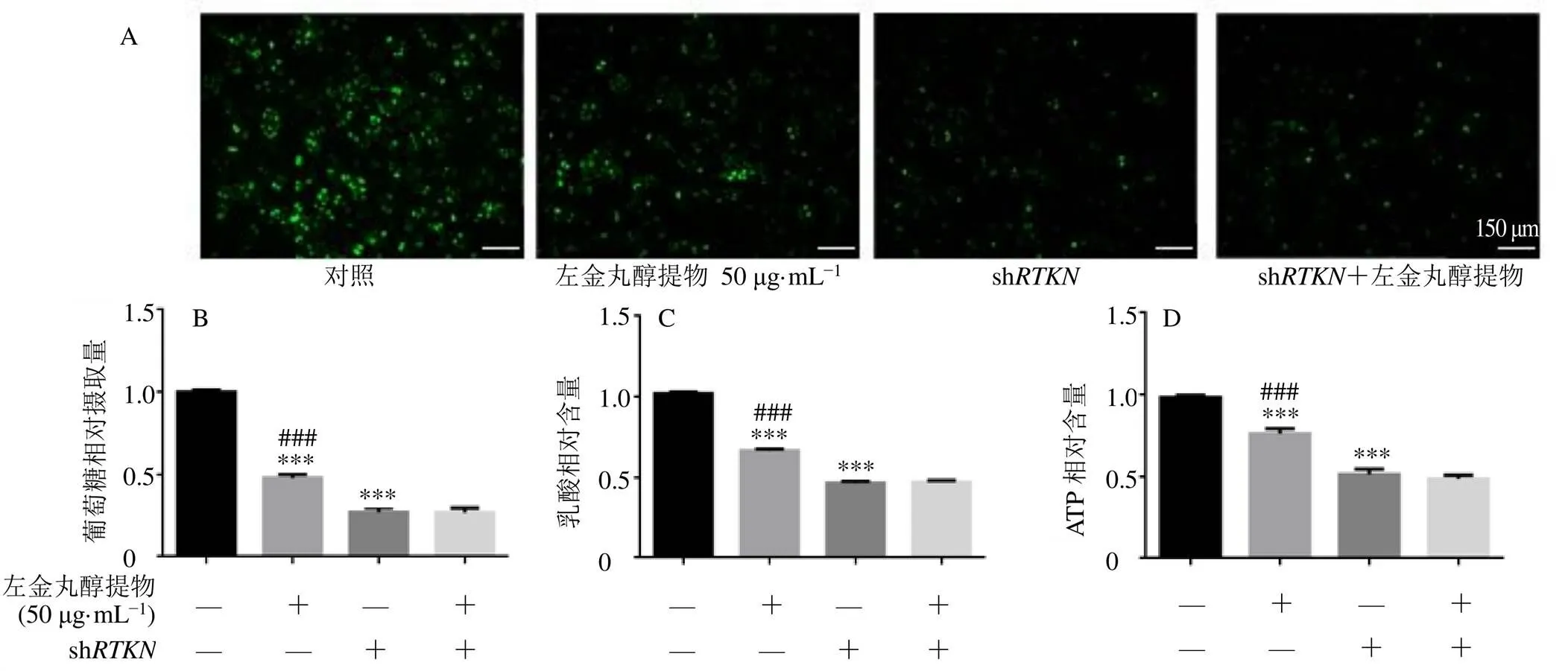
与对照组比较:***P<0.001;与shRTKN+左金丸醇提物组比较:###P<0.001
Warburg等[23]提出肿瘤细胞即使在氧气充足的情况下,依旧以糖酵解方式提供能量,这是肿瘤细胞维持生物学功能的重要机制。在无氧或缺氧条件下,细胞内葡萄糖部分降解为丙酮酸后,不再进行三羧酸循环,而在细胞质基质中合成乳酸,为细胞提供能量[24]。虽然此过程中产生的ATP含量低于有氧磷酸化反应,但肿瘤细胞中的糖酵解水平远高于正常细胞,且与正常细胞相比,肿瘤细胞即使在氧气充足的条件下,也优先通过糖酵解途径产生能量[25]。有氧糖酵解增强已成为肿瘤细胞重要的生物学标志[26]。研究表明,大多数恶性肿瘤表现为糖酵解活跃,抑制糖酵解可有效抑制肿瘤细胞的增殖[27-29]。本研究结果显示,左金丸醇提物显著抑制SGC-7901细胞的糖酵解,表现为降低葡萄糖摄取量、减少乳酸和ATP产量,呈剂量相关性。
RTKN在多种肿瘤如肝癌[9]、胃癌[10]、结直肠癌[11-12]中呈高表达状态。研究发现,干扰表达可降低细胞周期蛋白如细胞周期调节蛋白D1和人髓细胞增生原癌基因的表达,显著抑制肿瘤细胞增殖和细胞周期进程[30]。RTKN表达与肿瘤细胞的能量代谢有关。干扰后,SGC-7901细胞、MKN-45细胞乳酸和ATP含量显著降低[10]。本研究发现,左金丸醇提物显著降低SGC-7901细胞中mRNA和RTKN蛋白表达水平,呈剂量相关性。干扰后,SGC-7901细胞的葡萄糖摄取量、乳酸和ATP含量均显著降低,且抵消了左金丸醇提物对细胞糖酵解的抑制作用,表明左金丸醇提物通过下调mRNA和RTKN蛋白表达抑制SGC-7901细胞糖酵解。
综上所述,本研究发现左金丸醇提物能够通过下调mRNA和RTKN蛋白表达,从而发挥对SGC-7901细胞增殖和糖酵解的抑制作用。课题组后续将对左金丸醇提物抑制SGC-7901细胞糖酵解的具体机制进行深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Ferlay J, Soerjomataram I, Dikshit R,. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 [J]., 2015, 136(5): E359-E386.
[2] Feng R M, Zong Y N, Cao S M,. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics [J]., 2019, 39(1): 22-33.
[3] Mok T S, Wu Y L, Ahn M J,. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer [J]., 2017, 376(7): 629-640.
[4] 周祥羽, 邹忠杰. 左金丸化学成分及现代药理研究进展 [J]. 广东化工, 2017, 44(10): 89-90.
[5] 华晓东,芮菁,任变文. 左金丸对胃肠道的调节作用[J]. 药物评价研究, 2017, 40(2): 190-195.
[6] 戚笑笑.反左金丸抗肿瘤和抗转移的机制研究 [D]. 开封: 河南大学, 2015.
[7] Heasman S J, Ridley A J. Mammalian Rho GTPases: New insights into their functions fromstudies [J]., 2008, 9(9): 690-701.
[8] Zhou J J, Zhang Y J, Qi Y H,. MicroRNA-152 inhibits tumor cell growth by directly targeting RTKN in hepatocellular carcinoma [J]., 2017, 37(2): 1227-1234.
[9] Sun M Y, Zhang H, Tao J,. Expression and biological function of rhotekin in gastric cancer through regulating p53 pathway [J]., 2019, 11: 1069-1080.
[10] Li B, Chen P, Chang Y X,. Let-7a inhibits tumor cell growth and metastasis by directly targeting RTKN in human colon cancer [J]., 2016, 478(2): 739-745.
[11] Dong Y, Wei M H, Lu J G,. Long non-coding RNA HULC interacts with miR-613 to regulate colon cancer growth and metastasis through targeting RTKN [J]., 2019, 109: 2035-2042.
[12] Chen M, Bresnick A R, O'Connor K L. Coupling S100A4 to Rhotekin alters Rho signaling output in breast cancer cells [J]., 2013, 32(32): 3754-3764.
[13] Ito H, Morishita R, Nagata K. Functions of Rhotekin, an effector of Rho GTPase, and its binding partners in mammals [J]., 2018, 19(7): 2121-2130.
[14] Sun M Y, Wang D D, Sun J,. The Zuo Jin Wan Formula increases chemosensitivity of human primary gastric cancer cells by AKT mediated mitochondrial translocation of cofilin-1 [J]., 2019, 17(3): 198-208.
[15] 李加桩, 王凯冰, 郑红艳, 等. 胃癌分子靶向药物治疗的研究进展 [J]. 中国肿瘤, 2017, 26(4): 279-285.
[16] 黄海涛. 肿瘤诊断与化疗的纳米材料的研究及应用评价 [D]. 武汉: 华中科技大学, 2018.
[17] 朱元章, 张贵彪, 朱国福. 中药复方抗肿瘤机制研究进展 [J]. 中国实验方剂学杂志, 2017, 23(16): 227-234.
[18] 王向娟, 干红女. HPLC法测定左金丸中四种活性成分的含量研究 [J]. 浙江中医杂志, 2016, 51(7): 539-540.
[19] 许锋. 左金胃漂浮—生物黏附小丸制备关键技术与评价研究 [D]. 广州: 广州中医药大学, 2015.
[20] 张颖, 张兆旺. 均匀设计法优选左金丸方药的半仿生提取工艺 [J]. 中国中药杂志, 2008, 33(4): 466-469.
[21] 张金华, 李琦. 左金丸抗肿瘤机制的研究进展 [J]. 长春中医药大学学报, 2018, 34(3): 609-612.
[22] Peng Q X, Cai H B, Peng L J,. Extract of Zuojin Pill induces apoptosis of SGC-7901 cells via mitochondria- dependent pathway [J]., 2015, 21(11): 837-845.
[23] Warburg O, Wind F, Negelein E. The metabolism of tumors in the body [J]., 1927, 8(6): 519-530.
[24] Jiang B. Aerobic glycolysis and high level of lactate in cancer metabolism and microenvironment [J]., 2017, 4(1): 25-27.
[25] Pavlova N N, Thompson C B. The emerging hallmarks of cancer metabolism [J]., 2016, 23(1): 27-47.
[26] 艾子莺. K562/ADM细胞耐药性与有氧糖酵解的关系及双氢青蒿素诱导其铁死亡的研究 [D]. 兰州: 兰州大学, 2018.
[27] 石文静, 谭佳妮, 沈卫星, 等. 消癌解毒方含药血清对人结肠癌细胞增殖及糖酵解过程的影响 [J]. 中国实验方剂学杂志, 2017, 23(20): 120-125.
[28] 周永, 郑金英, 徐小华, 等. 抑制PKM2介导的糖酵解在蛇葡萄素抗乳腺癌增殖中的作用 [J]. 肿瘤代谢与营养电子杂志, 2019, 6(2): 236-241.
[29] 孙梦瑶, 王丹丹, 吴秋雪, 等. 左金丸对胃癌耐药细胞SGC-7901/DDP增殖和糖酵解的抑制作用 [J]. 上海中医药大学学报, 2019, 33(1): 71-75.
[30] Pang X, Li R, Shi D,. Knockdown of Rhotekin 2 expression suppresses proliferation and induces apoptosis in colon cancer cells [J]., 2017, 14(6): 8028-8034.
Mechanism of alcohol extract of Zuojin Pills on inhibiting glycolysis in SGC-7901 cells
WU Qiu-xue1, SUN Meng-yao1, XU Bo1, ZHANG Hui2, TANG Qing-feng1
1. Putuo Hospital, shanghai University of Traditional Chinese Medicine, Shanghai 200062, China 2. Shanghai University of Traditional Chinese Medicine, Shanghai 200135, China
To investigate the effect of Zuojin Pills (左金丸) alcohol extract on proliferation and glycolysis of gastric cancer SGC-7901 cells by downregulating Rhotekin (RTKN).CCK-8 was used to evaluate the effect of Zuojin Pills alcohol extract (10, 25, 50, 100, 200 μg/mL) on cell viability of SGC-7901 cell. Glucose uptake, lactate and ATP content of SGC-7901 cells were detected to evaluate the effects of Zuojin Pills alcohol extract on glycolysis of SGC-7901 cells. qRT-PCR and Western blotting were used to detect glycolysis related protein RTKN expression. Moreover,shRNA were transfected into SGC-7901 cells to knockdownand the effects of Zuojin Pills alcohol extract on glucose uptake, lactate and ATP content were evaluated.Zuojin Pills alcohol extract exhibited a dose- and time-dependent anti-proliferative effect on SGC-7901 cells (< 0.001). In addition, glucose uptake, lactate and ATP content of SGC-7901 cells were significantly decreased (< 0.01, 0.001) with Zuojin Pills alcohol extract treatment. Zuojin Pills alcohol extract significantly reducedmRNA and RTKN protein expression in SGC-7901 cells (< 0.001). However,knockdown significantly attenuated the inhibitory effect of Zuojin Pills alcohol extract on glycolysis of SGC-7901 cells (< 0.001).Zuojin Pills alcohol extract significantly inhibited the proliferation and glycolysis of SGC-7901 cells, which was related to the downregulation of RTKN.
Zuojin Pills; gastric cancer; cell proliferation; glycolysis; Rhotekin
R285.5
A
0253 - 2670(2021)01 - 0145 -07
10.7501/j.issn.0253-2670.2021.01.018
2020-08-07
国家自然科学基金资助项目(81973808);上海市自然科学基金资助项目(19ZR1447800);上海中医药大学预算内项目(2019LK038)
吴秋雪,女,硕士研究生,主要从事中西医结合防治肿瘤研究。E-mail: 13376221807@163.com
汤庆丰,男,硕士生导师,副主任技师。E-mail: tangqingfeng126@126.com
张 辉,男,硕士生导师,研究员。E-mail: zhanghuiman@126.com
[责任编辑 李亚楠]
