基于斑马鱼模型的补骨脂毒性相关成分群的高效辨识研究
2021-01-06李佳妍刘欣欣李彦东石子琪韦英杰
李佳妍,刘欣欣,宁 青,李彦东,石子琪,韦英杰*
基于斑马鱼模型的补骨脂毒性相关成分群的高效辨识研究
李佳妍1, 2,刘欣欣1, 2,宁 青1, 2,李彦东2,石子琪1, 2,韦英杰1, 2*
1. 南京中医药大学第三临床医学院,江苏 南京 210028 2. 江苏省中医药研究院,国家中医药管理局中药释药系统重点研究室,江苏 南京 210028
基于斑马鱼模型结合相关分析高效辨识补骨脂毒性成分群。采用高效液相色谱法测定7个产地18个批次补骨脂中4个香豆素类、4个黄酮类和补骨脂酚的含量。以斑马鱼(6 dpf)死亡率、脏器中毒形态、半数致死浓度(lethal concentration 50,LC50)值为指标,采用斑马鱼模型评价18个批次补骨脂水煎液的毒性。将各类成分的含量分别与斑马鱼LC50值进行相关分析,辨识毒性成分群,并通过对代表成分的斑马鱼毒性评价进行验证。不同产地18个批次补骨脂水煎液中香豆素类、黄酮类、补骨脂酚的含量差异较大,4个香豆素类成分、黄酮成分(新补骨脂异黄酮)和补骨脂酚含量最大值分别是最小值的3.47~5.60、5.30、6.47倍。斑马鱼毒性评价结果显示18个批次补骨脂水煎液对斑马鱼毒性差异较大,其中LC50最大值是最小值的7.2倍。毒性与成分含量相关分析结果表明,斑马鱼毒性与黄酮类成分、补骨脂酚的相关性较好(2分别为0.623 4、0.587 8),与香豆素类成分的相关性较低(2为0.187 7)。各类代表成分的毒性评价结果表明,补骨脂酚和3个黄酮成分(补骨脂甲素、新补骨脂异黄酮、补骨脂乙素)是补骨脂致毒的关键成分,香豆素类成分的安全性相对较好。斑马鱼模型可高效、灵敏反映不同批次补骨脂毒性的差异,通过毒性与成分含量的相关分析,能够快速发现补骨脂中毒性相关成分群,为从中药复杂体系快速发现毒性及其相关物质提供依据。
补骨脂;毒性成分;斑马鱼;相关分析;补骨脂甲素;新补骨脂异黄酮;补骨脂乙素
近年来,补骨脂及其复方的肝毒性作用受到广泛关注[1-2]。国家药品不良反应监测数据分析结果显示,服用含补骨脂的仙灵骨葆口服制剂具有肝损伤风险,患者临床表现为乏力、食欲不振、恶心、上腹胀痛、尿黄、目黄、皮肤黄染等,并伴有谷丙酸氨基转移酶、天门冬氨酸氨基转移酶、胆红素等升高,严重者可出现肝衰竭。补骨脂可能会导致胆汁瘀积性肝损伤,Wang等[3]研究表明补骨脂可能通过抑制7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、胆盐输出泵(bile saltexport pump,BSEP)、细胞色素P450(cytochrome P450,CYP450)等胆汁运输相关蛋白的表达,从而诱导大鼠胆汁瘀积性肝损伤。补骨脂化学成分复杂,目前已从中分离并鉴定出117个化合物,包括香豆素类、黄酮类、单萜酚类、苯并呋喃类等[4-5]。现有研究仅报道了补骨脂少数成分(如补骨脂素、异补骨脂素、补骨脂甲素、补骨脂酚等)具有明显的肝肾毒性[6-9],而其他成分的安全性尚不明确。因此,如何从复杂体系中快速辨识毒性相关成分是重点和难点问题。
传统方法常用化学分离结合毒性评价追踪毒性成分。化学分离纯化成分耗时长、成本高、工作强度大,且获得的化合物量少,常不能满足评价。现有的毒性评价模型如哺乳动物模型不能进行规模化筛选,具耗时长、工作强度大、样品用量大等缺点;体外细胞模型作用环节相对单一,不能体现在体实验的综合效果[10-11]。因此,不需进行化学成分分离,且能够在体高效快速锁定毒性目标成分群尤为重要。斑马鱼是一种小型热带脊椎动物,其基因组与人类基因组的同源性约为87%。斑马鱼发育快、个体小、繁殖多、胚胎透明、实验周期短,可在微板中实时、动态观察药物的毒性作用[12-15],是近年来高效筛选药物毒性的理想模式动物模型[12,16]。本研究以补骨脂为对象,采用斑马鱼模型评价7个产地18批补骨脂的毒性,并采用HPLC法测定补骨脂中香豆素类、黄酮类、补骨脂酚含量,进一步分析其毒性与成分的相关性,从而锁定补骨脂毒性相关成分群,通过对代表成分的毒性评价进行验证。
1 材料与仪器
1.1 动物
野生型(Tuebigen系后代)斑马鱼,6月龄,购于南京尧顺禹生物科技有限公司。成鱼在(28.0±0.5)℃的水中自由交配繁殖鱼卵,养殖与繁殖方法参照文献方法[17]。
1.2 药材
补骨脂购自不同药店或饮片公司(表1),经江苏省中医药研究院韦英杰研究员鉴定为豆科植物补骨脂L. 的干燥成熟果实。
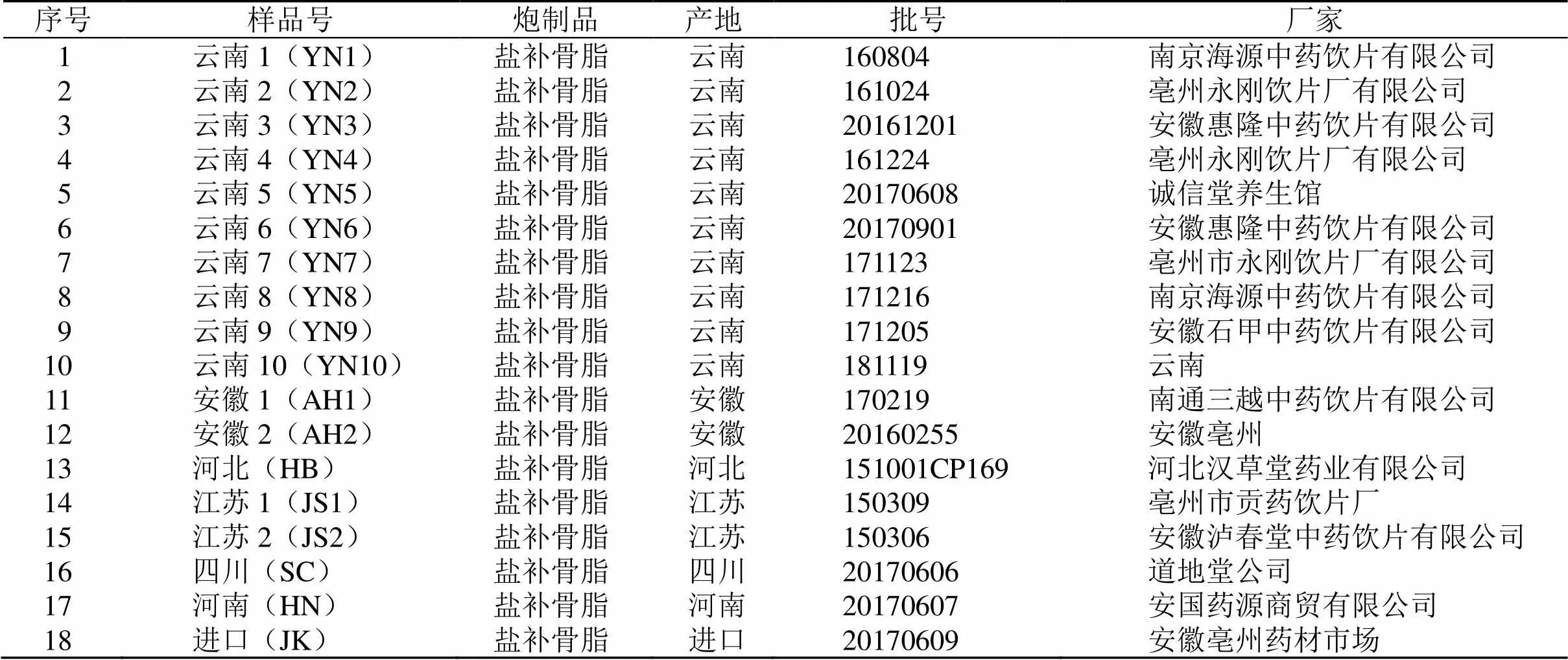
表1 补骨脂样品信息
1.3 药品与试剂
补骨脂素(psoralen,批号110739-201617)、异补骨脂素(isopsoralen,IPS,批号110738-201614)对照品购自中国食品药品检定研究院,质量分数均为99.7%;补骨脂苷(psoralenoside,批号180526)、异补骨脂苷(isopsoralenoside,IPSS,批号180524)对照品购自上海源叶生物科技有限公司,质量分数均大于98%;新补骨脂异黄酮(neobavaisoflavone,NBIF,批号DST170522-055)、4′--甲基补骨脂查耳酮(4′--methylbrousso chalcone,BCC,批号DST170522-052)、corylifol A(CA,批号DST170522-073)对照品购自成都德思特生物技术有限公司,质量分数均大于98%;补骨脂甲素(bavachin,BC,又名补骨脂二氢黄酮,批号JZ17031802)、补骨脂乙素(isobavachalcone,IBCC,又名异补骨脂查耳酮,批号JZ1703180)、补骨脂二氢黄酮甲醚(bavachinin A,BCin,批号JZ16071904)、补骨脂定(psoralidin,批号JZ16110406)、补骨脂宁(corylin,又名补骨脂异黄酮,批号JZ16091204)、补骨脂酚(bakuchiol,批号JZ16092103)对照品购自南京景竹生物科技有限公司,质量分数均大于98%;甲醇(批号19085170,色谱纯)、乙腈(批号19015157,色谱纯)购自美国TEDIA公司;甲酸(批号G1826012,色谱纯)购自阿拉丁试剂有限公司;其他试剂均为分析纯。
1.4 仪器
ECLIPSE E100显微镜(日本Nikon公司);Stylus TG-4相机(日本Olympus公司);生化培养箱SPX-80(宁波海曙赛褔实验仪器厂);1260型系列高效液相色谱仪(美国Agilent公司);KQ3200B超声波清洗器(昆山市超声仪器有限公司);AB135-S分析天平(瑞士Mettler Toledo公司)。
2 方法
2.1 不同产地补骨脂中香豆素类、黄酮类成分、补骨脂酚的HPLC分析
2.1.1 色谱条件 Agilent Zorbax C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为0.1%甲酸,B为乙腈,梯度洗脱:0 min,90% A;0~30 min,90%~50% A;30~45 min,50%~40% A;45~55 min,40%~20% A;柱温25 ℃;体积流量1.0 mL/min;检测波长246 nm;运行时间55 min;进样量10 μL。分析不同产地18个批次补骨脂的4个代表香豆素成分补骨脂苷、IPSS、补骨脂素、IPS;4个代表黄酮成分NBIF、BC、BCin、CA和单萜酚补骨脂酚的含量。
2.1.2 对照品溶液配制与线性关系考察 取补骨脂苷、IPSS、补骨脂素、IPS、NBIF、BC、BCin、CA、补骨脂酚适量,精密称定,加80%甲醇或甲醇分别配制成质量浓度为406.26、200.00、95.00、216.00、192.60、243.20、214.52、291.52、600.00 μg/mL的溶液,采用2倍稀释法分别进行稀释,进样分析,以峰面积积分值为纵坐标(),质量浓度为横坐标(),进行线性回归,结果见表2,各成分在质量浓度范围内线性关系良好。
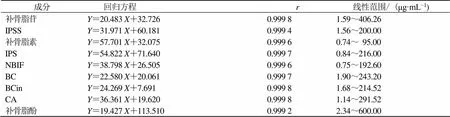
表2 9种成分的回归方程
2.1.3 供试品溶液配制与测定 称取不同产地的补骨脂10 g,分别加10倍量水煎煮2次,每次0.5 h,合并煎液,滤过,滤液加纯水至200 mL,调整至药材质量浓度为50 mg/mL。取400 μL溶液,干燥得到补骨脂水煎液干粉(相当于20 mg生药)。取补骨脂水煎液干粉适量,置2 mL量瓶中,加80%甲醇溶解并定容,0.45 µm微孔滤膜滤过,取续滤液,进样分析,记录各成分峰面积,外标法计算含量。
2.2 基于斑马鱼模型评价补骨脂的安全性
2.2.1 药物配制 取补骨脂水煎液干粉,用培养基配制成不同质量浓度(50、100、300、500、750、1000 µg/mL)的溶液。
2.2.2 分组与给药 培养基由5 mmol/L NaCl、0.17 mmol/L KCl、0.33 mmol/L CaCl2、0.33 mmol/L MgSO4组成。斑马鱼胚胎由斑马鱼成鱼自然交配产生,将胚胎放置培养基中,于28 ℃培养箱中培养24 h。取受精后(days post fertilization,dpf)1 d的斑马鱼健康胚胎置24孔板中,8个/孔,16个/组,设置对照组和补骨脂(50、100、300、500、750、1000 µg/mL)组。对照组加入2 mL培养基,给药组加入2 mL不同质量浓度的补骨脂溶液。每天计数斑马鱼死亡数量,死亡的斑马鱼及时捞出并记录,于显微镜下观察斑马鱼的形态,于3~6 dpf拍照。
2.2.3 毒性与成分含量关联的相关分析 采用SPSS 16.0软件计算6 dpf斑马鱼半数死亡浓度(lethal concentration 50,LC50)。将不同产地补骨脂的LC50值与其香豆素类、黄酮类、补骨脂酚含量进行相关分析,计算相关系数。
2.2.4 相关分析辨识毒性成分群的安全性验证采用斑马鱼模型评价4个香豆素类、7个黄酮类成分、PD、补骨脂酚的安全性,并与相关分析结果进行比对、验证。
3 结果
3.1 不同产地补骨脂水煎液中代表性成分的含量分析
采用HPLC法分析补骨脂水煎液中补骨脂苷、IPSS、补骨脂素、IPS、NBIF、BC、BCin、CA、补骨脂酚,如图1所示。用外标法计算不同产地共18批补骨脂水煎液中各成分的含量及平均值,以各成分含量均值占总和的百分比作为各成分的平均含量,结果见表3,补骨脂水煎液以香豆素类成分为主,4个成分平均质量分数之和为91.32%,其中补骨脂苷、IPSS、补骨脂素、IPS的质量分数分别为7.36~25.58、4.76~21.25、0.65~3.51、0.41~2.32 mg/g,不同产地批次质量分数差异较大,最大值是最小值的3.47~5.60倍;补骨脂酚质量分数次之(0.68~4.40 mg/g),平均质量分数为6.36%,不同产地批次最大值是最小值的6.47倍;黄酮类成分最少,NBIF、BC、BCin、CA的平均质量分数之和为2.33%,其质量分数分别为0.16~0.84、0~0.47、0~0.36、0 mg/g。
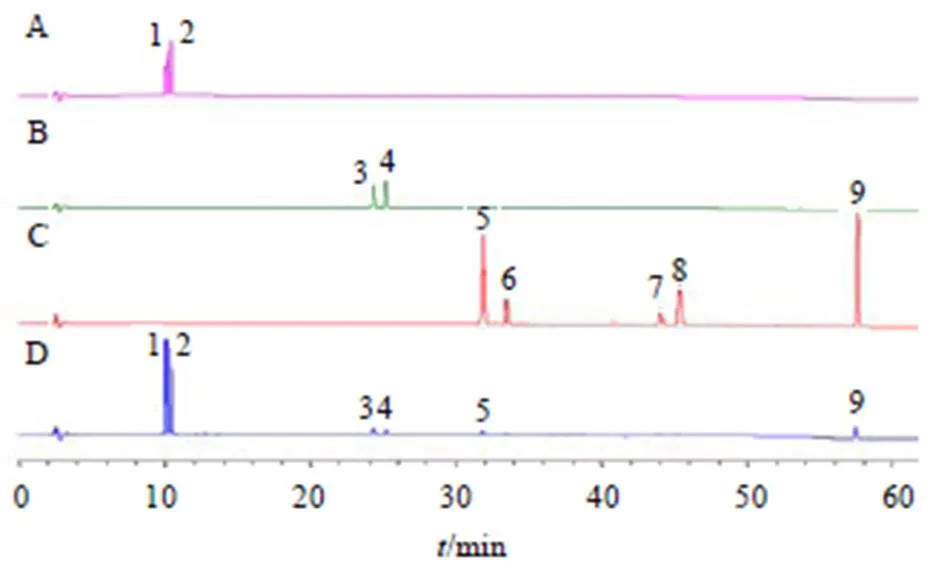
1-补骨脂苷 2-IPSS 3-补骨脂素 4-IPS 5-NBIF 6-BC 7-BCin 8-CA 9-补骨脂酚
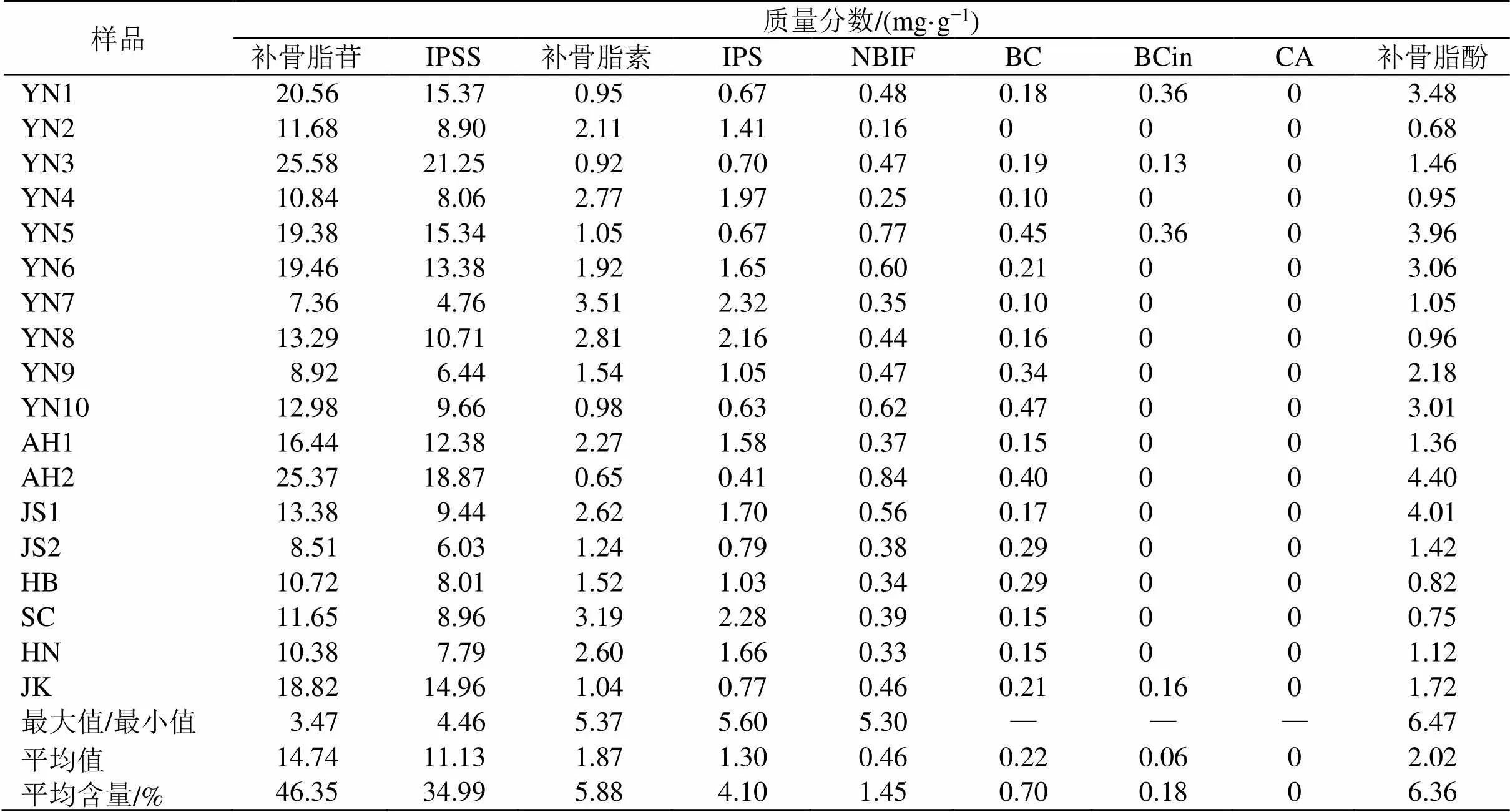
表3 不同产地补骨脂水煎液代表成分质量分数
3.2 不同产地补骨脂水煎液对斑马鱼胚胎/幼鱼毒性的影响
3.2.1 斑马鱼形态检视结果 斑马鱼受精3 dpf后孵化成幼鱼,各脏器发育基本完全,鱼体透明,在载玻片上易侧卧,显微镜下检视脏器形态清楚、直观。将3 dpf斑马鱼胚胎或幼鱼进行显微镜检视并拍照,结果见图2,与对照组相比,18批补骨脂给药组呈现不同程度的脏器中毒现象。其中,轻度中毒的斑马鱼表现出心胞及卵黄囊微肿大的现象;中度中毒的斑马鱼出现心胞肿大伴随充血、卵黄囊肿大伴随发黑、且身体出现微弯曲等畸形特征;重度中毒的斑马鱼畸形程度更加明显,一般会出现脊柱、尾部弯曲,色素沉淀减小,心率不稳,眼睛变小,身体变短;少数高剂量组还表现出幼鱼出膜晚或不出膜等现象。

蓝色箭头:心胞;红色箭头:卵黄囊;标尺:1 mm
由表4可知,补骨脂水煎液致斑马鱼幼鱼的中毒质量浓度为50~1000 µg/mL。不同产地、批次的补骨脂致斑马鱼中毒的质量浓度不同,毒性差异较大(HB组致斑马鱼中毒的质量浓度约为JK、YN5、JS1组的20倍)。JK、YN5、JS1、YN4组致斑马鱼中毒的质量浓度为50~100 µg/mL,毒性较大;JS2、AH2、YN6、YN10、YN3、YN1、YN8、AH1组致斑马鱼中毒的质量浓度为300~500 µg/mL,毒性次之;HN、SC、YN7、YN2、YN9、HB致斑马鱼中毒的质量浓度为750~1000 µg/mL,毒性较小。

表4 不同产地补骨脂水煎液对斑马鱼幼鱼(3 dpf) 的畸形特征和中毒质量浓度的影响
A:卵黄囊肿胀及发黑 B:心胞肿大 C:心胞充血 D:脊柱、尾部弯曲 E:眼睛及身体变浅 F:眼睛变小 G:出现未孵化现象 H:身体变短
A: Swelling and darkening of the yolk sac B: Enlarged heart C: Congestive pericardium D: Spine and tail bending E: Reduced pigmentation F: Eyes become smaller G: Embryos appear unhatched H: Zebrafish body shortened
3.2.2 不同产地补骨脂水煎液对斑马鱼死亡率的影响 如图3所示,斑马鱼的死亡率与补骨脂质量浓度和作用时间密切相关。死亡率小于20%的药物浓度为安全浓度[18],根据死亡率曲线,计算出斑马鱼死亡率达20%时各批次的补骨脂质量浓度(LC20),如图4所示,补骨脂LC20(µg/mL)由小到大依次为136.9(YN5)、158.3(YN10)、241.5(AH2)、246.5(YN1)、279.0(YN6)、315.6(YN3)、318.9(YN7)、328.0(AH1)、336.9(JS2)、367.2(JK)、383.8(JS1)、479.0(HN)、481.6(YN8)、504.1(YN4)、541.5(HB)、638.3(SC)、694.2(YN9)、774.7(YN2)。表明不同产地或同一产地不同批次的补骨脂对斑马鱼安全用药的质量浓度差异较大,最大值(YN2)是最小值(YN5)的5.7倍。
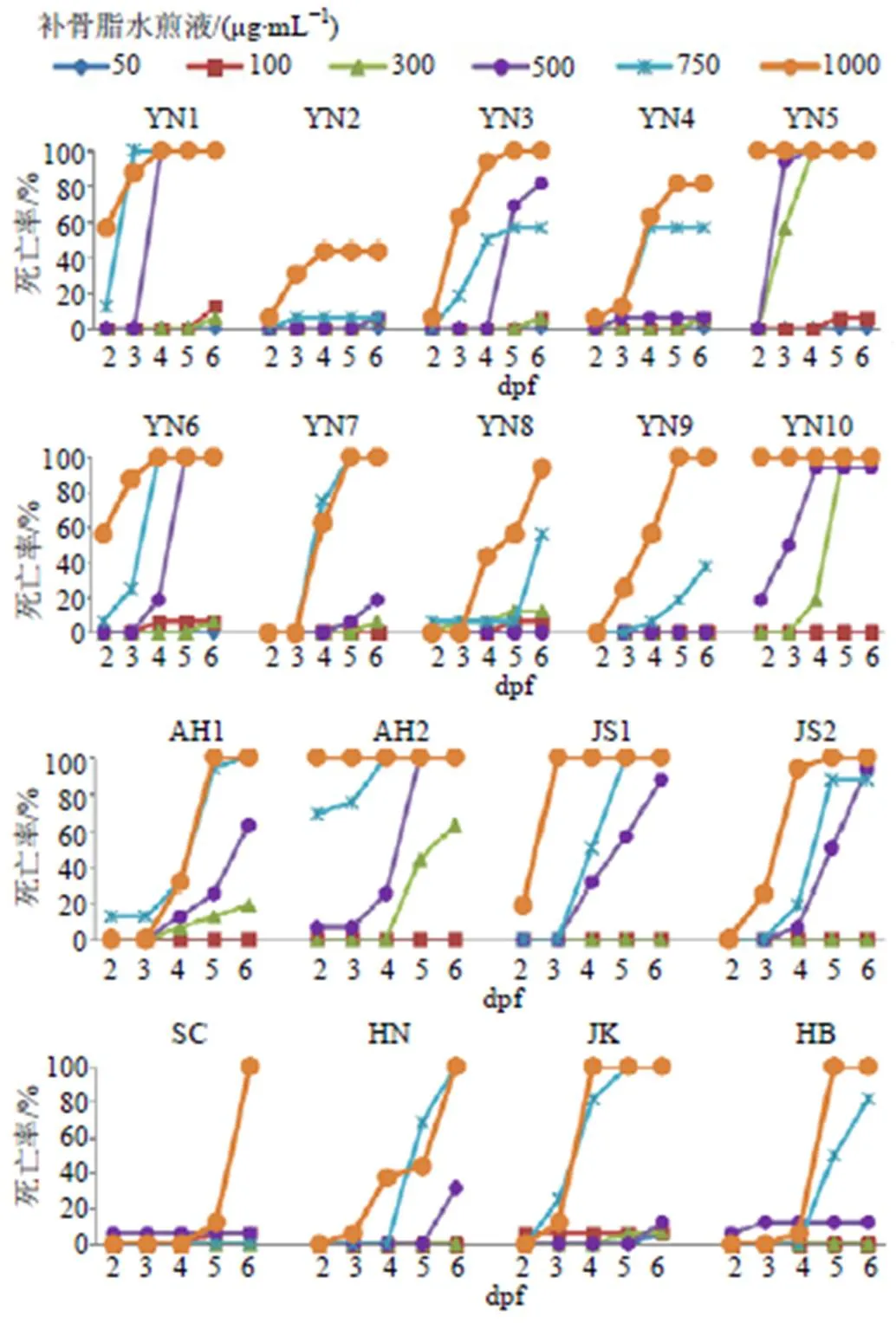
图3 不同产地补骨脂水煎液对斑马鱼(2~6 dpf) 死亡率的影响
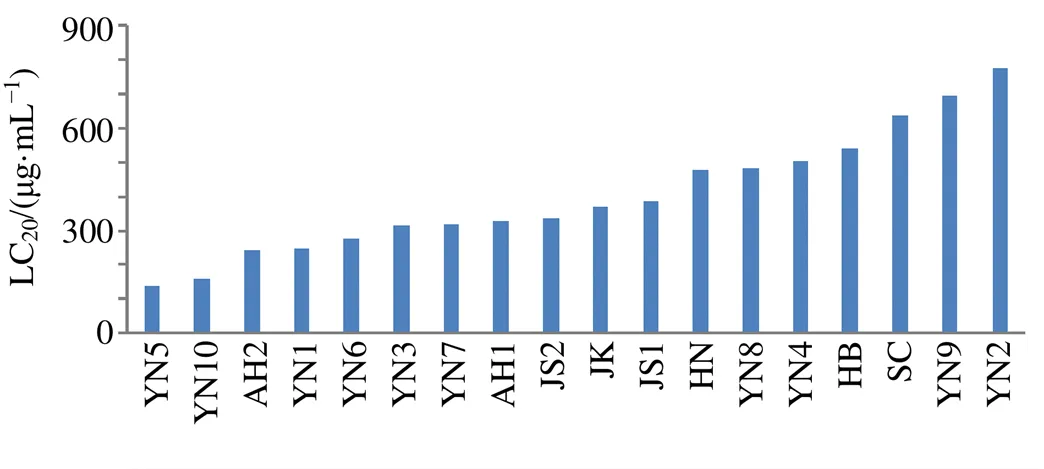
图4 不同产地补骨脂水煎液对斑马鱼(6 dpf)的LC20
3.2.3 不同产地补骨脂对斑马鱼的LC50补骨脂水煎液对斑马鱼(6 dpf)的LC50越小,其致鱼中毒的药物质量浓度越低、毒性越大。如图5所示,不同产地、批次补骨脂水煎液对斑马鱼(6 dpf)LC50差异较大(173.2~1 242.0 µg/mL),最大值(YN2)是最小值(YN5)的7.2倍,且同为云南产地。表明不同产地和同为云南产地不同批次的补骨脂致鱼毒性差异较大。5个批次(YN5、YN10、AH2、YN1、YN6)的LC50值均小于400 µg/mL,毒性较大;7个批次(JS1、AH1、JS2、YN7、YN3、HN、JK)的LC50值为400~600 µg/mL,毒性次之;6个批次(HB、YN8、YN4、YN9、SC、YN2)的LC50值为600~1000 µg/mL,毒性较小,与上述LC20结果一致。
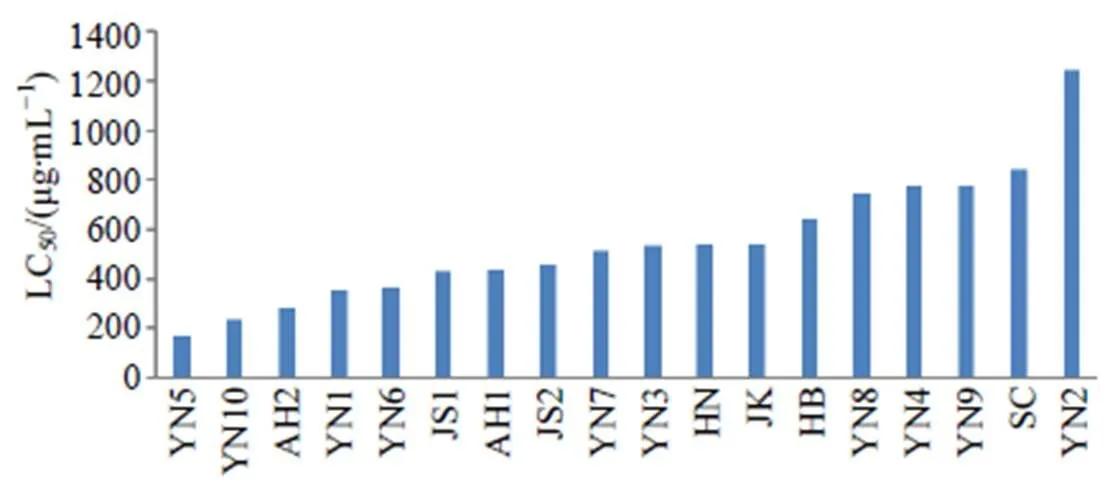
图5 不同产地补骨脂水煎液对斑马鱼(6 dpf)的LC50
3.2.4 补骨脂水煎液毒性与其成分含量的相关分析辨识毒性成分群的结果 分别将18个批次补骨脂水煎液中香豆素类成分含量(4个香豆素代表成分含量之和)、黄酮类成分含量(3个黄酮代表成分含量之和)、补骨脂酚含量与斑马鱼(6 dpf)的LC50值进行相关分析,结果如图6所示,黄酮类成分、补骨脂酚与斑马鱼毒性相关性较好(R分别为0.623 4、0.587 8);香豆素类成分的相关性相对较差(2=0.187 7),提示补骨脂水煎液中的毒性可能主要由黄酮类成分和补骨脂酚引起。

图6 不同产地、批次补骨脂水煎液中各类成分含量与斑马鱼毒性的相关性分析
3.2.5 补骨脂药材中香豆素类代表成分、黄酮类代表成分和补骨脂酚对斑马鱼的毒性结果 基于斑马鱼模型评价补骨脂药材中4个主要香豆素成分、7个黄酮成分、内酯类补骨脂定和单萜酚补骨脂酚的安全性,采用统计学软件SPSS 16.0计算斑马鱼(6 dpf)LC50值,参考斑马鱼毒性评价量表[18],结果如图7所示,LC50值最小即毒性最大的补骨脂酚为高毒成分,其LC50值为0.74 µg/mL,在0.1~1.0 µg/mL;3个黄酮成分BC、NBIF、IBCC的LC50值在1~10 µg/mL,是中等毒性物质;其他黄酮类成分如BCin、BCC,香豆素类成分如IPS、补骨脂素,毒性次之,LC50值为补骨脂酚的22~39倍,在10~100 µg/mL,是轻微毒性物质;补骨脂香豆素糖苷(补骨脂苷、IPSS)、补骨脂定、补骨脂宁、CA安全性最好,LC50值大于100 µg/mL,为补骨脂酚的130~185倍,为实际无毒物质。表明补骨脂酚和3个主要黄酮(BC、NBIF、IBCC)是补骨脂致毒的关键成分,香豆素及其糖苷类成分安全性相对较好,与上述相关分析结论一致。
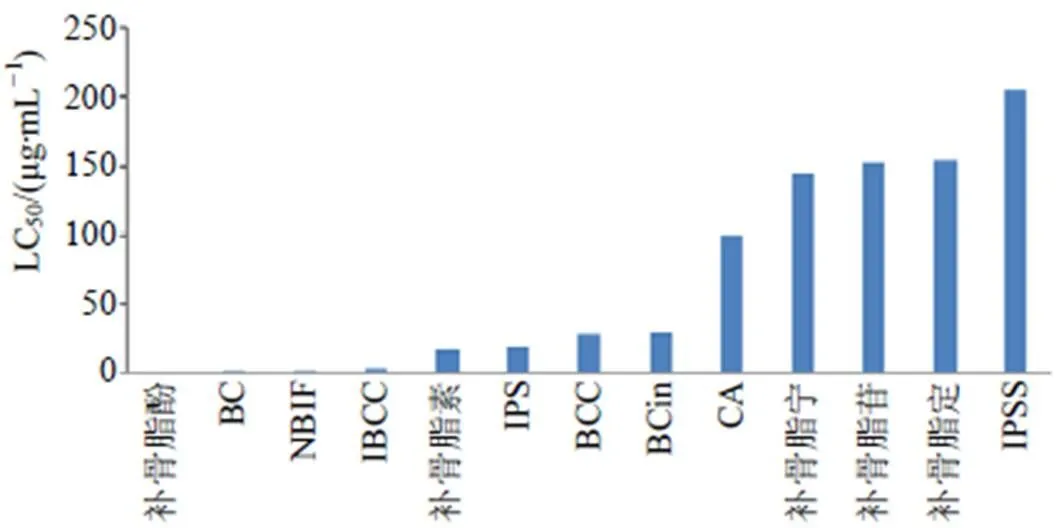
图7 补骨脂药材中13个成分对斑马鱼(6 dpf)的LC50
4 讨论
本研究针对中药复杂体系毒性物质发现的难点问题,通过斑马鱼高效评价毒性与成分含量进行相关分析,以高效辨识毒性成分群,从而克服传统化学分离先导的毒性追踪低效、高成本的缺陷。斑马幼鱼毒性评价在24孔板中进行,实验周期为6 d,溶液暴露的给药方式简单易行,可批量进行,鱼体透明,脏器形态变化可在显微镜下实时动态观察。补骨脂致斑马鱼(3 dpf)出现卵黄囊吸收延迟、肿大或变黑,提示与肝毒性相关,与文献中补骨脂对人和小鼠造成肝损伤的结论一致[19-22];补骨脂致鱼心胞肿大、充血,提示具一定心脏毒性,目前尚未见相关报道,有待进一步研究。补骨脂可致鱼发育明显迟缓,出现头部较小、体长较短或出现脊柱与尾部弯曲等畸形特征。鱼死亡率和LC50值可客观反映毒性大小,结果表明不同产地或同一产地不同批次补骨脂的毒性差异较大。补骨脂毒性由大到小即LC50值(173.2~1 242.0 µg/mL)由小到大分别为YN5>YN10>AH2>YN1>YN6>JS1>AH1>JS2>YN7>YN3>HN>JK>HB>YN8>YN4>YN9>SC>YN2。
不同产地或同一产地不同批次补骨脂的香豆素类成分、黄酮类成分、补骨脂酚的含量差异均较大,各类代表成分含量之和的最大值是最小值的3.47~6.47倍。毒性量化指标LC50值与成分含量的相关分析结果表明,斑马鱼毒性与黄酮类成分和补骨脂酚呈强相关(分别为0.789 6、0.766 7),与香豆素类成分呈弱相关(为0.433 2)。各类代表成分的毒性评价结果与相关分析一致:补骨脂酚为高毒成分,3个黄酮成分(BC、NBIF、IBCC)为中等毒性成分,提示这4个成分是补骨脂致毒的关键成分。本研究中的3个关键毒性成分(BC、NBIF、补骨脂酚)含量与毒性密切相关,毒性较大的6个批次(YN5、YN10、AH2、YN1、YN6、JS1)补骨脂水煎液中BC、NBIF、补骨脂酚及三者含量之和分别为0.17~0.47、0.48~0.84、3.01~4.40、3.87~5.64 mg/g;毒性次之的6个批次(AH1、JS2、YN7、YN3、HN、JK)补骨脂BC、NBIF、补骨脂酚及三者含量之和降低,分别为0.10~0.29、0.33~0.47、1.05~1.72、1.50~2.39 mg/g;安全性较好的6个批次(HB、YN8、YN4、YN9、SC、YN2)补骨脂BC、NBIF、补骨脂酚及三者含量之和含量进一步降低,分别为0~0.34、0.16~0.47、0.68~2.18、0.84~2.99 mg/g。提示监测关键致毒成分含量可初步推测补骨脂毒性大小,对临床安全、合理用药具有指导意义。
综上,斑马鱼模型可高效评价补骨脂毒性,并可进行量化分级,通过毒性差异与成分差异的相关分析,实现快速辨识补骨脂毒性相关成分群,突破化学分离先导的低效、高成本毒性评价的制约,为早期快速发现中药复杂体系的毒性相关物质提供简单、高效、低成本方法。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家食品药品监督管理局. 警惕仙灵骨葆口服制剂引起的肝损伤风险[J]. 上海医药, 2017, 38(1): 80.
[2] 国家食品药品监督管理局. 警惕壮骨关节丸引起的肝损害[J]. 中国社区医师, 2009, 25(8): 21.
[3] Wang Y, Zhang H, Jiang J M,Hepatotoxicity induced by psoralen and isopsoralen from: Wistar rats are more vulnerable than ICR mice [J]., 2019, 125: 133-140.
[4] 谭鹏, 许莉, 牛明. 一测多评法同时测定补骨脂中16种化学成分的含量[J]. 中草药, 2019, 50(16): 3937-3946.
[5] 吴疆, 魏巍, 袁永兵. 补骨脂的化学成分和药理作用研究进展 [J]. 药物评价研究, 2011, 34(3): 217-219.
[6] Yu Y, Yu R, Men W,. Psoralen induces hepatic toxicity through PERK and ATF6 related ER stress pathways in HepG2 cells [J]., 2020, 30(1): 39-47.
[7] Zhang Y, Zhang Y, Li J,. The role of hepatic antioxidant capacity and hepatobiliary transporter in liver injury induced by isopsoralen in zebrafish larvae [J]., 2019, 38(1): 36-44.
[8] Song L, Yu B, Yang L,. The mechanism of psoralen and isopsoralen hepatotoxicity as revealed by hepatic gene expression profiling in SD rats [J]., 2019, 125(6): 527-535.
[9] Wang X X, Lv X, Li S Y,. Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltr-ansferase 1A1 in(Bu-gu-zhi) [J]., 2015, 289(1): 70-78.
[10] 陈海媚, 谢晓芳, 彭成. 中药毒理学研究中体外细胞毒性的评价指标及检测方法[J]. 中国实验方剂学杂志, 2017, 23(22): 202-210.
[11] 江振洲, 王欣之, 孙丽新, 等. 中药毒性评价的技术方法与应用[J]. 药学进展, 2013, 37(11): 545-554.
[12] Horzmann K A, Freeman J L. Making Waves: New developments in toxicology with the zebrafish [J].,2018, 163(1): 5-12.
[13] Vliegenthart A D B, Tucker C S, Pozo J D,. Zebrafish as model organisms for studying drug-induced liver injury [J].,2014, 78(6): 1217‐1227.
[14] Fuse Y, Nguyen V T, Kobayashi M. Nrf2-dependent protection against acute sodium arsenite toxicity in zebrafish [J].,2016, 305: 136-142.
[15] 马瑞娇, 贾智莉, 王学芳, 等. 基于斑马鱼模型的抗结核药物肝脏毒性比较研究[J]. 中国抗生素杂志, 2020, 45(9): 953-959.
[16] 王丹丹, 韦英杰, 景莉君, 等. 基于斑马鱼毒/效联合评价的强骨胶囊抗骨质疏松活性与安全性研究[J]. 中成药, 2015, 37 (5): 938-943.
[17] Westerfield M.[M]. Eugene: Institute of Neuroscience, University of Oregon, 2000.
[18] Nasrallah G K, Al-Asmakh M, Rasool K,Ecotoxicological assessment of Ti3C2Tx(MXene) using a zebrafish embryo model [J].,2018, 5(4): 1002-1011.
[19] Jayasinghe C D, Jayawardena U A. Toxicity assessment of herbal medicine using zebrafish embryos: A systematic review [J]., 2019, 2019: 7272808.
[20] 彭蕴茹, 韦英杰, 丁永芳, 等. 基于斑马鱼模型的药物毒性研究进展与中药毒性研究新策略 [J]. 中草药, 2017, 48(1): 17-30.
[21] 郭兆娟, 张晶璇, 康倩君, 等. 补骨脂对大小鼠肝毒性的比较 [J]. 中国实验方剂学杂志, 2020, doi: 10.13422/j.cnki.syfjx.20201970.
[22] 田文杨, 兰姗, 张力, 等. 补骨脂的安全性评价与风险控制措施探讨 [J]. 中国中药杂志, 2017, 42(21): 4059-4066.
Effective identification of toxic related components ofbased on zebrafish model
LI Jia-yan1, 2, LIU Xin-xin1, 2, NING Qing1, 2, LI Yan-dong2, SHI Zi-qi1, 2, WEI Ying-jie1, 2
1. The Third Clinical School of Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Key Laboratory of New Drug Delivery System, National Administration of Traditional Chinese Medicine, Jiangsu Academy of Chinese Medicine, Nanjing 210028, China
To efficiently identify the toxic component groups of(PF) based on zebrafish model combined with correlation analysis.Contents of four coumarins, four flavonoids and bakuchiol in 18 batches of PF from seven producing areas were determined by HPLC. Zebrafish model was used to evaluate the toxicity of 18 batches of PFdecoction, with mortality, organ poisoning form, and LC50value of zebrafish (6 dpf) as indicators. Correlation analysis between contents of various components and LC50value of zebrafish (6 dpf) were carried out to identify toxicity related components, and the zebrafish toxicity evaluation results of the representative components were verified.Contents of coumarins, flavonoids and bakuchiol in 18 batches of PF decoction from different producing areas were quite different. The maximum content of four coumarins, flavonoid (neobavaisoflavone) and bakuchiol were respectively 3.47—5.60, 5.30 and 6.47 times of the minimum. The zebrafish toxicity evaluation results showed that the toxicity of 18 batches of PF decoction was quite different, and LC50(6 dpf) of the maximum was 7.2 times of the minimum. The results of correlation analysis between toxicity and component content showed that zebrafish toxicity had a good correlation with flavonoids and bakuchiol (2were respectively 0.623 4 and 0.587 8), while the correlation with coumarins was relatively low (2was 0.187 7). Toxicity evaluation results of various representative components showed that bakuchiol and three flavonoids (bavachin, neobavaisoflavone, isobavachalcone) were the key toxic components of PF, while coumarins was relatively safe.Zebrafish model could efficiently and sensitively reflect toxicity differences of different batches of PF, of which toxicity relevant component groups could be efficiently identified through correlation analysis between toxicity and content of components, providing a reference for quickly discovering toxicity and related substances from the complex system of traditional Chinese medicine.
; toxic components; zebrafish; correlation analysis; bavachin; neobavaisoflavone; isobavachalcone
R285.5,R285.53
A
0253 - 2670(2021)01 - 0129 - 08
10.7501/j.issn.0253-2670.2021.01.016
2020-08-07
“重大新药创制”科技重大专项资助项目(2017ZX09301-056);国家自然科学基金资助项目(81573833);江苏省医学创新团队项目(CXTDB2017003)
李佳妍,女,硕士研究生,研究方向为中药学。Tel: 18851180283 E-mail: ljy945094845@163.com
韦英杰,女,研究员,硕士生导师,研究方向为中药物质基础与质量控制。Tel: (025)52362109 E-mail: wyj970@163.com
[责任编辑 李亚楠]
