宏微结合素养下的教学实践探索
——以“盐类的水解”为例
2021-01-06◎
◎
一、问题提出
化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的一门学科,其特征是从微观层面认识物质,以符号形式描述物质。《普通高中化学课程标准[1](2017 年版)》(以下简称“课程标准”)中明确指出,化学学科核心素养包括了以“宏观辨识与微观探析”为首的五大核心素养。
对于化学学科而言,“宏观辨识”指的是可以通过肉眼或者借助实验或仪器等手段[2],对物质的性质及可存在状态、转化规律及现象的辨认和识别,“微观探析”指的是从分子、原子、电子等极微小的粒子领域探究和分析物质的组成、结构和性质。
根据课程标准的阐述,“宏观辨识与微观探析”的核心要素主要包括以下内容:(1)能从不同层次认识物质的多样性,并对物质进行分类;(2)能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念;(3)能从宏观和微观相结合的视角分析与解决实际问题。可见“宏观辨识”与“微观探析”并不是彼此孤立的,而是结合在一起的整体,并存在着如下图一所示的进阶关系:
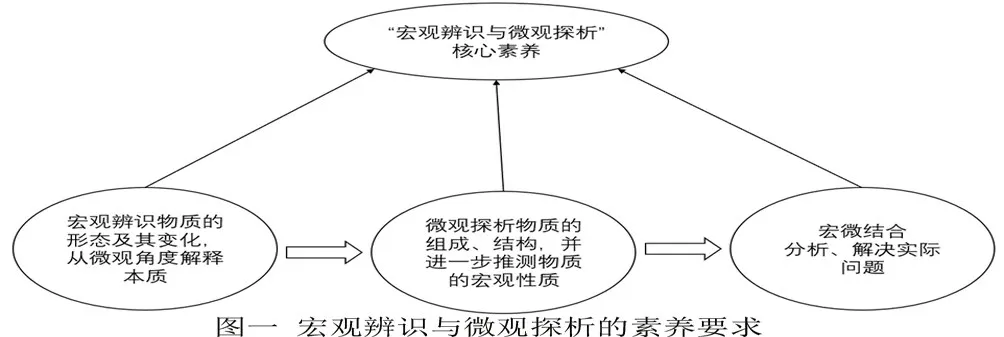
由此可见,在教学中渗透宏微结合的化学思维,培养学生宏微结合的意识和应用宏微结合分析、解决实际问题的能力,是发展“宏观辨识与微观探析”核心素养[3]的重要基础。笔者以“盐类的水解”为例,尝试了宏微结合素养下的教学实践探索。
二、教学目标的确定
1.教材分析和学情分析 “盐类的水解”位于沪教版高一化学第二学期第七章第三节,该内容的教学可以安排三课时,包括盐类水解的原理、影响盐类水解的主要因素以及盐类水解的应用三方面内容。这一部分的知识综合性较强,内容涉及电解质的电离、水的电离和溶液的酸碱性、化学平衡等知识,对于学生建立分析水溶液中微粒及微粒间相互作用的思路和方法等有着重要作用。
本节课的授课对象是高一年级的学生,学生在此之前已经学习了化学平衡、离子反应和电离的知识,能够从微观层面分析溶液中存在哪些微粒以及可能发生的相互作用,但对于涉及到溶质与溶剂间相互作用,并因此影响到水的电离和溶液酸碱性的这类综合问题的分析面临着思维上的挑战。
2.教学目标 通过观察FeCl3溶液的丁达尔效应、铁盐净水的宏观现象,尝试从微观角度分析原因。
知道盐类水解的概念,理解盐类水解的本质,能够判断哪些盐在溶液中发生水解以及盐溶液的酸碱性。
能够初步应用盐类水解的知识,解释一些简单的联系工农业生产和日常生活的化学问题,培养宏微结合下分析、解决问题的能力。
三、教学过程
1.教学设计思路
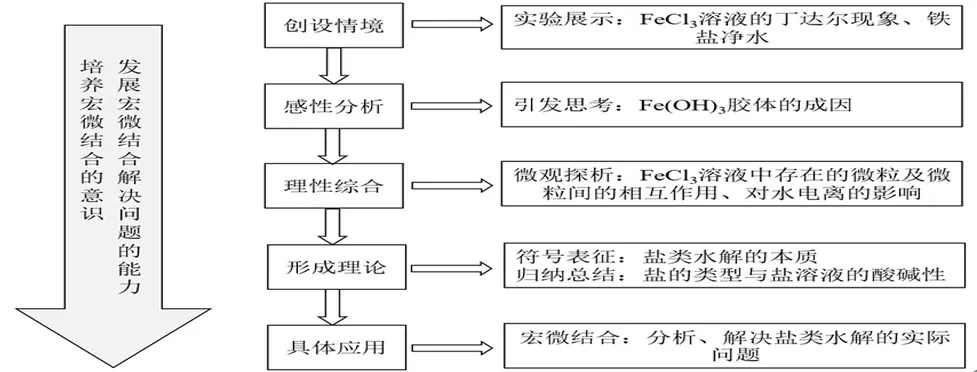
2.教学过程实施
学习任务一:宏观视角下的情境创设
【学生实验】①用激光笔照射FeCl3溶液,观察现象;②将FeCl3溶液倒入浑浊的水中,静置一段时间,观察现象。
【实验现象】①可以看到一条光亮的通路;②一段时间后水变澄清了
【教师提问】为什么会在FeCl3溶液中看到一条光亮的通路?FeCl3溶液为什么可以作为净水剂?
【学生回答】因为在FeCl3溶液中存在Fe(OH)3胶体,所以会存在“丁达尔效应”,且Fe(OH)3胶体具有吸附水中悬浮物的作用,可用作净水剂。
设计意图:通过氯化铁溶液的丁达尔效应及作为净水剂这一宏观事实,引发学生对FeCl3溶液中存在Fe(OH)3胶体的好奇心,为从微观角度探析Fe(OH)3胶体的成因埋下伏笔。
学习任务二:微观本质下的理性分析
【教师提问】FeCl3溶液中Fe(OH)3胶体是如何产生的?
【问题链引导】①FeCl3溶液中存在哪些微粒? ②哪些微粒间可以发生作用? ③作用的结果如何? ④对水的电离平衡有什么影响?
【小组讨论】
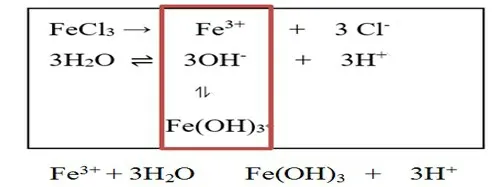
【学生归纳总结】FeCl3电离出的Fe3+与水电离出的OH-结合,生成Fe(OH)3胶体。
【教师提问】Fe3+与OH-结合,此时对溶液的酸碱性有何影响?
【学生猜测】因为Fe3+与OH-结合,可能会破坏水的电离平衡,导致溶液中C(H+)>C(OH-),使得溶液显酸性。
【实验证实】测定FeCl3溶液的酸碱性,证实溶液显酸性。
【教师补充讲解】通过前面有关电解质的电离以及电解质在溶液中的化学反应的学习,我们知道Fe(OH)3是弱电解质,这也是Fe3+能够与水电离出的OH-结合的原始动力。像这种,在溶液中盐电离出的某种离子跟水电离出的H+或OH-离子结合生成弱电解质的反应,就叫做盐类的水解。
设计意图:设计一组相互关联、层层递进的问题链,引导学生从微观角度分析粒子间可能发生的作用,建立宏观、微观及符号三个层面上的有效转换,发展学生从微观、动态、平衡的视角认识水溶液中微粒及微粒间相互作用的分析思路和方法。
学习任务三:宏微结合分析物质组成、结构和性质的关系
【教师提问】从盐的类型上分析,FeCl3属于强酸弱碱盐,其溶液显酸性。盐溶液的酸碱性与盐的类型有怎样的关系?
【学生活动】提供如下盐溶液FeCl3、Al2(SO4)3、NH4Cl、NaHCO3、K2CO3、CH3COONa、NaCl、KNO3、Na2SO4,先从盐的类型角度进行分组,再用pH 计或pH 试纸测定某几份溶液的酸碱性(可不必全部测定)。
【归纳总结】盐溶液的酸碱性与盐的类型的关系

表1 盐溶液的酸碱性与盐的类型的关系
【学生交流】请同学们两人一组,参照刚刚对于FeCl3溶液的分析,尝试分析其他盐溶液显酸性或碱性的原因。
【教师提问】NaCl、KNO3、Na2SO4这类强酸强碱盐溶液显中性,这是为什么呢?
【学生回答】这类盐在水中电离产生的都是强酸阴离子,或者是强碱阳离子,没有办法与水电离出H+或者OH-离子结合生成弱电解质,所以不会破坏水的电离平衡,不会发生盐类的水解,所以溶液显中性。
【归纳总结】盐类水解的规律:有弱才水解,无弱不水解。谁强显谁性,同强显中性。
【教师提问】综合以上对于盐类水解的学习,盐类水解的本质是什么? 对水的电离和溶液pH 有怎样的影响?
【归纳总结】盐类水解的本质:盐与水“复分解”生成弱电解质的反应。其结果是:①促进水的电离;②改变溶液的pH。
设计意图:通过对盐的类型以及对不同盐溶液酸碱性的分析、推理、测定,进一步完善学生对“盐溶液的水解模型”的认知。在此基础上,建构宏微结合视角下解决盐溶液水解问题的一般思路:写出盐的电离方程式、水的电离方程式→判断微粒间的相互作用→明确水电离平衡的移动→推断盐溶液的酸碱性。
学习任务四:知识迁移与运用,分析、解决实际问题
(1)利用简易实验装置,模拟泡沫灭火器灭火。
【演示实验】可供选择的仪器和药品:泡沫灭火器简易发生装置、NaHCO3溶液、Al2(SO4)3溶液。
【现象分析】观察到两者混合后剧烈反应,产生大量的二氧化碳和氢氧化铝,并以泡沫的形式喷出,可以覆盖在燃烧物体的表面,达到灭火的效果。请运用盐类水解的知识加以解释。
(2)草木灰是农村常用的钾肥,它含有碳酸钾。试解释草木灰不宜与铵态氮肥混合使用的原因。
(3)实验室中盛装NaHCO3、CH3COONa 溶液的试剂瓶使用橡胶塞而不用玻璃塞?
设计意图:通过盐类水解知识解决一些日常生产、生活中的应用实例,进一步体会从物质的宏观特征入手,联系物质的组成和结构,解释宏观现象,并从宏观与微观结合的视角对物质及其变化进行分类和表征,发展核心素养。同时,理解化学源于生产、生活,化学必将服务于生产、生活的理念,培养学生的社会责任意识。
四、教学反思
1.基于真实问题情境的创设,培养学科思维 真实问题情境的创设更能激起学生的好奇心和兴趣,有利于培养学生的学科思维。用激光笔照射FeCl3溶液出现一条光亮的通路,浑浊的水中加入铁盐一段时间后可以变澄清,是什么引起了这些有趣的现象? 学生在问题解决的过程中,分析问题情境,提取有用信息,不断地整合已有的知识、技能,学科知识和技能不断结构化,学科思维模式得以发展并逐渐形成。
2.基于学习任务发展“宏观辨识与微观探析”的核心素养 本节课通过设计4 个学习任务,层层推进,从宏观现象下的情境引思到微观本质下的探究剖析,运用化学符号等手段说明物质的组成及其变化,形成并发展学生的宏观辨识与微观探析能力,并在解决实际生产、生活问题的过程中,促进学生认识水溶液中的离子反应与平衡对生产、生活和社会发展的重要作用,深刻理解化学、技术与社会之间的相互关系,发展学生的化学学科核心素养。
