急性心肌梗死不同类型标本的共同差异基因
2021-01-06傅庆华彭飞范文娟唐毅刘征宇郑昭芬颜素兰潘宏伟
傅庆华 彭飞 范文娟 唐毅 刘征宇 郑昭芬 颜素兰 潘宏伟
(湖南省人民医院 湖南师范大学附属第一医院 1心内科,湖南 长沙 410005;2检验科)
缺血性心脏病(IHD)死亡率不断上升〔1~3〕,据世界卫生组织(WHO)估计,到2020年将约有2 500万人死于IHD〔4〕。急性心肌梗死(AMI)是IHD中的急危重症,院内死亡率为6.7%~16.6%,再住院率5.28%~19.9%〔5~7〕,是冠心病的最大死因。AMI可导致心力衰竭、心源性休克、室壁瘤、栓塞等多种严重并发症,住院率高,并发症严重〔8〕。近年来,肌钙蛋白作为AMI的诊断指标获得了认可和推荐,但在如何早期预防和识别AMI的高危人群上仍然缺乏有力的方法。
人类基因表达谱汇编数据库(GEO)是一个开放的基因表达谱芯片上传数据库。近年来,随着基因表达谱的数据急速增长,目前已积累了一些AMI病例和对照组的基因芯片数据,但这些研究通常集中在一种特定类型的AMI相关样本中,并且缺乏临床验证的证据〔9〕,本研究在AMI不同类型样本中识别共同差异基因,更具普遍性意义,同时应用定量准确、重现性非常好的实时荧光定量PCR验证基因表达,更加可靠,并探讨这些基因表达差异的生物信息学意义,从而进一步扩充AMI分子致病机制基因方向的研究,为预防及诊治AMI提供新的依据。
1 材料与方法
1.1芯片生物分析
1.1.1获取基因表达谱数据 搜索美国国立生物技术信息中心(NCBI)GEO数据库,关键词为 “Acute myocardial infarction”,“AMI”,and “Gene expression profile”。如果满足以下两个要求的研究将被纳入:(1)既有AMI患者又有健康对照组;(2)有不同类型样本的基因表达分析。
1.1.2原始数据的预处理及差异基因筛选 芯片数据的统计分析采用专业软件(BRB-ArrayTools 4.3.2 Beta)进行;芯片数据的预处理采用专业算法(JustRMA算法)完成;数据的标准化及过滤采用中位数形式表示,两组基因表达的比较采用独立样本t检验。基因过滤的相关条件:①基因中位数的改变不低于2倍,且改变数量级程度为总样本数的20%以上;②相关基因表达的绝对缺失数据低于总样本数的50%。利用专业数据工具(Class comparison)比较相应样本的数据集,找到AMI与正常样本的差异表达基因。
1.1.3共同差异基因筛选 将两张芯片筛出的差异基因作韦恩图(Venn)分析,将两张芯片差异基因中共同存在的少数基因定义为共同差异基因,并保存其在各芯片中的表达量用作后续分析。
1.1.4火山图 经t检验筛选出表达差异显著的基因,作火山图,横坐标以t检验显著性检验P值的负对数-log10(P-value)表示,纵坐标以log2〔倍数变化值(Fold Change)〕表示,经进一步的优化筛选,(如基因表达变化>2倍等),筛选出显著差异表达的基因用于后续研究。
1.1.5mRNA聚类分析 使用pheatmap R包对差异基因进行聚类分析以P值大小为标准,将P值越小的前50个差异基因作聚类分析,以高亮的形式显现出差异基因主要汇集区域。
1.2共同差异基因的临床验证
1.2.1AMI患者及对照组 10例AMI患者(AMI组)和10例正常对照(对照组)被纳入研究,所有患者符合2015年急性ST段抬高型心肌梗死诊断和治疗指南〔10〕及2016非ST段抬高型急性冠脉综合征诊断和治疗指南〔11〕的AMI标准,AMI组年龄50~ 77〔平均(62.66±7.58)〕岁,男7例、女3例;正常对照由湖南省人民医院体检中心提供,年龄41~ 74〔平均(61.20±10.63)〕岁,男6例、女4例。
1.2.2血液RNA的提取 将受试者外周血标本放入2 ml乙二胺四乙酸(EDTA)试管中,进行DNA分离。采用RNeasy微型试剂盒(Qiagen,Hilden,Germany)在血液取样后24 h内进行RNA分离,并测量分离RNA样品的RNA浓度和纯度。根据说明书,用RT2 HT第一链试剂盒(Qiagen,Hilden,Germany)对分离RNA进行cDNA合成,测量分离cDNA的浓度和纯度。同时,用cDNA样本对造血细胞激酶(HCK)、整联蛋白αM(ITGAM)基因表达进行实时PCR检测。使用RT2 qPCR引物分析工具包(Hilden,Germany)和mastermixes RT2 SYBR绿色qPCR Mastermix试剂盒(Hilden,Germany),用GAPDH作为内参基因。人HCK基因上游引物:5′-CCA GGT CGG AGG CAA TAC-3′,下游引物:5′-GGG CAA CCA CGA TGA TGT-3′,产物167 bp;GAPDH基因上游引物:5′-CGG ATT TGG TCG TAT TGG G-3′,下游引物:5′-CGC TCC TGG AAG ATG GTG AT-3′,产物213 bp,由上海申友生物公司合成。实时PCR循环条件为:预变性95℃、5 min,变性94℃、30 s,退火50℃(GAPDH基因53℃)、30 s,延伸72℃、30 s,终末延伸72℃、7 min,数据收集40个周期。在每个延长周期的末端收集荧光数据。实时PCR扩增后,对数据进行分析并描绘扩增曲线和熔解曲线。调整基线并确定阈值周期。Ct值为荧光信号到达设定阈值所需的循环次数,ΔCt值是Ct值之间的差值。计算目标基因和内参基因间的ΔCt值。目的基因表达水平计算公式〔12〕:目的基因相对量=2-ΔΔCt。
1.3蛋白互作网络分析 STRING数据库可应用于2 031个物种,包含960万种蛋白和1 380万种蛋白质之间的相互作用应用。蛋白质-蛋白质相互作用(PPI)是指两个或两个以上的蛋白质分子经过非共价键形成蛋白质复合体的过程。应用STRING软件对差异基因进行PPI分析:登陆STRING官网(https://string-db.org/),在多个蛋白质(Multiple proteins)选项下提交差异基因列表,有机体(Organism)选项下选择人类(Homo sapiens),完成后点击“SEARCH”。
1.4GO富集分析及KEGG通路分析 应用DAVID及Cytoscape软件的“Bingo”插件对整合后的差异基因进行GO富集分析及KEGG通路分析。第一步,登陆DAVID数据库(https://david.ncifcrf.gov/),选中基因ID转换功能(Gene ID Conversion),提交差异基因列表,并在标识符选项(Select Identifier)中选择官方基因符号(OFFICIAL_GENE_SYMBOL),列表类型(List Type)选择基因列表(Gene List),最后点击提交清单(Submit List)。
1.5统计方法 采用SPSS19.00进行t检验。
2 结 果
2.1差异基因筛选
2.1.1收集基因表达谱数据集 收集序列号为GSE66360和GSE97320的两张基因表达谱数据集。GSE66360为循环内皮细胞,其中AMI患者样本49例,正常人样本50例;GSE97320为血液,其中AMI患者样本3例,正常人样本3例。
2.1.2差异基因筛选及聚类分析
2.1.2.1GSE66360差异基因筛选 GSE66360共筛出差异基因349个,其中表达上调56个,下调293个,如NR4A2、GABARAPL1、NFKBIZ、PDE4B,具有统计学意义,部分主要的差异基因如表1所示。
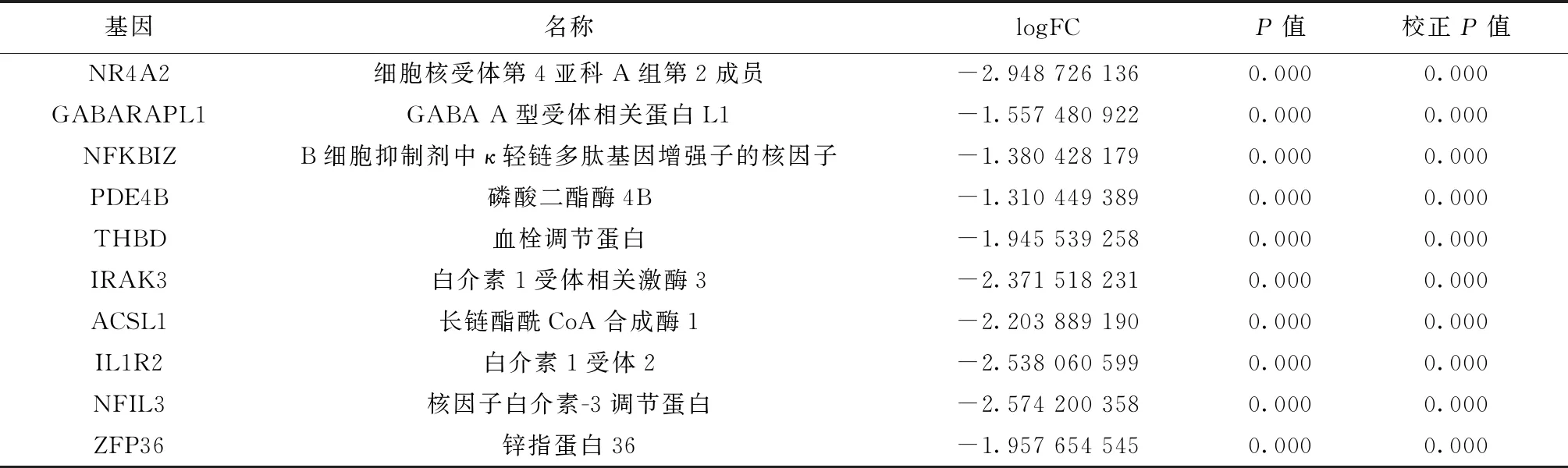
表1 GSE66360部分主要的差异基因
2.1.2.2GSE97320差异基因筛选 GSE97320共筛出差异基因2 425个,其中表达上调1 027个,下调1 398个,如RNASET2、ITGAM、HUWE1、DAZAP2,具有统计学意义(P<0.05,Fold Change>2),部分主要的差异基因如表2所示。
2.1.2.3共同差异基因筛选 从GSE66360与GSE97320中共有2 774个基因被提取并进行分析,分别来自循环内皮细胞和血液,最后筛选出共同差异基因159个,其中上调基因75个,下调基因84个,共同差异基因如表3所示。其中包括C型凝集素结构域家族(CLEC)6个成员,核糖体蛋白(RP)5个,溶质载体家族(SLC)4个成员,ZNP3个,这些同家族蛋白具有部分相同的结构域。
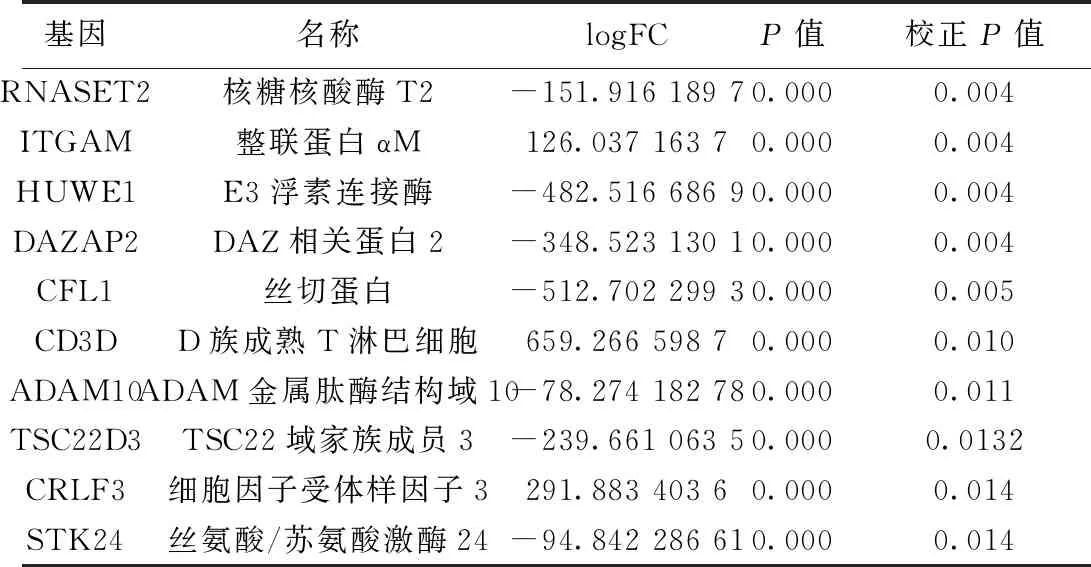
表2 GSE97320部分主要的差异基因
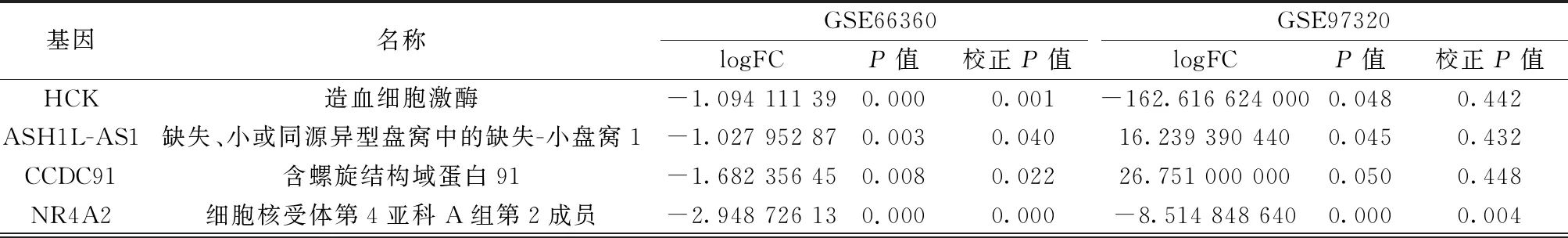
表3 部分主要的共同差异基因

续表3 部分主要的共同差异基因
2.1.3火山图 每个数据库中按上述条件绘制的火山图见图1和图2。以P值-log10为横轴,以logFC为纵轴,可以很好地将两张芯片中筛选的上调和下调共同差异基因分别显示在0轴上下两侧。
2.1.4mRNA聚类分析 两个数据库绘制的差异基因聚类图见图3和图4。从图中可以看出,差异基因可以很好地将正常组织和处理组织分开。
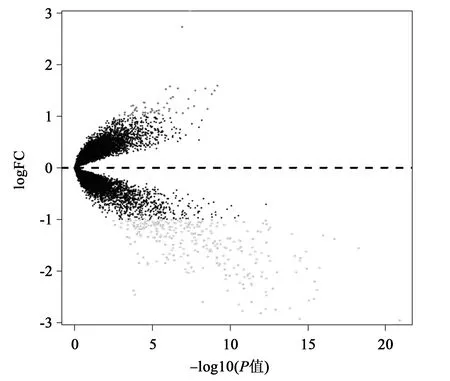
图1 GSE66360基因火山图
图2 GSE97320基因火山图

图3 GSE66360差异mRNA热图
2.2Real-time PCR验证
2.2.1两组临床资料比较 AMI组与对照组比较在舒张压、空腹血糖(FBG)上存在统计学差异(P<0.05);而在年龄、体重指数(BMI)、收缩压、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)方面差异统计学无意义(P>0.05)。见表4。
2.2.2两组HCK、ITGAM基因表达情况比较 用平均ΔCt值比较AMI患者与对照组的HCK和ITGAM基因的相对表达量。低的ΔCt值表示基因表达量高。与对照组相比,AMI组的 HCK、ITGAM基因表达量上调(P<0.05)。见表5。
2.3共同差异基因之间的PPI分析 PPI分析表明AMI的共同差异基因之间有复杂的相互关系,见图5。例如IL1B与IRAK3、IL1R2、NFIL3、ITGAM,LRRK2与NFKBIZ、IRAK3、MAP3K8共同表达,同时NFKBIZ与MAP3K8也共同表达,而且LRRK2与这些基因的相互作用已被实验证明,ITGAM与多达16个基因有文本采掘证据或共同表达或数据库证据等多种类型的证据,也有少数基因如MEST和SLC22A4间仅存在文本采掘证据,和其他基因无相互作用,而如RPH3A等基因与其他任何共同差异基因间无相互作用的证据。
2.4核心基因柱状图 通过核心基因柱状图(图6)可以看到IL1B、JUN、JRRK2、ITGAM、HCK处于蛋白互作系统的核心位置,对整个网络起的作用最关键,其中最为重要的是IL1B、JUN、JRRK2,分别连接了25、23、22个节点,而ITGAM,既连接16个节点又是主要的共同差异基因之一。
2.5共同差异基因GO富集分析 在上述明确的159个AMI的共同基因里,最显著的富集生物过程见图7。最显著的富集功能是“对生物刺激的反应”(GO:0009607,P=0.000)及“防御反应”(GO:0006952,P=0.000)。此外,它们也富集在“对其他有机体的反应”和“对压力的反应”中。

图4 GSE97320差异mRNA热图
表4 两组临床资料比较
2.6KEGG功能富集分析 使用DAVID对合成后的基因进行KEGG功能富集分析,我们共找到14个相关的KEGG通路,其中最主要的肿瘤坏死因子信号通路、利什曼病、百日咳、AMPK信号通路、矿物质吸收、破骨细胞分化、趋化因子信号通路、幽门螺杆菌感染中上皮细胞信号及细胞因子与其受体相互作用(P<0.05)。见表6。
表5 两组HCK、ITGAM基因平均ΔCt值比较

图5 共同差异基因蛋白相互作用网络
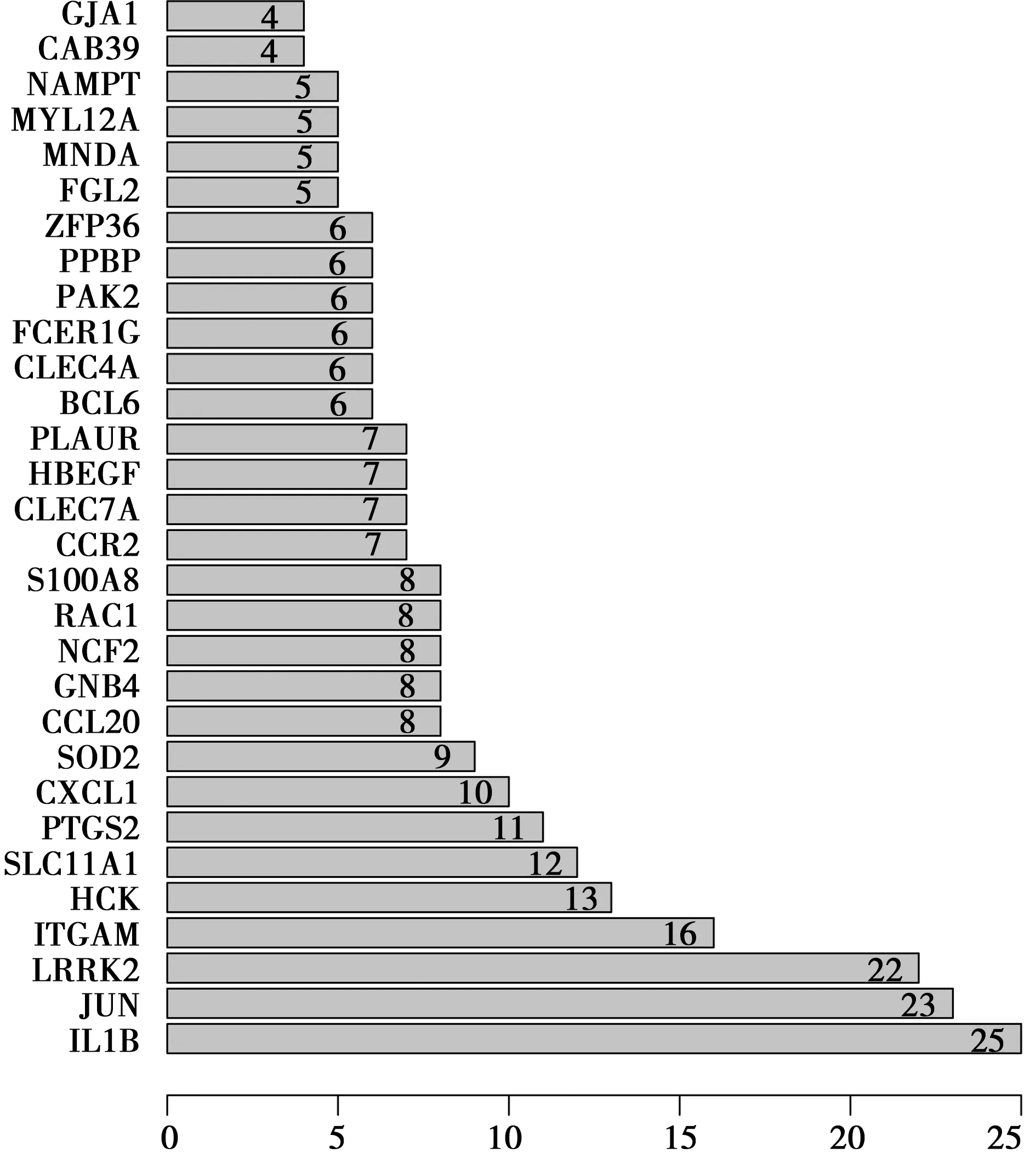
图6 核心基因

图7 共同差异基因GO富集分析结果
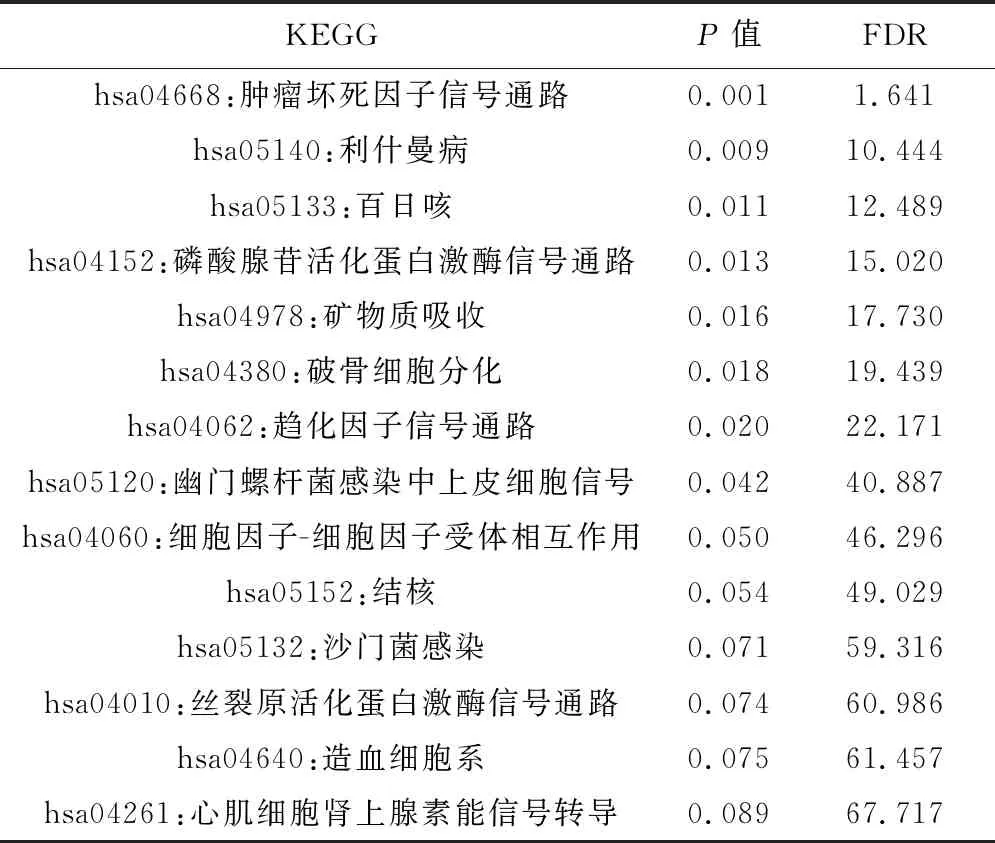
表6 共同差异基因KEGG通路富集结果
3 讨 论
AMI大部分是冠状动脉动脉粥样硬化斑块破裂导致的,以往的研究表明动脉粥样硬化与高脂血症、吸烟、糖尿病、高血压、肥胖等危险因素有关,其动脉血管内皮细胞的改变与炎症有关〔13〕。近年来基因芯片研究发现了与AMI有关的大量基因表达〔14~16〕,让我们对AMI的遗传发病机制有所认识,但这些差异基因是在单一类型样本中与正常对照组比较后发现的,未见对于不同类型样本间共同差异基因的研究,而这些共同差异基因在AMI病理及病理生理过程中所发挥的作用可能更具有普遍性意义。通过对血液及循环内皮细胞两个基因芯片数据集的研究,筛选出了AMI的共同差异基因。
本研究共纳入109个样本,从2 784个差异基因中找到了159个共同差异基因,运用大量的微阵列数据,将误差率降得更低,使实验结果变得更可信。
在筛选出的共同差异基因中,PPI分析结果提示,IL-1B、JUN、LRRK2、ITGAM、HCK是影响最大的5个因子。其中一些在以往研究〔17~21〕表明在AMI患者中上调,并有证据表明他们参与到形成AMI的某些途径中。IL-1β是一种重要的炎症性细胞因子,其在AMI中上调,症状出现后的24 h达高峰〔17,18〕,可持续3 w〔19〕。IL-1β与动脉粥样硬化有关,其mRNA在人类的高胆固醇血症和动脉粥样硬化中表达增加〔20〕。整合素(ITGAM)是分布于细胞表面的跨膜糖蛋白受体,AMI患者的ITGAM上调可持续28 d甚至更久〔21〕。血小板膜上的ITGAMα2bβ3是GPⅡb/Ⅲa受体,其拮抗剂能发挥强有力地抗血小板作用。目前临床上使用的ITGAMα2bβ3拮抗剂tirofiban及单克隆抗体阿西单抗(abciximab)广泛应用于AMI中。LRRK2与JUN未见于AMI的研究,而与帕金森病和阿尔茨海默病关系密切,Eugénie等〔22〕观察到降脂药物能推迟和减缓帕金森病的进程,提示帕金森病与脂质代谢有关系。而在本次的实验中,这两个因子作为对AMI很重要的共同差异基因,应当对其进行更多的探讨及实验,期待后续有科研工作者对其展开与AMI的系统性研究。
GO富集分析发现,“刺激反应的正向调节” “response to external stimulus” “immune response” “regulation of response to stress”和“defense response”等生物进程在AMI的发病过程中占重要地位。所有这些都可以引起炎症反应,而以往研究〔23〕显示炎症反应在动脉粥样硬化和AMI过程中发挥重要作用,与本结果高度相符。血管内皮损伤启动炎症反应导致动脉粥样硬化开始,并持续作用于整个过程中,调脂药物除了降低LDL、升高高密度脂蛋白外还通过抗炎作用治疗冠心病。
在KEGG通路分析方面,共同差异基因主要影响 “肿瘤坏死因子信号通路”“利什曼病”“百日咳”和“AMPK信号通路”。肿瘤坏死因子是一种重要的炎症因子,在AMI后升高,与GO分析结果相呼应〔23〕。cAMP通过调节酶的活性来实现对细胞许多代谢过程的调节。Andrew等〔24〕研究发现在心梗或非心梗导致的心力衰竭动物模型中百日咳毒素能显著降低由于升高的cAMP水平带来的正性肌力作用,但未提及百日咳和cAMP与AMI的直接联系,需要进一步研究明确,但因我们实验条件有限,还没有达到可以深入研究其分子机制的条件,期待有条件的研究人员进行后续研究。
通过实时PCR我们验证了AMI患者血液中共同差异基因中的HCK水平上调,与 Wen等〔25〕研究结果一致。Hck通过LPS/TLR4途径诱导炎症因子TNF和IL-6产生,参与动脉粥样硬化过程〔26〕。可见本研究鉴定的共同差异基因符合临床实际。但因为经济及其他原因,无法将所有的共同差异基因做临床验证,可在以后的研究中逐步完善。
AMI的生物学指标的检测近些年不断取得进步。心肌肌钙蛋白只在心肌细胞中特异表达,具有高敏感性、高特异性的特点,自从1987年第1次被描述检测〔27〕,血浆心肌肌钙蛋白I或T水平已经成为诊断AMI的非常重要的工具〔28~31〕。随着研究的深入,人们发现它在多种心血管疾病如心力衰竭、急性肺栓塞中的危险分层和短期和长期预后中也具有关键作用〔32〕。本研究鉴定的共同差异基因在敏感性与特异性上与肌钙蛋白比较无优势,但仍可以就肌钙蛋白联合共同差异基因在AMI的危险分层进行研究。本研究识别出的差异基因中有的已经以药物形式参与AMI的治疗,如ITGAM,所以进一步研究这些差异基因具有广阔的前景。
由于资料有限,本研究仅集中于两种标本类型,得到的共同差异基因较多,指向性不是特别强。然而,在目前研究中发现的这些共同基因,可以作为进一步探索和证实更多AMI样本类型的候选差异基因库。随着日后基因表达数据的增多,可以在此基础上进行进一步探索,发现更具有普遍性和代表性的差异基因。此外,芯片数据发布时间以及样本个数也存在缺陷,因为样本个数问题,不能完全统计各类人种及地区的不同,也可能不同的地区或人种之间所隐藏的共同差异基因有所不同。基于本研究的上述结果和讨论,找到这些共同差异基因并进行相关性分析后,有很多值得进行的后续研究:①在AMI发病过程中的作用机制。②在预测AMI发生中的临床价值,是否能利用这些共同差异基因早期预测AMI及提前预防。③在AMI治疗及预后方面的前景,寻找到AMI治疗靶点或作为衡量治疗疗效的标志。
综上,AMI不同类型的样本中存在共同调节基因,且其水平上调,这些基因间存在广泛的相互作用。期待进一步研究其在AMI中的可能机制及AMI早期预测、诊断、治疗中的潜力,使患者获益。
