Caveolin 3蛋白与心脏Kv1.5钾通道的相互作用及鉴定△
2021-01-06马青艳林吉进
马青艳,林吉进,黄 蕾
[1.广东省人民医院(广东省医学科学院)广东省心血管病研究所心血管辅助诊断科,广州 510080;2.广东省人民医院(广东省医学科学院)广东省心血管病研究所心内科,广州510080]
Caveolin 3是细胞膜穴样内陷分子的锚定蛋白,具有心肌特异性,只在心脏和骨骼肌中表达[1],在蛋白质信号传导中发挥着活性调节因子的作用。既往研究表明,caveolin 3 不仅参与心肌缺血再灌注损伤、心肌肥大、心律失常等疾病的病理生理机制[2],而且调控caveolin 3 功能或表达水平可能起到治疗相关心血管疾病的作用[3]。由KCNA5 基因编码的Kv1.5 钾电流,是心房的超速激活延迟整流钾电流(ultrarapidly activating delayed rectifier potassium current,Ikur)。此电流只影响心房动作电位持续时间(APD)复极化过程,而未影响心室复极化,是目前研发心房颤动药物的新靶点[4]。近几年已报道,caveolin 3 蛋白与心肌钙离子通道存在相互作用并调控该通道蛋白的表达、转运及功能[5];而caveolin 3 蛋白与Kv1.5 钾通道是否存在相互作用,目前还未见报道。因此,本研究采用酵母双杂交技术初步探索caveolin 3 蛋白与Kv1.5 钾通道是否存在相互作用,然后应用免疫荧光细胞分析和膜片钳技术,证实caveolin 3 在心肌细胞中与Kv1.5存在相互作用。
1 材料和方法
1.1 材 料
脂质体2000(Lipofectamine 2000)购自Invitrogen 公司,pGBKT7 载体和人类心脏cDNA 文库(载体为pACT2)购买自Clontech 公司,膜片钳放大器为美国Axon 公司的Axopatch 200 B。
1.2 Caveolin 3 质粒的构建
利用合成的带有EcoR I 和BamH I 限制性内切酶位点的特异性引物(Forward:5′-CGGAATTCATGATGGCAGAAGAGCA-3′;reverse:5′-CGGGATCCTTAGCTGTAGGTGCCCACAGG-3′)进行聚合酶链反应(polymerase chain reaction,PCR),PCR 扩增caveolin 3 基因的N 端全长(caveolin 3-NT,aa 1-159)。应用EcoR I 和BamH I 限制性内切酶酶切PCR 产物和pGBKT7 载体(Clontech),通过凝胶回收纯化得到两端分别为EcoR I 和BamH I 限制性内切酶位点的线性pGBKT7 载体和PCR 产物,应用T4 连接酶将两者连接,从而构建了pGBKT7-caveolin 3-NT 诱饵质粒。为了确保构建好的pGBKT7-caveolin 3-NT 质粒能表达“caveolin 3-NT-Gal4 DNA binding domain”融合蛋白,将其送往TaKaRa公司测序,证明caveolin 3-NT 和“”GAL4 DNA-BDC-Myc”在同一读框,没有PCR 引起的任何突变。
1.3 感受态酵母菌的制备和转化
详细方法参见我们既往的报道[6]。
1.4 Caveolin 3 诱饵蛋白是否自我激活报告基因的检测
为判断诱饵蛋白本身是否自我激活Ade2,His3和Mel1报告基因,分别将被pGBKT7-caveolin 3-NT、pGBKT7空载体、阳性对照质粒(p53+Large T-antigen)转化的酵母菌AH109 分别涂布于SD/-Trp、SD/-Trp/-His、SD/-Trp/-Ade 和SD/-Trp/X-α-Gal不同平板上,于30℃培养2 周,观察生长情况及菌落是否变成蓝色。同时也进行了β-半乳糖苷酶菌落影印滤膜分析来测定不同诱饵质粒对LacZ基因激活的水平。
1.5 内源性His3 表达检测
由于不同酵母菌菌株会产生不同水平的内源性组氨酸,通常可以通过加入抑制剂3-氨基-1,2,4-三唑(3-Amino-1,2,4-triazole,3-AT)来抑制这种内源性组氨酸的产生。为使3-AT 的浓度最优化,将已被各种诱饵质粒载体或pGBKT7空载体、阳性对照质粒转化的酵母菌涂布于3-AT 浓度分别为0、2.5、5、7.5、10 mmol/L 的SD/-His/-Trp 平板上,于30℃培养2 周,观察菌落生长情况。
1.6 酵母双杂交筛选人类心脏cDNA 文库
挑选新鲜的已被诱饵质粒pGBKT7-caveolin 3-NT 转化的AH109 菌落接种于50 mL SD/-Trp 培养液中,培养20 h 后,离心取沉淀物,与含人类心脏cDNA文库(载体为pACT2,Clontech)的酵母菌Y187混合培养24 h。24 h 后离心取沉淀物加入0.5×YPDA/kanamycin 培养液中,涂布于50 个含5 mmol/L 3-AT 的SD/-Trp/-Leu/-His/-Ade(Quadruple Dropout,QDO)平板上进行培养2 周。然后,挑取分离生长良好菌落依次划线接种于QDO/X-α-Gal、SD/-Trp/-Leu(Double Dropout,DDO)/X-α-Gal、DDO/X-α-Gal、DDO/X-α-Gal、QDO/X-α-Gal 平板上。挑取最后一次的QDO/X-α-Gal 平板上生长良好的单个蓝色菌落,接种于0.5 mL 的SD/-Leu/-Trp 培养液,于30℃250 r/min 振荡培养20 h。然后,使用Lyticase 溶壁酶提取酵母菌中的总DNA(包括酵母菌的基因组DNA、“诱饵”质粒、来自cDNA 文库的质粒),将提取所得的总DNA 经电穿孔法转化大肠杆菌DH5α并涂布于LB/Ampicillin平板上,仅有被来自cDNA 文库(其携带cDNA 的载体为pACT2,该载体带有AMPr)的质粒转化的细菌才能生长,因此,LB/Ampicillin 平板上能生长的质粒即是来自cDNA 文库的“猎物”质粒。
1.7 pDsRed2-N1-caveolin 3 和pEGFP-N3-KCNA5质粒的构建
利用EcoR I/BamH I 从pMD18-T-caveolin 3 中切出caveolin3 的全长,将其连接到pDsRed2-N1,构建成能表达红色荧光素的pDsRed2-N1-caveolin 3 质粒。从pcDNA3.1-KCNA5 表达载体中,通过Hind III/ Kpn I 将全长KCNA5 cDNA 插入表达绿色荧光素载体pEGFP-N3 的相应位点上,构建pEGFP-N3-KCNA5 表达载体。构建载体时,确保载体pDSRed2-N1 中的“DsRed2“与caveolin3 在同一读框、载体pEGFP-N3 中的“EGFP“与KCNA5 在同一读框,分别能表达“caveolin3-DsRed2“和“KCNA5-EGFP“融合蛋白。将构建的载体送往TaKaRa 公司测序,证明目标质粒构建成功。
1.8 细胞培养及转化
在37℃、5%二氧化碳的温箱中,用含10%胎牛血清的DMEM(Hyclone Laboratories)培养基培养HEK293 细胞。转染前的1 d,将生长旺盛的HEK293 细胞接种于六孔板中,确保转染当天细胞的融合度达到90%~95%。应用脂质体2000(lipofectamine 2000)将pEGFP-N3-KCNA5 质粒转染HEK293 细胞以及质粒pDsRed2-N1-caveolin 3和pEGFP-N3-KCNA5 共转染HEK293 细胞。孵育6 h 后,将HEK293 细胞培养于24 孔培养板,加入不同浓度的G418(200、300、400、500、600、700、800 mg/L),根据培养基的颜色和细胞生长情况,每3~5 d 更换一次培养基,以2 周左右细胞全部死亡的浓度为筛选浓度。
1.9 免疫荧光细胞化学分析
质粒pDSRed2-N1-caveolin 3 和pEGFP-N3-KCNA5 转染HEK293 细胞24~48 h 后,用DAPI 与磷酸盐缓冲液(PBS)按体积比1∶10 的比例配制,配置后复染细胞核孵育5 min,然后用磷酸盐缓冲液清洗3 次,每次5 min。载玻片上加入抗淬灭剂DABCO 进行封片,然后将载玻片放置倒置荧光显微镜下进行观察转染细胞。
1.10 膜片钳技术
既往研究已表明HEK293 细胞中未表达内源性caveolin,因此被选为我们的建模系统。将实验分为两组。(1)对照组(Kv1.5 组):将质粒pEGFPN3-KCNA5转染HEK293细胞,使其单独表达Kv1.5通道电流;(2)实验组(Kv1.5+caveolin 3组):将质粒pEGFP-N3-KCNA5 和pDSRed2-N1-caveolin 3 共转染HEK293 细胞,使其同时表达caveolin 3 蛋白,以研究caveolin 3蛋白对Kv1.5通道功能的影响。每组记录10 个细胞的Kv1.5 通道电流情况。在转染后24 h,通过膜片钳破坏细胞膜的脂筏,将Borcillica玻璃移液管拉至2~4 MΩ的电阻,在荧光显微镜(Nikon)下通过GFP和Red荧光鉴定细胞,记录其对应电流情况。本研究使用Axon 的MultiClamp 700B Commander和Molecular Devices的pCLAMP 10.2软件(Axon Instruments,Foster City,California)进行全细胞膜片钳记录。电极的电阻用KCl 20 mmol/L、MgCl21.0 mmol/L、HEPES 10.0 mmol/L、EGTA 5.0 mmol/L、GTP 0.1 mmol/L、门冬氨酸钾110 mmol/L、磷酸肌酸钠5 mmol/L、Mg2+-ATP 5 mmol/L,用KOH 调pH 至7.2。用细胞外液NaCl 140 mmol/L、KCl 5.0 mmol/L、MgCl21.0 mmol/L、KaH2PO40.33 mmol/L、HEPES 5.0 mmol/L、Glucose 10.0 mmol/L,用NaOH 调pH 至7.4。调制细胞钳制在-80 mV 的条件下,予指令从-40~+60 mV 的电位,步阶电压为10 mV,波宽为200 ms,然后电压保持在-40 mV,持续300 ms记录Kv1.5 钾电流。所有电生理实验均在室温(23℃±1℃)下进行。
1.11 统计学分析
采用SPSS 19.0 统计软件对数据进行分析。计量资料以()表示,进行Student′st检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 “诱饵质粒”pGBKT7-caveolin 3-NT的鉴定结果
将caveolin 3 基因的N 端全长caveolin 3-NT(aa 1-159)克隆进诱饵载体pGBKT7 中。构建载体时,确保载体pGBKT7 中的“GAL4 DNA-BD”和C-Myc 与caveolin 3-NT 在同一读框,能表达融合蛋白“GAL4 DNA-BD-C-Myc-caveolin 3-NT”。将构建好的pGBKT7-caveolin 3-NT 诱饵质粒经EcoRI和BamHI 双酶切(图1)及进一步测序鉴定,结果证明caveolin 3-NT 和“GAL4 DNA-BD-C-Myc”在同一读框,没有PCR 引起的任何突变。

图1 “诱饵质粒”pGBKT7-caveolin 3-NT 酶切鉴定图
2.2 Caveolin 3诱饵蛋白是否自我激活报告基因的检测结果
在SD/-Trp/X-α-Gal 平板上,所有被转化的AH109 均生长,这是因为pGBKT7 自身带有营养筛选标记Trp,可以自身表达色氨酸,然而只有被阳性对照质粒转化者变成蓝色,这表明诱饵蛋白caveolin 3-NT不能自我激活报告基因Mel1(图2A)。在SD/-Trp/-Ade 平板上,只有被阳性对照质粒转化的AH109 酵母菌可以生长,这表明诱饵蛋白caveolin 3-NT不能自我激活报告基因Ade2(图2B)。在SD/-Trp/-His 平板上,被pGBKT7 和pGBKT7-caveolin 3-NT 转化AH109 酵母菌有弱生长,这表明诱饵pGBKT7 可以弱激活报告基因His3,并表达一定水平的组氨酸(图2C)。总之,诱饵蛋白caveolin 3-NT 未能够自我激化报告基因Ade2、Mel1 和LacZ,弱激活报告基因His3。

图2 “诱饵蛋白”caveolin 3 自激活报告基因图
2.3 内源性His3 表达检测结果
在诱饵蛋白自我激活报告基因的检测中,发现被pGBKT7 载体AH109 菌可以弱激活报告基因His3,表达一定水平的组氨酸。为抑制酵母菌内源性组氨酸表达,本研究可以通过在培养基上加入3-氨基-1,2,4-三唑(3-AT)抑制这种的表达。为使3-AT 的浓度最优化,将被pGBKT7-caveolin 3-NT 质粒转化的酵母菌AH109 分别涂布于含有不同浓度3-AT(0、2.5、5、7.5、10 mmol/L)的SD/-Trp/-His 平板上30℃培养1~2 周,生长情况如图3所示。该结果表明3-AT 抑制内源性组氨酸的最适合浓度为10 mmol/L。

图3 pGBKT7-caveolin 3-NT、pGBKT7 vector、阳性对照组、AH109 酵母菌在含有不同浓度3-AT(0、2.5、5、7.5、10 mmol/L)的SD/-Trp/-His 平板上的生长情况
2.4 诱饵蛋白caveolin 3-NT 筛选心脏文库
本实验对caveolin 3-NT 进行酵母双杂交筛选时,共筛选了6.82×107个克隆,在最初的含10 mmol/L 3-AT 的QDO 板上共长出的158 个克隆,再经过多次的筛选得到30 个克隆。将这30 个克隆的“猎物”质粒送往测序,将测序所得到的DNA 序列输入美国国立医学图书馆的BLAST 数据库(http://www.ncbi.nlm.nih.gov/BLAST/)进行分析,共得到KCNA5、CDH13(T-cadherin)、MYBPC3(cardiac myosin binding protein C)等16 种蛋白质(有的克隆重复多次为KCNA5)。
2.5 质粒pDSRed2-N1-caveolin 3 和pEGFP-N3-KCNA5 的鉴定结果
将构建好的质粒pDSRed2-N1-caveolin 3 和pEGFP-N3-KCNA5 经测序鉴定,结果证明DsRed2与caveolin 3、EGFP 与KCNA5 在同一读框,且没有PCR 引起的任何突变。
2.6 Caveolin3 和KCNA5 共定位
应用免疫荧光细胞化学分析方法研究caveolin 3 蛋白和KCNA5 蛋白在细胞内的亚定位情况。将质粒pDSRed2-N1-caveolin 3 和pEGFP-N3-KCNA5利用脂质体2000共转染HEK293细胞,用G418处理筛选出表达载体的转染细胞,再进行细胞爬片固定,应用倒置荧光显微镜进行观察。荧光显微镜显示KCNA5 蛋白定位于细胞膜上,显示为绿色信号,caveolin 3 蛋白也定位于细胞膜上,显示为红色信号;红色信号和绿色信号重叠处意味caveolin 3 蛋白和KCNA5 蛋白的细胞共定位的位置,则显示为黄色信号(如图4)。本实验结果表明,caveolin 3 蛋白和KCNA5蛋白在细胞内共定位于细胞膜上。

图4 KCNA5 与caveolin 3 蛋白的细胞共定位图像[绿色信号为KCNA5 蛋白信号(A),红色信号为caveolin 3 蛋白信号(B),黄色信号为红色信号和绿色信号重叠信号(C),提示cavoiln 3 蛋白和KCNA5 蛋白的细胞共定位的位置]
2.7 Caveoiln 3 和Kv1.5 钾通道功能的影响
对照组和实验组细胞所记录到的Kv1.5 通道电流,如图5A、5B 记录所示。结果显示,实验组(Kv1.5+caveolin 3 组)明显减少了HEK293 细胞中Kv1.5 的电流情况(如表1 所示)。与对照组相比,在脉冲电压从-10 mV 到60 mV 时,caveolin 3 表达组的电流振幅和电流密度均显著的改变(P<0.05)(如表1、图6AB所示);其中,在电压+60 mV时,Kv1.5+caveolin 3 组的Kv1.5 电流振幅明显低于HEK293/Kv1.5 组的Kv1.5 电流振幅,差异有统计学意义[(896.69±145.12)pAvs.(3 303.77±779.27),P<0.001,n=10](如图6A)。同时,在电压+60 mV 时,Kv1.5+caveolin 3 组的Kv1.5 电流密度比亦明显低于Kv1.5组的Kv1.5电流密度比,差异有统计学意义[(30.99±5.46)pA/pFvs.(95.13±13.46)pA/pF,P<0.001,n=10](如图6B)。因此,可以认为caveolin 3 的表达影响并降低了Kv1.5 的电流振幅及电流密度比,caveolin 3 蛋白对心脏Kv1.5 钾通道具有负性调控作用。
3 讨论
本研究首次利用酵母双杂交技术筛查出与caveolin 3相关蛋白有KCNA5、CDH13(T-cadherin)、MYBPC3(cardiac myosin binding protein C)等16 种蛋白质,其中克隆重复多次、备受关注的是KCNA5。KCNA5 基因(potassium voltage-gated channel,shaker-related subfamily,member 5)为Kv1.5 钾通道的编码基因,是Ikur 的主要分子基础,编码了Kv1.5 钾电流,此电流只在心房中特异性表达[5,7]。caveolin 3 是细胞质膜上的特异性囊状小凹结构,具有心肌特异性,从caveolin 3 N 端筛选出心脏文库中KCNA5 基因,我们初步推测caveolin 3 蛋白质可能对Kv1.5 钾电流的正常定位、复合体形成、功能调控等具有重要意义。
表1 两组细胞在不同电压时Kv1.5电流振幅和电流密度比的比较 [n=10,]

表1 两组细胞在不同电压时Kv1.5电流振幅和电流密度比的比较 [n=10,]

图5 Caveolin 3 蛋白对Kv1.5 通道电流的影响的电流图(A:HEK293 细胞中单独表达KCNA5 蛋白的Kv1.5 通道电流;B:共同表达KCNA5 和caveolin 3 的细胞所记录到的Kv1.5 钾通道电流)
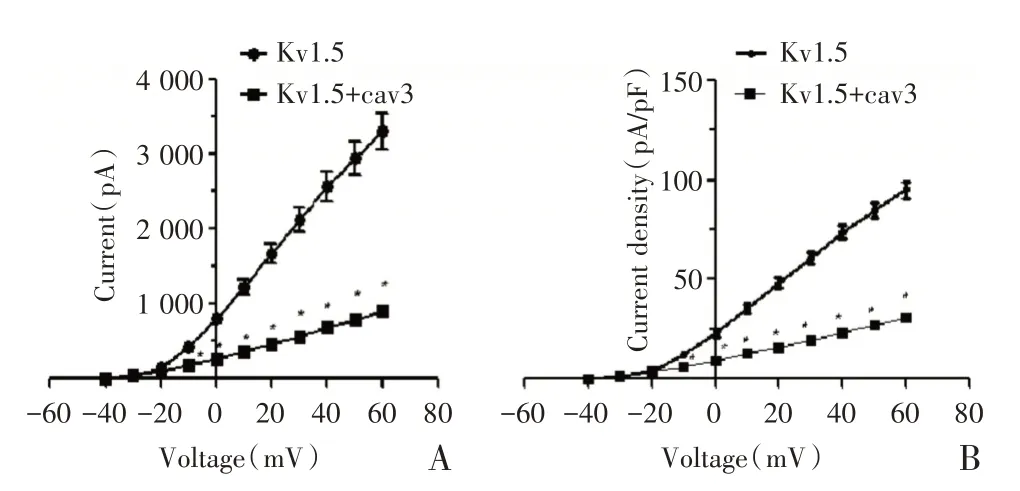
图6 Caveolin 3蛋白对Kv1.5通道电流影响的曲线图[A:对照组与实验组,Kv1.5 钾通道的电流与电压关系(I-V 曲线);B:对照组与实验组,Kv1.5 钾通道的电流密度比与电压的曲线关系(n=10,P<0.05)]
本实验将caveolin 3 蛋白N 端(caveolin3-NT,aa 1-159)克隆进入诱饵载体pGBKT7。pGBKT7为酵母表达载体,具有核定位序列,该载体表达的caveolin 3-NT 融合蛋白通过该核定位序列而进入核内。然而,此技术未能确定完整的caveolin 3蛋白正常定位是否与Kv1.5 钾电流存在共定位。因此,我们将caveolin 3 蛋白和KCNA5 蛋白转染HEK293细胞,通过荧光免疫化学分析发现KCAN5 和caveolin 3 蛋白共定位于细胞膜上。Ravi 等[4]研究利用共聚焦成像证明了Kir2.1和caveolin 3的共定位,并发现caveolin 3蛋白与Kir2.1形成复合体,修饰并调控Kir2.1 电流密度表达。Caveolin 3 蛋白和KCNA5蛋白共定位提示,caveolin 3 蛋白很可能也相似参与了Kv1.5 钾通道的功能调控。
众多研究证实KCNA5 基因参与了心房颤动的心肌重构[8],心房颤动时动作电位中复极化过程的改变与Kv1.5 的mRNA 表达改变有关[9]。此外,Christophersen 研究者发现,KCNA5 基因的突变,扰乱酪氨酸激酶信号通道传导,引起Ikur 电流密度的增强或减弱,动作电位持续时间和有效不应期(ERP)的延长,增加早期复极化的可能,进而诱发心房颤动[10]。Kv1.5 钾电流参与动作电位持续时间复极化过程,而未影响心室肌复极化过程发挥作用,使其成为新的治疗心房颤动药物研究热点[5]。人们在不断地探索选择性抑制Kv1.5 通道延长心房有效不应期,而不引起室性心律失常的危险,研发选择性抗心律失常药物靶点[8,11-12]。假设caveolin 3 蛋白与Kv1.5 钾通道形成复合体,修饰并调控电流密度的表达,那么,caveolin 3 蛋白可成为治疗心房颤动的药物靶点。
以往的研究显示,caveolin 3蛋白与心脏Kir2.1[2]、Nav1.5[13]、Kv1.3[14]、KCa1.1[15]、cyclicnucleotidegated(HCN)[16]等多种离子通道存在相互作用并调控该通道蛋白的表达、转运及功能。本研究利用膜片钳技术,记录到caveolin 3 蛋白的表达,降低了Kv1.5 钾通道的电流振幅和电流密度,首次发现caveolin 3 蛋白对Kv1.5 钾通道的电流具有负性调控作用。然而,其具体调控机制需进一步的探索。先前研究已经证实,caveolin 区域的改变会显著影响心脏HCN4,Kv1.5,Cav1.2 和Nav1.5 等通道的特性[13,15-17]。Caveolin 3 基因的突变与先天性长QT综合征(LQT9)有关,其T63S,T78M,A85T,L79R,C78W 的点突变增加晚期钠电流、延长动作电位持续时间从而诱发LQT9 的发生[16]。F97C 和S141R点突变,增加了Cav1.2 编码的L 型Ca2+通道电流的增加,降低了介导瞬时外向钾电流(Ito)的Kv4.2 和Kv4.3通道电流[17]。此外,Vaidyanathan、Vatta等[13,18]研究发现,caveolin 3 可通过影响Kir2.1、Nav1.5 通道诱发LQT7、LQT3 发生;而caveolin 3 影响Kir2.1的另一种机制包括通道亚硝基化,Nedd4-2 诱导的快速降解或通过与4,5-二磷酸磷脂酰肌醇(PIP2)相互作用改变门控特性[18]。因此,改变小窝蛋白的微结构可调控多种通道蛋白的表达、转运及功能。调控caveolin 3 功能或表达水平有时候可起到治疗在多种心血管相关疾病的作用,例如过渡表达caveolin 3 蛋白可通过抑制T 型Ca2+电流来对抗心脏肥大[15]。
Caveolin 3 作为信号分子的支架和调节蛋白,其调控离子通道特别是Kv1.5 电流通道的病理生理机制,尚未明了,需要进一步的研究探索。本研究首次发现caveolin 3 蛋白对Kv1.5 电流具有负性调节机制,为研发安全有效的心房颤动药物提供一个潜在的靶点和新的研究思路。