Cu2+、Zn2+胁迫下苦草的生理生化特性研究
2021-01-05贾雨淅李睿江杨婉秋姚军文高桂青
江 延 王 岩 贾雨淅 李睿江杨婉秋 姚军文 高桂青
(1.南昌工程学院 土木与建筑工程学院,江西 南昌 330099;2.南昌工程学院 水利与生态工程学院,江西 南昌 330099)
由于矿产资源的不合理开发利用和人类生活中的胡乱排放,大量重金属元素进入河流湖泊当中[1-3],使得水体重金属含量严重超标[4]。重金属种类和来源各不相同,导致水体污染情况十分复杂[5-6],因此重金属污染水体的污染情况也普遍以复合胁迫的形式出现,其中,Cu2+、Zn2+、Pb2+、Cd2+等都是较为常见的重金属污染物[7]。研究表明:重金属对植物体内活性氧代谢系统的平衡起到极其关键的作用[8-9]。植物短期内能够抵抗低浓度的重金属胁迫,但随着胁迫时间的延长和重金属浓度的升高,其生理生长会被严重遏制[10]。
苦草是我国大多湖泊的优势物种,由于其生长繁殖较快、分布较广,对多种重金属的富集效果较高,逐渐成为解决重金属污染问题的先锋物种[11]。Cu2+、Zn2+都是苦草生长的微量元素,低浓度下能够促进其发育生长,但高浓度的Cu2+、Zn2+会影响到苦草对其他营养元素的吸收,打破细胞新陈代谢的平衡[12],进而引发一系列的生理状况,对苦草的健康状况产生严重的影响。本研究通过Cu2+、Zn2+胁迫下苦草的生理生化特性,探讨其响应过程,以期为重金属污染水体的生态修复提供一定的依据。
1 材料与方法
1.1 实验材料
实验所需的苦草和底泥均采自鄱阳湖。将底泥剔除杂物后,均匀地平铺在塑料方盒(长34.0 cm、宽22.5 cm、高10 cm)中,底泥厚8 cm。选取叶片健康、长势健壮的苦草植株,修剪叶片长度为15 cm,根长为3 cm,洗去叶片表面附着物后均匀种植在塑料盒中,每盒12株,然后将塑料方盒放入玻璃缸(长40 cm、宽40 cm、高50 cm)内,加入经过晾晒的自来水至40 cm高度处进行预培养[13],待植株生长状况稳定后用于后期实验。
1.2 实验设计
向玻璃缸中加入不同浓度的CuSO4、ZnSO4溶液分别进行单一及复合胁迫处理,各设置5个处理组(T1、T2、T3、T4、T5)。Cu2+浓度梯度依次为0.2 mg/L、0.4 mg/L、0.6 mg/L、0.8 mg/L和1.0 mg/L,Zn2+浓度梯度依次为2.0mg/L、4.0 mg/L、6.0 mg/L、8.0 mg/L和10.0 mg/L,Cu2++Zn2+复合处理浓度依次为(0.1+1.0)mg/L、(0.2+2.0)mg/L、(0.3+3.0)mg/L、(0.4+4.0)mg/L和(0.5+5.0)mg/L,与此同时,设置浓度为0mg/L的空白对照组(CK),每个处理组设置3个重复。胁迫培养14d后,进行各项指标的测定。
1.3 测定方法
采用氮蓝四唑比色法测定超氧化物歧化酶(Superoxide dismutase,SOD);采用测定过氧化物酶(Peroxidase,POD);采用硫代巴比妥酸比色法测定丙二醛(Malondialdehyde,MDA);采用分光光度法测定光合色素。
1.4 数据处理
实验结果为3次以上平行数据的平均值±标准差,试验原始数据的处理和制图釆用Excel2017,用SPSS19.0软件对数据进行单因素方差分析,采用SNK法进行多重比较分析,P<0.05表示显著差异。
2 结果与分析
2.1 Cu2+、Zn2+不同胁迫对苦草SOD的影响
Cu2+和Zn2+作为有毒重金属,对苦草的生理状况产生了一定的影响。由图1所知,胁迫培养14d,三种处理方式的T1处理组均小于对照组,当Cu2+浓度为0.2mg/L时,SOD值最低。Zn2+处理下的苦草SOD值始终呈显著上升趋势,T5处理组达到最大,对比对照组上升了67.15%,Cu2+单一胁迫的最大值出现在T4处理组为47.35,T5处理组处又呈现明显的降低现象,说明此浓度的重金属胁迫已经超出了苦草的承受范围,对苦草的生长产生一定的抑制性,所以出现先升后降的趋势。
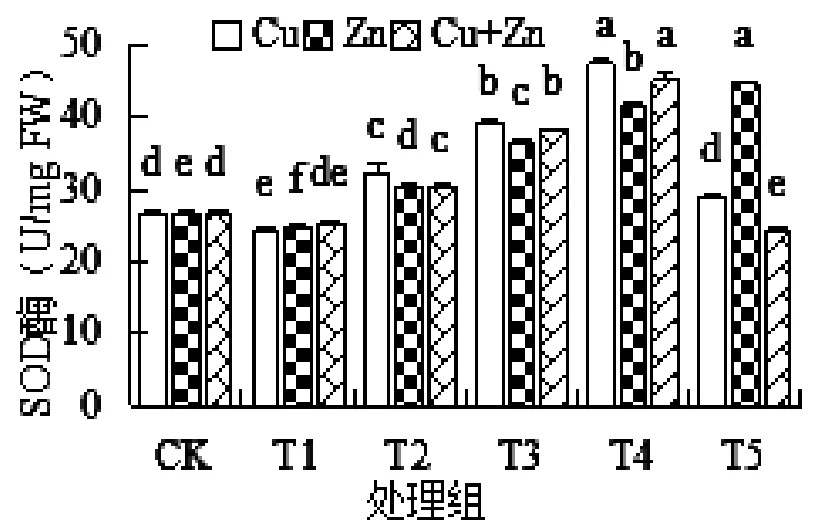
图1 不同浓度重金属胁迫对苦草SOD的影响
Cu2+和Zn2+单一及复合胁迫引起的苦草SOD变化表现出不同的趋势。整体上看,复合胁迫造成的变化程度更大,且复合胁迫与Cu2+单一胁迫产生的变化规律具有一定的相似性,最大值出现在T4处理组中。T1处理组SOD值与两种重金属单一胁迫相差不大,但在较高的浓度中发现,Cu2+胁迫引起的变化幅度最大,其次是复合胁迫,Zn2+胁迫最小。T5阶段SOD值降至最低,甚至小于对照组。三种处理方式对苦草的抑制性表现为:Cu2+胁迫>复合胁迫>Zn2+胁迫。
2.2 Cu2+、Zn2+不同胁迫对苦草POD的影响
如图2所示,Cu2+和Zn2+单一及复合胁迫对苦草POD活性产生显著的影响(P<0.05)。T1处理组中,三种处理方式的POD值均低于CK组,且酶活性相差不大。随着重金属胁迫浓度的升高,Cu2+和Zn2+单一及复合胁迫的POD活性变化趋势基本相同,T1至T5处理组呈现先上升后下降的趋势,且均在T4处理阶段达到最大,分别为30.47、29.98和36.23,而后又出现不同程度的下降,说明T5处理组的重金属浓度过高,已经对苦草POD活性产生了抑制作用。

图2 不同浓度重金属胁迫对苦草POD的影响
整体上来,两种重金属单一胁迫造成的变化相差不大,说明单因素的Cu2+和Zn2+对苦草POD的影响基本相同。复合胁迫的变化幅度较两种单一胁迫更大,说明对苦草的抑制性最高。
2.3 Cu2+、Zn2+不同胁迫对苦草MDA的影响
苦草MDA含量对Cu2+和Zn2+单一及复合胁迫响应如图3所示:三种处理的最小值均出现在T1处理组,分别为7.11、6.97和7.01。Cu2+和Zn2+单一胁迫下始终随浓度的升高而显著增大(P<0.05),且两种处理的变化幅度相差不大,最大值分别为23.67和22.79。
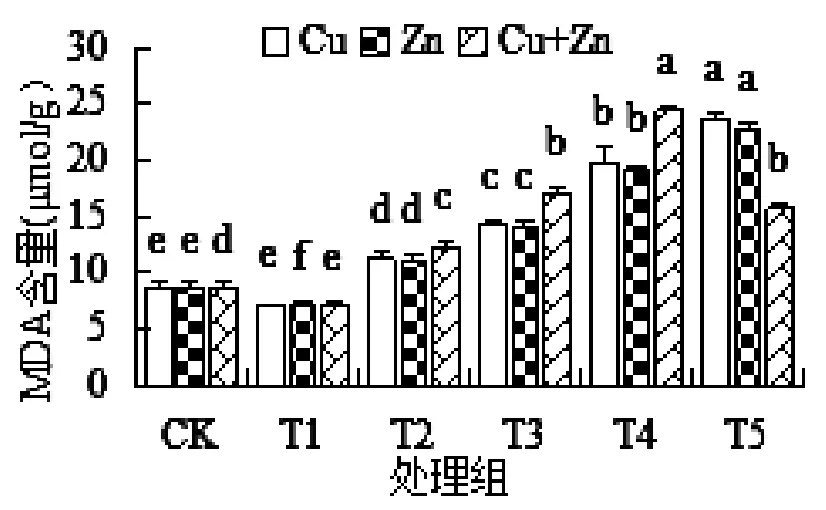
图3 不同浓度重金属胁迫对苦草MDA的影响
复合胁迫下的MDA含量随胁迫浓度的升高呈先上升后下降的趋势,T4处理组达到最大,较CK组上升了184.60%,T5处理中又显著降低,其MDA含量为15.69。三种处理中,复合胁迫对苦草的抑制性最强。
2.4 Cu2+、Zn2+不同胁迫对苦草叶片光合色素含量的影响
叶绿素含量与植物光合作用的能力关系紧密,植物体通过光合作用将体内有机物转化为能量,太阳光为叶绿素供能将CO2转化为碳水化合物[14]。本小节从叶绿素含量变化的角度来说明苦草在重金属胁迫的影响。
三种处理方式的T1处理组叶绿素a+b、叶绿素a、叶绿素b均有所增大,可能是由于Cu2+、Zn2+都是苦草生长所需的微量元素,在一定程度上能够刺激叶绿素的合成,但三种处理的增幅相差不大。随着重金属胁迫浓度的升高,叶绿素a+b、叶绿素a含量显著下降(P<0.05),而叶绿素b含量变化不显著。胁迫14d,T5处理组的叶绿素b均达到最低,Cu2+胁迫下分别为对照组的69.94%、58.81%、90.06%;Zn2+处理分别为对照组的67.55%、61.26%、78.92%;复合胁迫的叶绿素a+b、叶绿素a、叶绿素b分别为对照组的42.43%、30.99%、63.11%。Cu2+、Zn2+复合胁迫的变化幅度比单一胁迫更大,对苦草叶绿素a+b、叶绿素a、叶绿素b的抑制性表现为:复合胁迫>Zn2+胁迫>Cu2+胁迫。
T1到T5阶段,随着Cu2+、Zn2+和复合胁迫浓度的增大,叶绿素a/b呈持续下降趋势,其最小值分别为对照组的65.30%、77.15%、48.24%,说明复合胁迫的降低程度大于单一胁迫,对叶绿素a/b的抑制性表现为:复合胁迫>Cu2+胁迫>Zn2+胁迫。
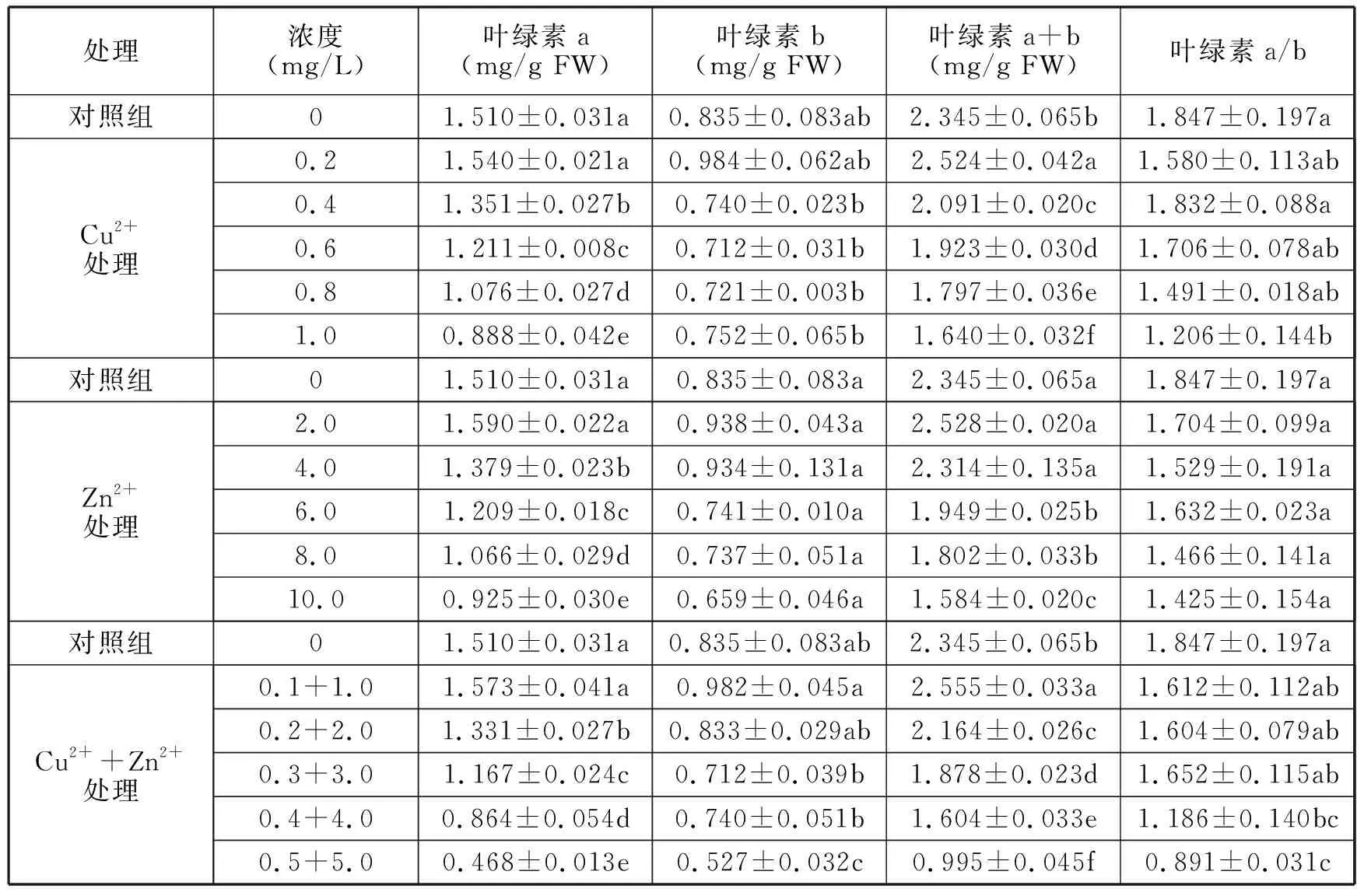
表1 不同浓度Cu2+、Zn2+处理对苦草光合色素指标的响应
3 讨论
目前,关于植物抗氧化酶活性的研究很多。SOD、POD、MDA是植物防御系统的重要组成部分,对维护植物保护酶系统发挥重要的作用[15]。当植物受到外界条件干扰时,酶活性平衡被破坏,会产生过多的O2-、H2O2、OH,然后进一步加快膜脂过氧化进程,降低植物体的膜系统完整性[16]。研究表明:外界环境的胁迫会造成植物体电解质和小分子有机物外渗,导致细胞内外物质交换的平衡受到影响,进而影响正常的细胞生理代谢功能[17]。SOD在提高植物抵抗逆境方面有重要的作用。一般情况下,重金属的毒害导致植物体内产生过多的O2-,为消除这种影响,植物本身通过提高SOD酶活性来催化转化O2-为H2O2,保护细胞免受损伤[18],因此植物SOD活性随重金属的升高而逐渐增大,本研究中,苦草胁迫培养14d中,T1至T4处理阶段的SOD活性确实符合这一特征,而T5处理组中的Cu2+单一胁迫和复合胁迫却呈下降趋势,这可能是由于重金属的胁迫已经超出了苦草的耐受力,抑制了植物本身的酶活性,所以出现了SOD先升后降的现象。Cu2+、Zn2+都是植物生长所需的元素,能够参与其正常的生理活动,有利于细胞内外的细胞物质交换[19],这也是三种处理的T1处理组SOD值均略低于对照组的原因。另外,可能是由于Zn2+的存在降低了Cu2+对苦草的伤害,缓和了部分重金属的影响,导致三种处理方式对苦草的抑制性表现为:Cu2+胁迫>复合胁迫>Zn2+胁迫。
POD催化H2O2分解成H2O和O2[20],其受重金属胁迫变化规律与SOD非常类似,在实验前期随重金属的升高而显著增大,但在高浓度的影响下却开始降低。本研究中,三种胁迫的T5处理组中均有观察到POD显著下降的现象,说明高浓度的重金属胁迫破坏了正常的酶功能,导致酶系统清除活性氧的能力减弱,H2O2和O2-等大量积累,引发细胞正常生理功能混乱,与SOD降低的原因相似,这里和计汪栋[21]等人的研究结果符合得很好。MDA含量代表细胞膜被氧化的程度[22],用来反映植物逆境或衰老过程膜脂的破坏程度,含量越高表明植物受抑制的程度越严重[23]。MDA含量过高或过低都可能对植物的光合作用造成影响[24]。本实验中苦草的MDA含量随重金属浓度的升高呈显著上升趋势,说明苦草的生命活动受重金属抑制情况明显加重。徐勤松[25]等人的研究成果也证实重金属能导致植物体内膜脂过氧化产物(MDA)明显上升。T5处理组中Cu2+和Zn2+单一胁迫下的MDA值达到最大,但复合胁迫却使得其活性降低,可能是由于此两种重金属之间的相互作用导致MDA酶活性受影响程度明显增加,进而导致植物体本身的酶保护系统遭到破坏,因此T5处理组中的MDA含量明显降低。三种抗氧化酶活性中,除SOD外,POD和MDA的复合处理所造成的影响较两种重金属单一胁迫更大,其次是Cu2+单一胁迫,Zn2+产生的影响最小,可能由于Cu是非常活跃的氧化还原型过渡金属元素,它能吸收或释放一个电子(Cu2+/Cu+),从而产生自由基导致损伤[26],而Zn的化学性质比Cu要弱的多。
叶绿素a和叶绿素b对苦草光合作用的进行都具有重大帮助。叶绿素a+b能够反映植物叶片光合活性的强弱,代表对光能的利用率[27]。本研究中,叶绿素a+b、叶绿素a、叶绿素b的T1处理组各叶绿素含量略高于对照组,其原因可能是少量的Cu2+、Zn2+都能够有助于合成叶绿素。T1到T5处理组中各叶绿素含量指标随重金属胁迫浓度的升高而显著降低,在实验中也可以看到苦草叶片表面明显失绿的现象。有学者认为重金属离子与叶绿体蛋白上的巯基结合[28],破坏了叶绿体的基本结构;此外,重金属还能够与某些合成叶绿素的酶(原叶绿素酸酯还原酶和胆色素原脱氨酶)相结合,使得酶活性大幅下降,阻碍了叶绿素的合成[29]。本研究中,叶绿素a比叶绿素b下降更快,说明叶绿素a对重金属更敏感。Cu2+、Zn2+对苦草叶绿素a+b、叶绿素a、叶绿素b的抑制性表现为:复合胁迫>Zn2+胁迫>Cu2+胁迫。Ca/Cb始终呈下降趋势,说明两种重金属都能加速苦草叶片的衰老,且复合胁迫的降低幅度最大,Zn2+单一胁迫变化程度最小。就对苦草抑制性而言,复合胁迫>Cu2+单一胁迫>Zn2+单一胁迫。
4 结论
Cu2+、Zn2+单一及复合胁迫对苦草的抗氧化酶活性和叶绿素含量均能产生抑制作用。
除SOD活性外,三种胁迫对苦草POD、MDA和各叶绿素含量的抑制效果表现为协同作用。
