苦草对底泥中重金属铜的生理响应
2021-01-05潘倩羽杨润昭康彩霞
潘倩羽 杨润昭 李 俊 康彩霞
(华东交通大学土木建筑学院,江西 南昌 330013)
引言
沉水植物是水生态系统中重要的初级生产力,对水体中的重金属和氮磷都有良好的富集效果[1-4],但近年来随着经济的高速发展,鄱阳湖各入湖河流收纳了大量的城镇生活污水和工农业废水,输入了较多的营养盐和重金属物质,导致了鄱阳湖水质的恶化[5],而过量的重金属也会对沉水植物造成严重生理胁迫。目前对鄱阳湖的水质研究主要集中在富营养化,调查中发现龙口近年来受频繁的采砂活动影响甚严重,加剧了湖区的重金属污染,在相关文献中也提到鄱阳湖主要入湖口重金属元素呈复合污染,其中沉积物中重金属Cu污染程度最高[6],而底泥中可提取态的重金属占总量比例越高,重金属越易释放造成二次污染[7]。鄱阳湖区土壤中Cu含量分布差异较大,最高值为342.54mg/kg,位于蔡家湾。最低值为6.83mg/kg,位于都昌[8]。目前相关研究表明,60μM Cu2+能抑制拟南芥合成生长素的吲哚-3-丙酮酸途径中TAA1和YUCCA家族基因的表达,从而使得根尖生长素含量减少,抑制主根生长[9];在相同处理时间条件下,随着铜浓度的增大,柠檬香蜂草的SOD以及叶绿素含量均表现低促高抑的趋势[10];Cu2+浓度为≤200mg/kg可促进香椿的生长,随着Cu2+浓度的升高,可溶性蛋白含量先降低后升高而后又下降[13]。重金属Cu是植物必需的微量元素之一,是一些酶(如多酚氧化酶、抗坏血酸氧化酶、细胞色素氧化酶、超氧化物歧化酶(SOD)、过氧化物酶(POD))的成分,可以影响氧化还原过程,还存在于叶绿体的质体蓝素中,参与光合作用的电子传递体系,对植物的生长发育起着十分重要的作用[11]。目前研究表明,鄱阳湖湿地沉水植物以苦草为广布种,但近年来的鄱阳湖水质监测数据显示,各区域水质呈下降趋势,一定程度上导致了沉水植物的减少[12]。本实验以苦草为实验材料,着重研究其对底泥中重金属铜的生理响应,旨在为近年来鄱阳湖水生态系统沉水植物的保护提供依据,并为进一步探索沉水植物对重金属污染的早期预警和耐性机理提供参考。
1 材料与方法
1.1 实验材料
苦草(Vallisneria Asiatica)冬芽于一月上旬采自鄱阳湖,带泥培养在鄱阳湖星子站湿地实验室中。存储一段时间,待发芽后一个半月,选取长势良好且一致的植株,用自来水冲洗干净,染毒前一周对其驯化。底泥采自鄱阳湖星子站未受重金属污染泥土,过2 mm孔径筛,混合均匀备用。
1.2 实验设置
实验设置在潘阳湖星子站室外,将苦草水深环境设为1.5m,并设置三组平行实验。每组底泥分别加入CuSO4·5H2O,使底泥中w(Cu)分别为50mg/kg,80mg/kg,150mg/kg,250mg/kg。为防止底泥中的重金属进入上部覆水,在每个塑料桶底泥表面平铺2cm细沙。每个塑料桶种6株苦草,用尼龙绳将这些塑料桶分别固定于两个2m×2m×2m的水池。实验从2018年6月11日开始,计为0d采样,在第19d结束试验并采样。实验期间采用自然光照,排除光照不足,病虫害等因素对苦草生长的影响。取样的植株洗净后,用纸擦干植物表面水分,取每株相同部位的苦草叶片,测定叶片叶绿素a,过氧化物酶(POD)比活力,超氧化物歧化酶(SOD),可溶性蛋白含量(SP)。
从样品剪取苦草叶片,称取约0.2g叶片组织,放入冰水预冷的研钵中,以液氮冷冻,加入1 mL的50 mmol·L-1PBS(磷酸缓冲盐溶液 Phosphate buffer saline)(pH 7. 8)研磨均匀,再加入3 mL上述PBS缓冲液,倒入4 mL离心管,于4 ℃条件下12 000xg离心20 min,上清液即为粗酶提取液。
SOD活性测定采用氮蓝四唑(NBT)光化还原法[13]。在3mL反应液中含有130mmol/L甲硫氨酸、750μmol/L NBT、20μmol/L 核黄素、100 μmol/L EDTA-2Na、50mmol/L 磷酸缓冲液(pH7.5)、待测酶液(空白以缓冲溶液代替,以不对照光的管作调零),在4000lx光下照射20min后,NBT光化还原产物蓝色甲腙在560 nm有最大吸收,在此条件下,反应被抑制50%所需酶量为1个活力单位。
POD活性测定采用愈创木酚法。该方法参照Tsibris[14]等人的方法,将2.3mL的10 mmol/L Tris-HCl缓冲液(内含0.50mol/L CaCl)、0.5mL的78 mmol/L愈创木酚和0.1mL的待测酶液样品充分混合,最后加入0.2mL的4.5mmol/L H2O2溶液,反应3 min,在波长470 nm 处测定吸光度值。吸光度值每分钟变化0.01个单位记为1U。
可溶性蛋白(SP)含量测定采用考马斯亮蓝G-250染色法。该方法参照王艾平,周丽明[15]的优化方法,取待测液1.0mL,加入考马斯亮蓝G-250溶液(0.01%)4.0mL,以蒸馏水补至总体积为10.0mL,混匀,25℃条件下放置35min,于595nm处测定其吸光度。
叶绿素含量测定采用分光光度法。取1g样品,加入10 mL纯丙酮及少许CaCO3(中和酸性,防止叶绿素酯酶分解叶绿素)和石英砂,研磨成匀浆后转入离心管,用适量80%丙酮洗涤研钵,定容15ml后,取4ml(5ml,或10ml也行)离心。12000 xg离心10 min。取上清液(色素提取液)1.5 mL,加80%丙酮1.5 mL,空白为80%丙酮,测定663nm、645nm处的吸光度A663、A645。
1.3 统计分析方法
各指标测定结果均以平均值±标准误差表示。使用SPSS软件(SPSS 19.0 for Windows)对同一染毒时间各处理组与对照组之间某指标平均值进行方差分析(one-way ANOVA,LSD检验)。
2 结果与分析
2.1 不同Cu2+浓度对苦草生长影响
由表1可知,在铜离子浓度小于80mg/kg时,苦草叶片逐渐变宽,长势逐渐良好。当铜离子为150mg/kg时新生叶片较少,颜色深绿。在铜离子为250mg/kg时植株矮小。

表1 不同铜离子浓度下苦草的生长状况
2.2 不同Cu2+浓度对苦草叶片叶绿素含量的影响
由图1可知,实验过程中苦草叶片中叶绿素随Cu2+浓度增加先出现上升,然后下降恢复正常稳定值。当Cu2+浓度处于50mg/kg时叶绿素量达到最大值,随后叶绿素量随着Cu2+浓度的增加逐渐下降最终趋于稳定。

图1 不同铜离子浓度下苦草的叶绿素含量
2.3 不同Cu2+浓度对苦草叶片可溶性蛋白含量的影响
由图2可知,苦草叶片中可溶性蛋白含量(SP)随着Cu2+浓度的增加先增加最后逐步下降,在Cu2+浓度为80mg/kg时达到最大值,随后可溶性蛋白含量(SP)随着Cu2+浓度增加逐渐降低。
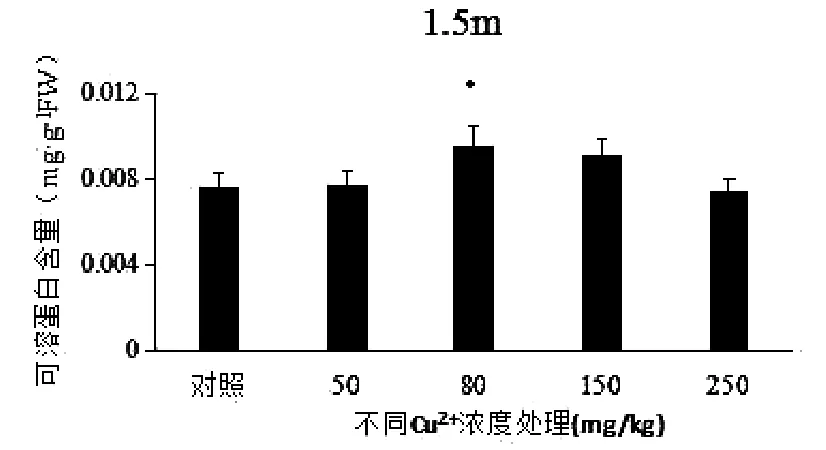
图2 不同铜离子浓度下苦草的可溶性蛋白含量
2.4 不同Cu2+浓度对苦草叶片POD含量的影响
由图3可知,随着 Cu2+浓度增加,苦草叶片中POD含量逐渐增加,但过量Cu2+浓度又会使POD含量降低。Cu2+浓度为150mg/kg时POD含量达到最大值,随后POD含量开始随着Cu2+浓度的增加而下降。由此可见,低浓度Cu2+对苦草叶POD 产量有所提高,高浓度有所抑制。
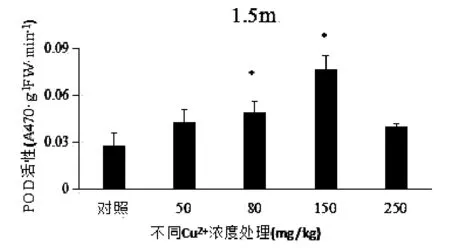
图3 不同铜离子浓度下苦草的POD活性
2.5 不同Cu2+浓度对苦草叶片SOD含量的影响
由图4可知,随着Cu2+浓度增加,SOD含量增加,当 Cu2+浓度为80mg/kg和Cu2+浓度为150mg/kg时SOD含量达到最大值并基本保持不变,随后在Cu2+浓度为250mg/kg时SOD含量下降。由此可见,低浓度Cu2+对苦草叶SOD 产量有所提高,高浓度有所抑制。

图4 不同铜离子浓度下苦草的SOD活性
3 讨论
Cu是植物有机体必需的一种金属元素,微量的Cu对生物体有积极作用,如Cu存在于叶绿体的质体蓝素中,参与光合作用的电子传递体系,对植物的生长发育起着十分重要的作用,并且作为SOD的重要辅基,Cu对清除氧自由基以保护细胞有重要作用[16],可见,低浓度Cu2+有助于植物的生长。从实验分析来看,在低浓度Cu2+环境下,Cu2+参与光合作用电子传递体系[16],苦草的生长可以得到促进。在本实验中,SOD和POD的活性出现一定程度的升高,这是植物体的保护性反应,能有效地清除毒害所产生的活性氧。但抗氧化能力有限,一旦Cu2+浓度过高,活性氧的动态平衡被打破,产生了大量剩余活性氧,则其对苦草就会造成氧化损伤,苦草光合作用功能下降[17],叶绿素、可溶性蛋白含量较对照组含量而言都有所下降,这说明高浓度Cu2+会对苦草产生胁迫,影响苦草生长。
3.1 苦草的代谢反应
经过19d处理后,苦草内叶绿素含量有小幅度上升,表明低浓度Cu2+可促进苦草生理代谢。但当Cu2+浓度处于较高阶段,叶绿素含量骤然下降,且与对照组叶绿素含量相比,有所下降。铜是一些金属蛋白酶(例如:SOD、POD)的结构元素,其参与植物重要的生物过程,如光合作用、呼吸、氧化超氧化物清除等,但过量的铜会导致植物生物量减少、生长发育迟缓,甚至引起萎黄病和坏死[18]。实验结果表明高浓度Cu2+会抑制苦草新陈代谢。光合作用是植物体内较为重要的代谢过程,其强弱对植物生长及抗逆性具有十分重要的影响,并且叶绿素的高低在很大程度上反映了植物的生长状况和光合作用效率[19]。铜作为植物生命活动的微量元素,当其浓度较低时能够促进光合作用,反之则抑制。过量的铜会改变叶绿体或类囊体的结构,甚至会导致植物生物量减小,细痩萎黄,铜和D1蛋白的络氨酸残基相结合,可抑制光系统II(PSⅡ)的电子传递[20],或导致细胞色素b559氧化还原端的改变[21],光合作用所储存的能量减少,光合电子传递降低,导致生物量减少[22],铜胁迫使叶绿素含量大幅下降,24 h内使初始荧光(Fo)和最大荧光(Fm)升高,特别是Fm可能出现负值,表明光合器官己受到破坏[23],致使光合作用效率降低、叶绿素含量下降。植物新陈代谢所涉及到的酶大多属于蛋白质,而本实验所测的可溶性蛋白含量在低浓度Cu2+环境下会有一定幅度的上升,但随着Cu2+浓度处于较高阶段时,植物体内可溶性蛋白含量逐步下降,说明在高浓度Cu2+环境,苦草受到了重金属胁迫。
3.2 苦草的抗氧化反应
铜是一种具有氧化还原性的金属,Cu2+过量后表现为高毒性,会对植物体产生氧化胁迫,形成有害的活性氧(ROS),破坏细胞膜的结构和功能,同时催化芬顿(Fenton)反应生成羟基自由基,导致脂类、蛋白质和DNA损害[24],导致植物出现生物量减少、根系生长受抑制及萎黄病、烫伤、坏死等症状[25]。但植物可通过过酶和非酶抗氧化系统保护其自身免受氧化损伤,其中用于清除ROS的酶包括SOD和POD等,它们分布在植物细胞的不同位点上,相互协作清除体内ROS[9]。本实验中铜处理后苦草中SOD含量以及POD含量随着Cu2+浓度的增加不断上升,但当Cu2+浓度处于250 mg/kg时二者含量下降。该情况说明,在胁迫条件下时,植物体ROS的产生和清除平衡遭到破坏,加速了ROS的积累,进而影响植物正常的生长发育。植物通过调节体内的抗氧化物酶系抵抗Cu2+胁迫,当Cu2+浓度超过植物耐铜阈值时,其抗氧化物酶系被破坏。
4 结论
通过上述分析得出,在高浓度Cu2+环境,苦草会受到重金属胁迫,但其可提高SOD、POD等活性来抵御胁迫。同时苦草SOD含量受Cu2+浓度影响较为明显,在Cu2+浓度升高的每一个阶层,SOD含量的增幅较大。因此,相较于一般沉水植物胁迫研究中,选用SPD比活性指标来衡量植物胁迫程度更具时效性,可作为进一步探索沉水植物对重金属污染的早期预警。但当Cu2+浓度超过植物耐铜阈值时,其抗氧化物酶系被破坏,对苦草生长产生一定损伤。因此,在工农业经济不断发展的同时,合理回收利用重金属对鄱阳湖生态系统的保护具有重要意义。
