脑白质高信号伴认知功能障碍患者胆碱能通路损伤与皮质结构改变的关系研究
2021-01-05王诗男王金芳石庆丽李越秀陈红燕张玉梅
王诗男 王金芳 石庆丽 李越秀 陈红燕 张玉梅
脑白质高信号(WMH)是脑小血管病(cSVD)最为常见的影像学表现之一[1],与血管性认知损害(VCI)关系密切[2]。业已证实,单基因遗传性血管性认知损害性病变——常染色体显性遗传性脑动脉病伴皮质下梗死和白质脑病(CADASIL)患者存在胆碱能神经元缺失和胆碱能活性降低[3]。由此推测,胆碱能系统损害可能在脑白质高信号伴认知功能障碍的发病中起关键作用。关于MRI 显示的脑白质高信号程度,目前主要采用各种视觉量表(如Fazekas 量表、Scheltens 量表、Ylikoski 量表和Manolio量表)进行评价[4],并通过多模态MRI[5]为脑白质高信号导致的脑结构改变提供更直观的影像学证据。胆碱能系统至大脑皮质的投射主要由Meynert基底核胆碱能神经元(nbM⁃Ch4)发出,通过结构性MRI 可以观察到认知功能障碍导致的大脑皮质兴趣区(ROI)结构改变[6]。我们课题组的前期研究显示,脑白质高信号伴执行功能下降与胆碱能通路损伤相关[7],本研究继续探讨脑白质高信号致胆碱能通路损伤伴不同程度认知功能障碍时大脑皮质结构变化特点,以明确二者之间相关性。
对象与方法
一、研究对象
1.纳入标准 (1)符合脑白质高信号的影像学诊 断标准[8]:T2WI 或FLAIR 成 像所见脑白 质信号增高区域集中分布于脑室周围(紧邻脑室系统)和脑深层组织(位于皮质下且不与脑室相邻)。(2)年龄50 ~80 岁。(3)右 利 手。(4)Hachinski 缺 血 评 分(HIS)≥7 分。(5)汉密尔顿抑郁量表(HAMD)评分<8 分,汉密尔顿焦虑量表(HAMA)评分≤7 分。(6)本研究涉及内容由首都医科大学附属北京天坛医院道德伦理委员会审查,符合《世界医学协会赫尔辛基宣言》和《涉及人的生物医学研究伦理审查办法》的要求(审批号:KY2019⁃011⁃02),入选病例及其家属对检查项目知情并签署知情同意书。
2.排除标准 (1)头部CT 和(或)MRI 提示孤立性关键部位大面积脑梗死、陈旧性梗死、脑微出血(CMBs)、皮质萎缩等其他脑血管病。(2)阿尔茨海默病(AD)、帕金森病(PD)、额颞叶痴呆(FTD)或亨廷顿病(HD)等神经变性病致认知功能障碍。(3)意识障碍、严重听力和视力障碍、失语、优势侧偏瘫等影响认知功能的疾病,以及24 h 内服用过影响认知功能的药物。(4)颅脑创伤(TBI)、脑肿瘤、中枢神经系统感染性或代谢性疾病、正常压力脑积水、血清叶酸或维生素B12缺乏、甲状腺功能减退症等导致的痴呆。(5)存在颅脑创伤史、癫发作史或特殊药物服用史,或者既往6 个月内确定为酒精或药物依赖。(6)有严重内科疾病,如心脏、肺、肝脏、肾脏功能障碍,重度内分泌性、感染性、中毒性脑病,严重胃肠道疾病,肿瘤等。(7)有精神病史、先天性精神发育迟缓或严重焦虑、抑郁等。(8)存在心脏起搏器、神经刺激器、人工金属心脏瓣膜、体内顺磁性金属异物、严重幽闭恐怖症、重度高热等MRI 检查禁忌证。
3. 一般资料 (1)脑白质高信号组:共选择2016 年3 月至2018 年12 月在首都医科大学附属北京天坛医院门诊或住院治疗的80 例脑白质高信号患者,其中男性43 例,女性37 例;年龄50 ~80 岁,平均 为(64.00 ± 0.57)岁;体 重 指 数(BMI)19.03 ~38.21 kg/m2,平均为(23.25 ± 0.51)kg/m2;受教育程度0 ~18 年,平 均 为(8.66 ± 0.31)年;病 程4.20 ~17.50 年,平均(8.19±0.45)年。参照美国国立神经病学与卒中研究所⁃瑞士神经科学研究国际协会(NINDS ⁃ AIREN)非 痴 呆 型 血 管 性 认 知 损 害(VCIND)和血管性痴呆(VaD)标准[9],分为脑白质高信号不伴认知损害组(WMH⁃CN 组)、脑白质高信号伴非痴呆型血管性认知损害组(WMH⁃VCIND 组)和脑白质高信号伴血管性痴呆组(WMH⁃VaD 组)。(2)正常对照组(对照组):以同期在我院行体格检查的30 例健康志愿者作为正常对照者,头部MRI 正常,临床痴呆评价量表(CDR)评分为零,蒙特利尔认知评价量表(MoCA)评分≥26 分。男性15 例,女性15 例;年龄50 ~80 岁,平均(59.46±0.68)岁;体重指数18.02 ~32.20 kg/m2,平均(24.21±0.23)kg/m2;受教育程度0 ~13 年,平均(10.92±0.40)年。
二、研究方法
1.临床数据收集 所有患者均于入组当日详细记录性别、年龄、体重指数、受教育程度、既往史(高血压、糖尿病、脂质代谢紊乱、冠心病、房颤、脑血管病)、吸烟史和饮酒史等一般资料。
2.认知功能评价及亚组分组 (1)认知功能评价:由经过专业培训的神经内科医师进行认知功能评价。①MoCA 量表,为认知功能障碍初筛量表,测试项目包括视空间与执行功能(5 分)、命名(3 分)、注意力(6 分)、语言复述(2 分)、词语流畅性(1 分)、抽象思维(2 分)、延迟回忆(5 分)、定向力(6 分)共计8 个认知域,总评分30 分,评分<26 分为认知功能障碍,对于受教育程度≤12 年的患者,评分+1 分以校正受教育程度的偏倚。②CDR 量表,用于评价认知功能障碍严重程度,包括记忆力、定向力、判断和解决问题能力、社会事务、家庭生活业余爱好、个人照料共6 项内容,总评分3 分,评分为零,认知功能正常;0.50 分,可疑认知功能障碍;1 分,轻度认知功能障碍;2 分,中度认知功能障碍;3 分,重度认知功能障碍。(2)亚组分组:①WMH⁃CN 组,MRI 可见脑白质高信号,CDR 评分为零、MoCA 评分≥26 分。②WMH⁃VCIND 组,MRI 有脑白质高信号表现,CDR评分0.50 分、MoCA 评分<26 分。③WMH⁃VaD 组,MRI 有脑白质高信号表现,CDR 评分≥1 分,MoCA评分<26 分。
3.头部MRI 检查 所有患者就诊1 周内均行头部MRI 检查,采用德国Siemens 公司生产的Magnetom Trio Tim 3.0T MRI 扫描仪,扫描序列包括T1WI、T2WI、T2⁃FLAIR 成像,并由两位影像科医师共同完成结果判读。据MRI 图像判断是否存在脑白质高信号,在T2⁃FLAIR 成像上采用胆碱能通路高信号评分(CHIPS)评价胆碱能通路中脑白质高信号程度。(1)T1WI/T2WI:重复时间(TR)3500 ms/4800 ms、回波时间(TE)为270 ms/280 ms、反转时间(TI)为2800 ms,反转角(FA)8°,扫描视野(FOV)256 mm×256 mm×190 mm,矩阵256×256,体素大小1 mm×1 mm×1 mm 各向同性,层厚5 mm、层间距0.50 mm,扫描时间5 min/6 min,共20 层/25 层,范围覆盖顶叶至延髓。(2)T2⁃FLAIR 成像:重复时间4600 ms、回波时间280 ms、反转时间2800 ms,扫描视野256 mm×256 mm×190 mm,矩阵256×256,体素大小1 mm×1 mm×1 mm 各向同性,层厚3 mm、层间隔0.50 mm,扫描时间6 min,共25 层,扫描范围覆盖顶叶至延髓。(3)CHIPS 量表:以胆碱能通路免疫组化标记为基础,通过MRI 重叠分析技术进行分区,双侧大脑半球在第三脑室和侧脑室层面的4 个横断面图像共分为10 个脑区,包括内侧通路(扣带回白质)和外侧通路(外囊和半卵圆中心),每区分别评分,0 分,无脑白质高信号;1 分,轻度脑白质高信号(脑白质高信号体积<该区域的50%);2 分,重度脑白质高信号(脑白质高信号体积≥该区域的50%)。各脑区分评分乘以各自权重即为CHIPS 总评分[10](表1)。
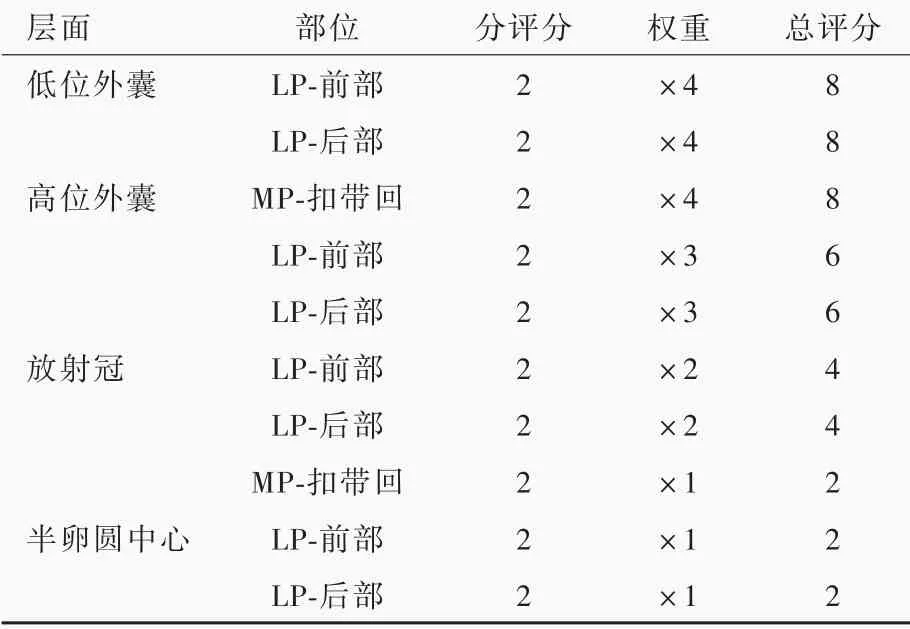
表1 CHIPS 评分标准[10]Table 1. Standard of CHIPS[10]
4.兴趣区标记 (1)标记方法:在所获得的大脑皮质表面结构性MRI 数据基础上,标记胆碱能通路相关大脑皮质兴趣区。首先,分别对每次扫描头动、扫描强度行平均化校正和标准化,以FreeSurfer软件包[11]重新标记体素1 mm×1 mm×1 mm 的各向同性;然后通过颅骨剥离算法剔除图像中的颅骨;最后展开分割图像,识别大脑皮质背部、腹部、侧部灰质与白质之间的界限。采用自动测算软件RSD和BTQ[12]重新检验剔除颅骨的质量,以及划分灰质与白质界限的精确性,上述步骤中的拓扑缺陷自动校正;最后采用自动测算模型球面折叠变形程序[13]标记双侧大脑半球皮质表面的兴趣区,对灰质表面沟回解剖结构的每个标记点进行概率分配,对大脑皮质与球面之间的测算变形率进行最小化处理,并采用球面多尺度梯度下降式的平均化校准方法进行测量。(2)胆碱能通路中兴趣区:胆碱能通路共标记34 个大脑皮质兴趣区,分别包括内侧通路(前喙扣带回、后扣带回、尾侧前扣带回、扣带回峡部)、外侧通路(中央后回、中央前回、旁中央回);额极、内侧前额叶、眶额中部、额中回上部、额中回下部、额下回眶部、额上回、岛盖部、三角部;嗅皮质、海马旁回、颞上沟两侧区域、颞上回、颞中回、颞下回、颞极、颞横回;枕叶外侧、旁距状回、楔状叶、舌回、梭状回;顶上小叶、顶下小叶、缘上回、楔前叶、脑岛(图1)。(3)评价指标:全脑、左侧和右侧大脑半球CHIPS 评分,左侧和右侧大脑半球皮质兴趣区层厚和体积,以及左侧和右侧大脑半球CHIPS 总评分与相应兴趣区层厚和体积的相关性。
5. 统计分析方法 采用SPSS 24.0 统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验或Fisher 确切概率法。呈正态分布的计量资料以均数± 标准差(±s)表示,行单因素方差分析,两两比较行LSD⁃t 检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Kruskal⁃Wallis 检 验(H 检验),两两比较行Wilcoxon 秩和检验。左右两侧大脑半球CHIPS 总评分与同侧皮质兴趣区层厚和体积的相关性采用Spearman 秩相关分析和偏相关分析。以P ≤0.05 为差异具有统计学意义。
结 果
本组80 例脑白质高信号患者分为WMH⁃CN 组(43 例)、WMH⁃VCIND 组(21 例)以及WMH⁃VaD 组(16 例),不同亚组患者一般资料的比较差异无统计学意义(均P >0.05,表2),均衡可比。
不同亚组患者全脑(P=0.023)、左侧大脑半球(P=0.039)和右侧大脑半球(P=0.004)CHIPS 评分差异具有统计学意义,其中,WMH⁃VCIND 组(P =0.002,0.000,0.001)和WMH⁃VaD 组(P = 0.000,0.003,0.000)患者上述3 个脑区CHIPS 评分均高于WMH⁃CN 组,而WMH⁃VaD 组3 个脑区CHIPS 评分则高于WMH⁃VCIND 组(P=0.008,0.013,0.020;表3,4)。
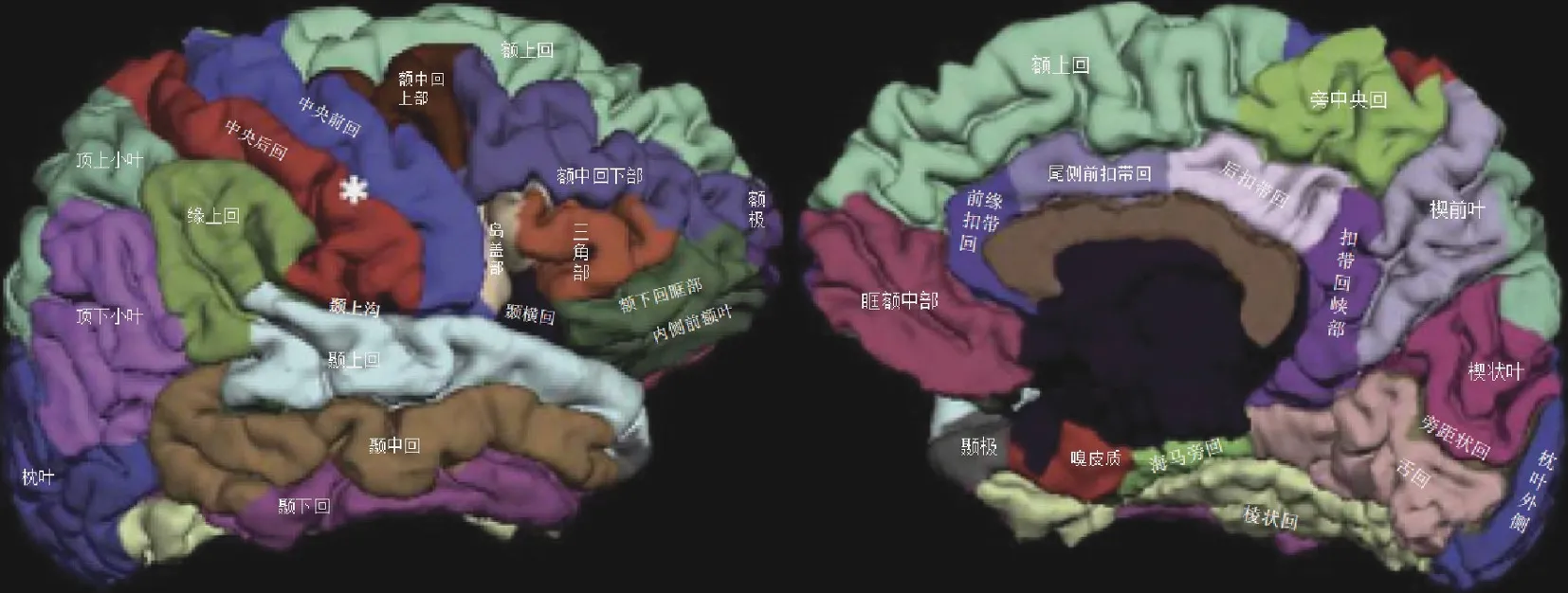
图1 胆碱能通路兴趣区模式图Figure 1 Pattern of ROIs in cholinergic pathway.
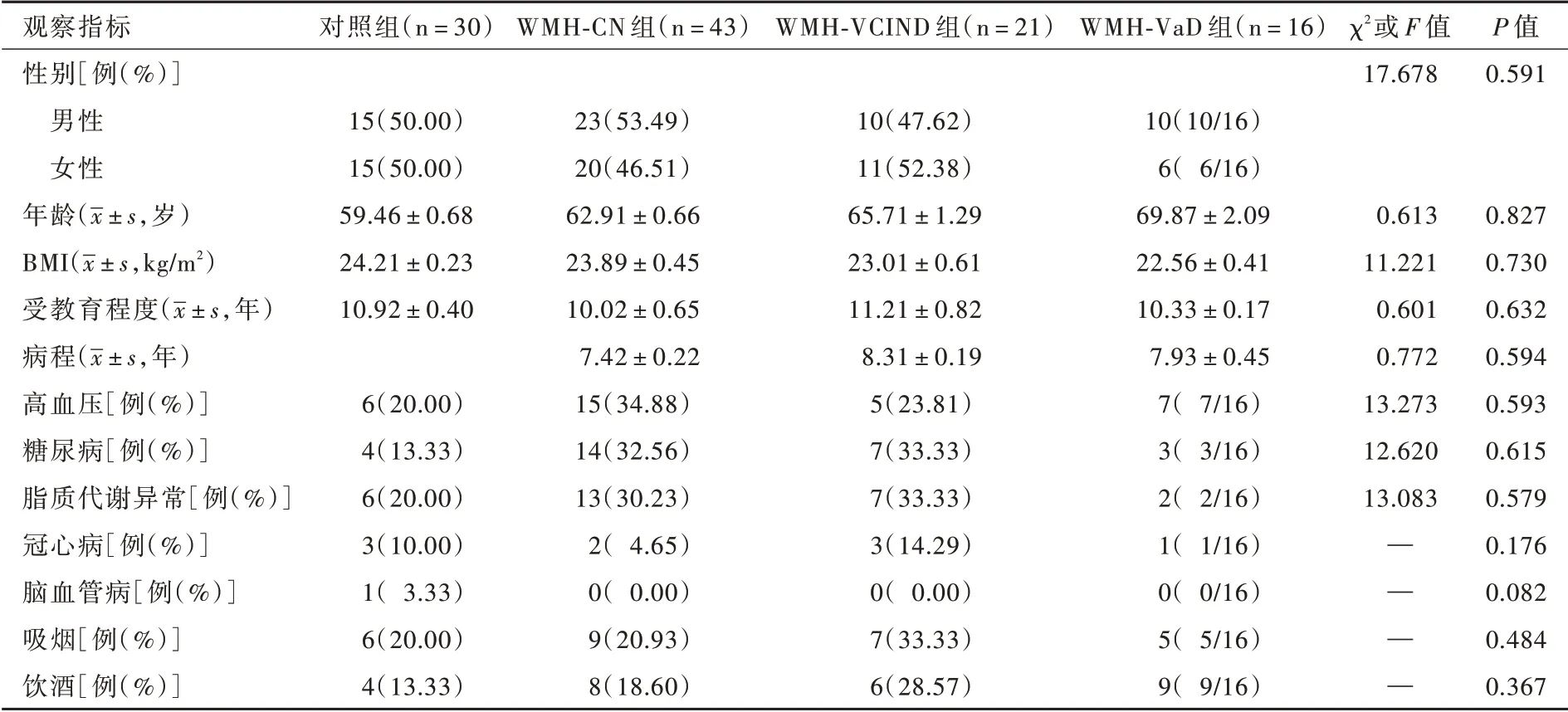
表2 脑白质高信号组与对照组受试者社会人口学资料的比较Table 2. Comparison of general data between WMH patients and normal controls
脑白质高信号患者与正常对照者左侧大脑半球皮质兴趣区层厚(P=0.000)和体积(P=0.000)、右侧大脑半球皮质兴趣区层厚(P=0.000)差异均有统计学意义,而右侧大脑半球皮质兴趣区体积差异无统计学意义(P = 0.291,表5)。其中,WMH⁃CN组、WMH⁃VCIND 组和WMH⁃VaD 组左侧大脑半球皮质兴趣区层厚(均P = 0.000)和体积(均P =0.000)、右侧兴趣区层厚(均P=0.000)均低于对照组;WMH⁃VaD 组左侧兴趣区层厚高于WMH⁃CN 组(P=0.000)和WMH⁃VCIND 组(P=0.036),WMH⁃CN组左侧兴趣区体积高于WMH⁃VCIND 组(P =0.033)、低于WMH⁃VaD 组(P=0.025),WMH⁃VCIND组(P=0.001)和WMH⁃VaD 组(P=0.000)右侧兴趣区层厚均高于WMH⁃CN 组(表6,图2 ~5)。
Spearman 秩相关分析仅WMH⁃VCIND 组患者左侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚呈正相关(P=0.049),其余各亚组无论左侧还是右侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积均无关联性(P >0.05;表7,8);进一步的偏相关分析支持上述结论(表9,10)。
表3 脑白质高信号各亚组患者胆碱能通路CHIPS 评分的比较(±s,评分)Table 3. Comparison of CHIPS scores in cholinergic pathway among WMH subgroups (±s, score)
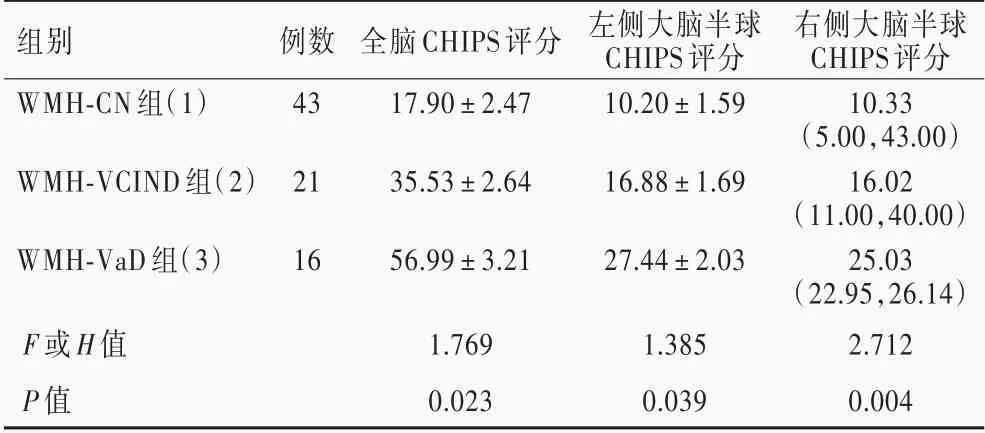
表3 脑白质高信号各亚组患者胆碱能通路CHIPS 评分的比较(±s,评分)Table 3. Comparison of CHIPS scores in cholinergic pathway among WMH subgroups (±s, score)
Kruskal⁃Wallis test for comparison of CHIPS of right hemisphere, and one⁃way ANOVA for comparison of others,右侧大脑半球CHIPS 评分的比较行Kruskal⁃Wallis 检验,其余各项指标的比较行单因素方差分析。CHIPS,Cholinergic Pathways Hyperintensities Scale,胆碱能通路高信号评分;WMH,white matter hyperintensity,脑白质高信号;CN,cognitive normal,认知功能正常;VCIND,vascular cognitive impairment⁃no dementia,非痴呆型血管性认知损害;VaD,vascular dementia,血管性痴呆
右侧大脑半球CHIPS 评分10.33(5.00,43.00)16.02(11.00,40.00)25.03(22.95,26.14)2.712 0.004组别WMH⁃CN 组(1)WMH⁃VCIND 组(2)WMH⁃VaD 组(3)例数43 21 16全脑CHIPS 评分17.90±2.47 35.53±2.64 56.99±3.21左侧大脑半球CHIPS 评分10.20±1.59 16.88±1.69 27.44±2.03 F 或H 值P 值1.769 0.023 1.385 0.039
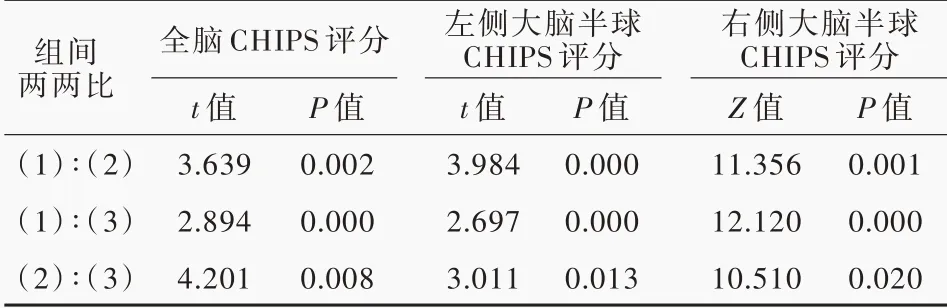
表4 脑白质高信号各亚组患者胆碱能通路CHIPS 评分的两两比较Table 4. Pairwise comparison of CHIPS scores in cholinergic pathway among WMH subgroups
表5 脑白质高信号组与对照组受试者大脑皮质兴趣区层厚和体积的比较(±s)Table 5. Comparison of thickness and volume of ROIs between WMH patients and normal controls (±s)
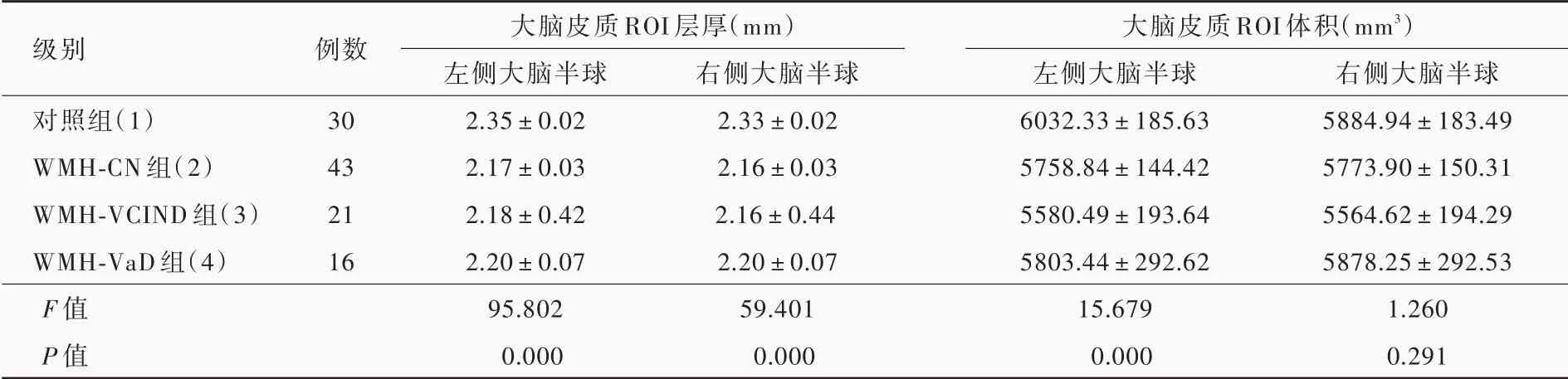
表5 脑白质高信号组与对照组受试者大脑皮质兴趣区层厚和体积的比较(±s)Table 5. Comparison of thickness and volume of ROIs between WMH patients and normal controls (±s)
ROI,region of interest,兴趣区;WMH,white matter hyperintensity,脑白质高信号;CN,cognitive normal,认知功能正常;VCIND,vascular cognitive impairment⁃no dementia,非痴呆型血管性认知损害;VaD,vascular dementia,血管性痴呆
级别对照组(1)WMH⁃CN 组(2)WMH⁃VCIND 组(3)WMH⁃VaD 组(4)F 值P 值例数30 43 21 16大脑皮质ROI 层厚(mm)左侧大脑半球2.35±0.02 2.17±0.03 2.18±0.42 2.20±0.07 95.802 0.000右侧大脑半球2.33±0.02 2.16±0.03 2.16±0.44 2.20±0.07 59.401 0.000大脑皮质ROI 体积(mm3)左侧大脑半球6032.33±185.63 5758.84±144.42 5580.49±193.64 5803.44±292.62 15.679 0.000右侧大脑半球5884.94±183.49 5773.90±150.31 5564.62±194.29 5878.25±292.53 1.260 0.291
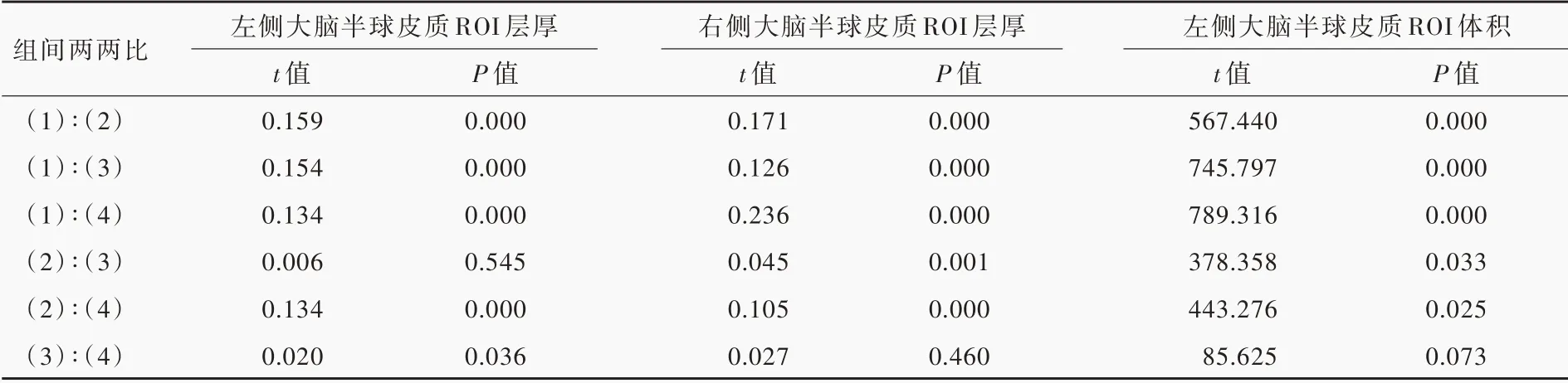
表6 脑白质高信号组与对照组受试者大脑皮质兴趣区层厚和体积的两两比较Table 6. Pairwise comparison of thickness and volume of ROIs between WMH patients and normal controls
讨 论
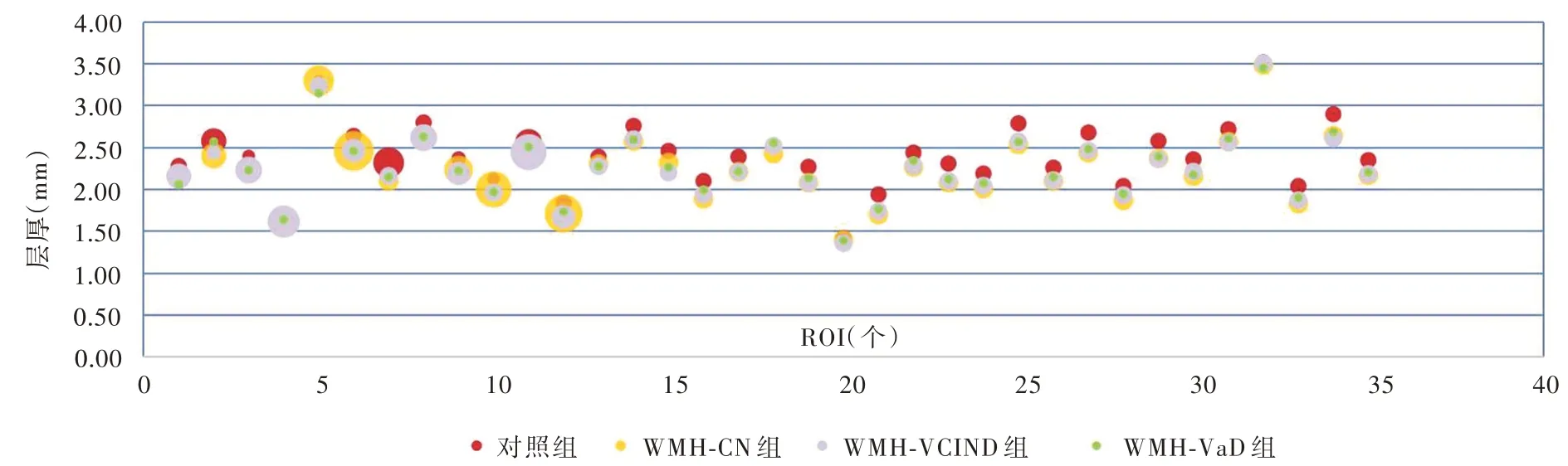
图2 脑白质高信号组患者大部分左侧大脑半球皮质兴趣区层厚均低于对照组Figure 2 The thickness of ROIs in most parts of left hemisphere cortex of patients with WMH were lower than normal controls.
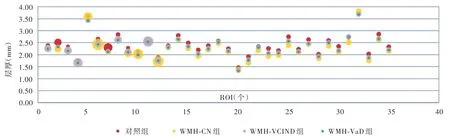
图3 脑白质高信号组患者大部分右侧大脑半球皮质兴趣区层厚均低于对照组Figure 3 The thickness of ROIs in most parts of right hemisphere cortex of patients with WMH were lower than normal controls.
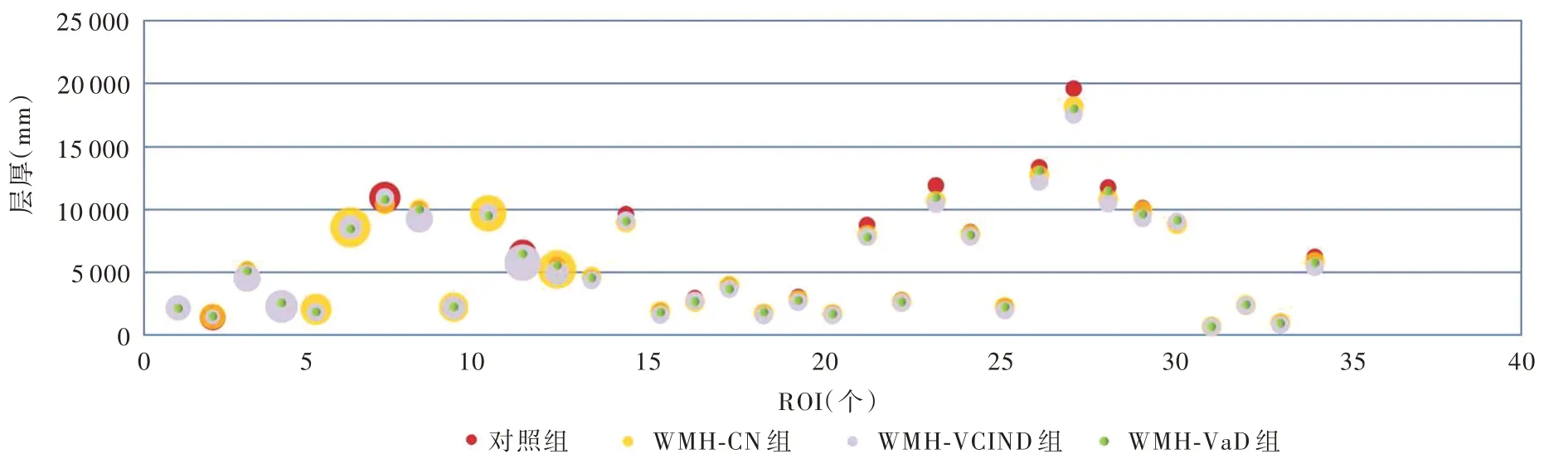
图4 脑白质高信号组患者部分左侧大脑半球皮质兴趣区体积低于对照组Figure 4 The volume of ROIs in part of left hemisphere cortex of patients with WMH were lower than normal controls.
研究显示,CHIPS 评分可用于评价神经变性病(如阿尔茨海默病、帕金森病痴呆、路易体痴呆)性认知损害患者的胆碱能神经元功能,且大脑皮质灰质体积与胆碱能纤维损害呈负相关[14]。PET⁃CT 显像显示,认知相关神经变性病和年龄相关脑室旁白质高信号体积与胆碱能神经元功能呈正相关[15]。但是脑白质高信号合并认知功能障碍患者胆碱能通路中大脑皮质结构是否改变尚不清楚。结构性MRI 可反映神经变性病[16]和年龄相关认知损害[17]导致的大脑皮质兴趣区解剖结构改变的特点。Liu等[6]经对胆碱能通路与血管性认知损害关系的探讨发现,尽管皮质下非痴呆型血管性认知损害患者胆碱能核团(Meynert 基底核)体积变化不明显,但疾病早期胆碱能通路即受损,提示胆碱能通路损害可直接导致认知功能减退。 采用MRI 自动测量FreeSurfer 软件包[18]可以更准确地测量大脑皮质兴趣区边界,从而为结构改变提供准确描述[19]。
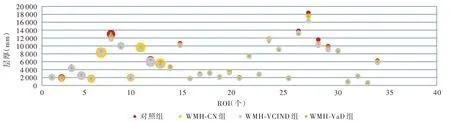
图5 脑白质高信号组患者仅少部分右侧大脑半球皮质兴趣区体积低于对照组Figure 5 The volume of ROIs in a little part of right hemisphere cortex of patients with WMH were lower than normal controls.
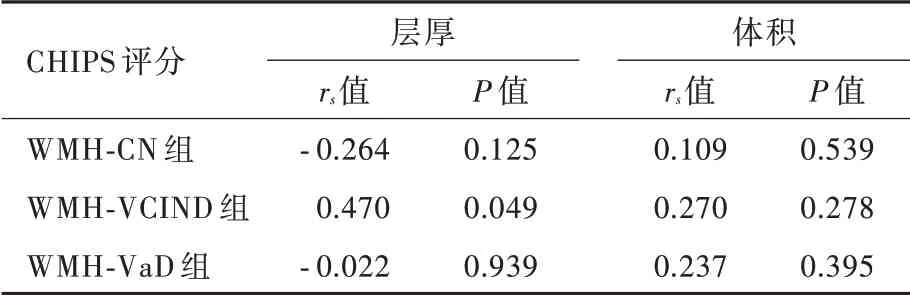
表7 脑白质高信号各亚组患者左侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积的Spearman 秩相关分析Table 7. Spearman rank correlation analysis of CHIPS scores in left hemisphere cortex and thickness and volume of ROIs in the same hemisphere in WMH subgroups
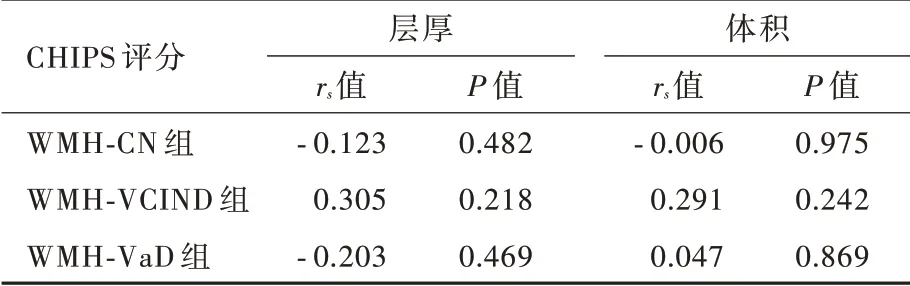
表8 脑白质高信号各亚组患者右侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积的Spearman 秩相关分析Table 8. Spearman rank correlation analysis of CHIPS scores in right hemisphere cortex and thickness and volume of ROIs in the same hemisphere in WMH subgroups
本研究通过对比分析脑白质高信号合并不同认知损害患者与正常对照者胆碱能通路中大脑皮质兴趣区层厚和体积变化特点,获得脑白质高信号影响大脑皮质灰质结构改变的量化指标。对左侧胆碱能通路中皮质兴趣区层厚的分析显示,脑白质高信号患者与正常对照者左侧大脑半球皮质兴趣区层厚差异有统计学意义,其中,WMH⁃CN 组、WMH⁃VCIND 组和WMH⁃VaD 组左侧兴趣区层厚均低于对照组,WMH⁃VaD 组左侧兴趣区层厚高于WMH⁃CN 组和WMH⁃VCIND 组,提示左侧大脑半球脑白质高信号一旦合并认知损害,同侧大脑皮质胆碱能通路中兴趣区层厚即变薄,其中脑白质高信号合并轻度认知损害时兴趣区层厚变薄并不明显,唯有进展为痴呆时才显著变薄。对左侧胆碱能通路中皮质兴趣区体积的分析显示,脑白质高信号患者与正常对照者左侧大脑半球皮质兴趣区体积差异具有统计学意义,其中,WMH⁃CN 组、WMH⁃VCIND组和WMH⁃VaD 组左侧兴趣区体积均低于对照组,WMH⁃CN 组左侧兴趣区体积高于WMH⁃VCIND 组、低于WMH⁃VaD 组,提示左侧大脑半球脑白质高信号一旦合并认知损害,同侧大脑皮质胆碱能通路中兴趣区体积即缩小,但随着认知功能障碍的加重,兴趣区体积并未进一步缩小。对右侧胆碱能通路中皮质兴趣区层厚的分析显示,脑白质高信号患者与正常对照者右侧大脑半球皮质兴趣区层厚差异有统计学意义,其中,WMH⁃CN 组、WMH⁃VCIND 组和WMH⁃VaD 组右侧兴趣区层厚均低于对照组,但WMH⁃VCIND 组和WMH⁃VaD 组并未低于WMH⁃CN组,提示右侧大脑半球脑白质高信号一旦合并认知损害,同侧大脑皮质胆碱能通路中兴趣区层厚即变薄,但脑白质高信号合并痴呆与合并轻度认知损害的兴趣区层厚并无明显差别。对右侧胆碱能通路中皮质兴趣区体积的分析显示,脑白质高信号患者与正常对照者右侧大脑半球皮质兴趣区体积差异无统计学意义,提示随着脑白质高信号患者合并认知功能障碍程度的加重,右侧大脑皮质胆碱能通路中的兴趣区体积无明显变化。
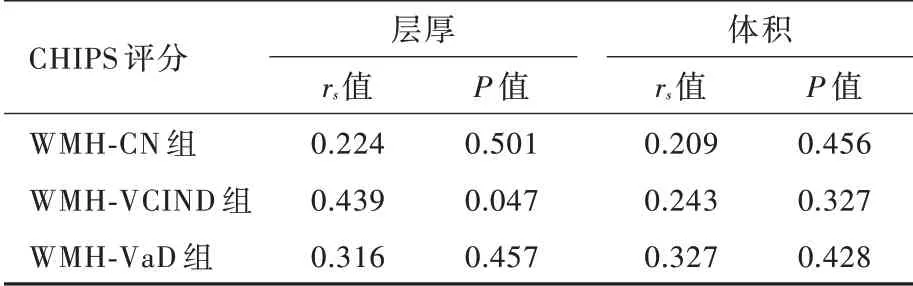
表9 脑白质高信号各亚组患者左侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积的偏相关分析Table 9. Partial correlation analysis of CHIPS scores in left hemisphere cortex and thickness and volume of ROIs in the same hemisphere in WMH subgroups
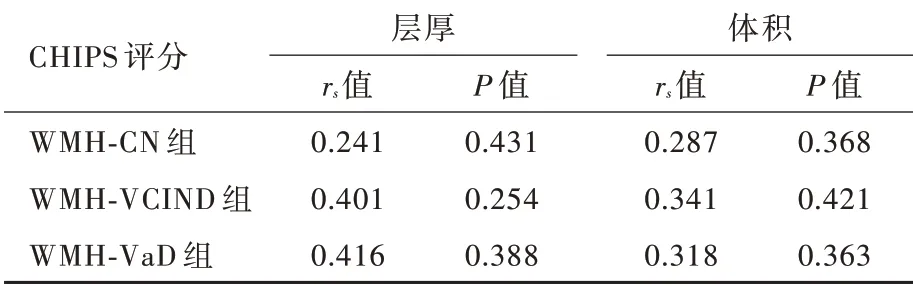
表10 脑白质高信号各亚组患者右侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积的偏相关分析Table 10. Partial correlation analysis of CHIPS scores in right hemisphere cortex and thickness and volume of ROIs in the same hemisphere in WMH subgroups
综合本研究结果,我们的结论是脑白质高信号可继发左侧大脑皮质胆碱能通路中34 个兴趣区层厚和体积下降,随着认知功能障碍程度的加重,层厚下降趋势更明显;脑白质高信号亦可继发右侧大脑皮质胆碱能通路中34 个兴趣区层厚下降,但其下降幅度并不随认知功能障碍程度的加重而增加,经典神经病学理论认为,左侧大脑半球主司语言、书写、计算、逻辑思维、执行功能,右侧大脑半球主司空间感知、面容识别、想象、音乐、艺术。脑白质高信号是轻度认知损害最常见的影像学表现,而血管性认知损害早期通常造成逻辑思维、执行功能、视空间、注意力、记忆力等初级认知域损害。脑白质高信号破坏基底前脑⁃海马通路中皮质下结构的完整性和功能网络,造成胆碱能通路功能紊乱[20]。我们课题组的前期研究显示,脑白质病变(WML)合并不同程度认知损害时,执行功能下降与左侧大脑半球胆碱能通路损害呈正相关[21],与本研究证实的脑白质高信号主要继发左侧大脑皮质胆碱能通路中兴趣区厚度变薄相吻合。
CHIPS 评分不仅包括脑白质高信号数目、大小,亦涉及胆碱能纤维空间分布特点,可以客观评价胆碱能通路的完整性。Meynert 基底核发出胆碱能纤维投射至广泛大脑皮质,多为无髓纤维,易受小血管病变的影响[22]。脑白质高信号合并血管性痴呆认为与脑小血管脂质玻璃样变导致的血脑屏障渗漏性功能障碍相关,且脑脊液/血浆白蛋白比例升高>3 年方进展为痴呆[23]。研究显示,阿尔茨海默病患者胆碱能纤维变性或胆碱能通路功能障碍通常发生于影像学提示大脑皮质萎缩前[24]。上述研究均表明,大脑皮质结构改变通常继发于胆碱能纤维损伤后,这一现象可以长期神经轴突破坏缓慢逆行影响神经元胞体结构和功能的完整性解释。因此,脑白质高信号患者CHIPS 评分越高、胆碱能纤维完整性越差,合并认知功能障碍程度越严重、继发大脑皮质结构改变越显著。亦有研究显示,多发性硬化患者脑白质高信号体积与认知功能障碍和CHIPS 评分均呈正相关,尤以与认知功能障碍的相关性更强[22,25]。然而,目前关于脑白质高信号合并认知功能障碍后出现大脑皮质兴趣区结构改变与CHIPS 评分的相关性尚不清楚,本研究探讨左侧和右侧大脑半球CHIPS 总评分与同侧皮质兴趣区层厚和体积的相关性,结果显示,仅WMH⁃VCIND 组患者左侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚呈正相关,其余各亚组无论左侧还是右侧大脑半球CHIPS 评分与同侧皮质兴趣区层厚和体积均无关联性,提示脑白质高信号造成胆碱能通路长期慢性损害可能对左侧大脑半球皮质结构的改变更显著。然而,CHIPS 评分与同侧大脑皮质兴趣区层厚和体积的相关性并未随着认知功能障碍程度的加重而明显增强,究其原因,一方面是由于WMH⁃VaD组样本量较少,存在偏倚;另一方面可能与脑白质高信号病变部位有关,例如位于胼胝体的白质损害可以造成双侧大脑半球之间联络纤维中断而致复杂的认知行为改变[26]。
本研究为单中心横截面研究,且样本量偏小,未来我们将继续对研究对象进行随访,并扩大样本量对胆碱能通路中大脑皮质兴趣区结构改变与各认知域变化特点的关系进行深入研究,以进一步探明脑白质高信号对认知功能和大脑结构的影响。
利益冲突无
