血清可溶性Endoglin用于诊断子痫前期的临床价值研究
2021-01-05杨铧琦
杨铧琦
(遂宁市中心医院妇产科,四川 遂宁)
0 引言
子痫前期(preeclampsia,PE)是临床上的常见妊娠期疾病,未经及时有效治疗可严重影响孕妇及胎儿的健康,甚至进展为子痫,导致不良的预后[1]。临床上,PE的发病率约为3%~5%,其中因PE或子痫所致病死率约为10%~15%[2]。PE的发病机制十分复杂,目前认为母体、胎盘及胎儿之间多种复杂因素相互复杂作用导致了PE发生,而血管内皮损伤及活性物质过度释放是其中的重要致病原因[3]。PE发病影响因素多,个体首发症状表现不一,部分孕妇在发病时可能并无高血压或蛋白尿情况,临床上对PE的早期识别及诊断较为困难,影响了及时的干预治疗。因此,临床指南一直推荐开发及筛选更为优良的无创生物学指标来用于PE的早期诊断评估。Endoglin(CD105)是内皮细胞表面的跨膜糖蛋白,其功能与转化生长因子(transforming growth factor,TGF-β)及其受体密切相关[4]。可溶性Endoglin(soluble Endoglin,sEng)是胎盘组织Endoglin释放至外周血中的一种可溶性蛋白形式,属于血管生成抑制因子,与微血管收缩及舒张的平衡相关,可导致血管内皮细胞损伤,在如高血压、恶性肿瘤、慢性肾病等的多种疾病中发挥重要的调控作用[5]。此,本研究对sEng水平用于PE的临床诊断价值进行了探讨,以求为PE诊断筛选更为准确的无创指标提供参考。
1 患者与方法
1.1 患者
纳入2018年7月至2020年5月在我院妇产科就诊住院的PE患者83例,其中轻度PE患者47名,重度PE患者36名,一般情况及常规实验室指标见表1。同时纳入在我院进行常规孕检的健康妊娠女性32例作为对照,年龄为33.67±4.79岁。两组间年龄、孕周、吸烟、饮酒情况无显著差异。
PE的诊断标准参考最新的临床实践指南[6]:妊娠超过20周,收缩压≥140 mmHg和(或)舒张压≥90 mmHg,且伴有下列任意1项:尿蛋白≥0.3g/24h,或尿蛋白/肌酐比值≥0.3,或随机尿蛋白≥(+)(无条件进行蛋白定量时的检查方法);无蛋白尿但伴有以下任何1种器官或系统受累:心、肺、肝、肾等重要器官,或血液系统、消化系统、神经系统的异常改变,胎盘-胎儿受到累及等。PE基础上出现下列任一情况时可诊断为重度PE[6]:①血压持续升高不可控制:收缩压≥160mmHg 和(或)舒张压≥110mmHg;②肾功能受损:尿蛋白≥2.0g/24h,少尿(24h尿量 <400mL,或每小时尿量 <17mL)或血肌酐水平 >106μmol/L;③持续头痛、视觉障碍或其他中枢神经系统异常表现;④持续上腹部疼痛及肝包膜下血症或肝破裂表现;⑤转氨酶水平异常:丙氨酸氨基转移酶(alanine aminotransferase,ALT)或门冬氨酸氨基转移酶(aspartate aminotransferase,AST)升高;⑥低蛋白血症伴有胸水、腹水或心包积液;血液系统异常:⑦血小板(platelet,PLT)持续下降至<100×109/L,微血管内溶血,表现有贫血、黄疸或血清乳酸脱氢酶(lactic dehydrogenase,LDH)升高;⑧肺水肿;⑨胎儿生长受限或羊水过少、胎死宫内、胎盘早剥。
排除标准:①妊娠前存在高血压基础患者;②合并妊娠期胆汁淤积及其他严重疾病;③人工受孕;④妊娠期糖尿病及合并糖尿病;⑤妊娠前有严重基础肝肾疾病;妊娠合并贫血。
1.2 临床资料收集及实验室检测
患者首次产检时收集临床资料,记录患者妊娠前身高、体重、吸烟饮酒情况等。根据规范方法检测患者血压、心率及临床实验室检测指标。收集患者常规实验室指标检测剩余血清标本,冻存于-20℃冰箱,以备检测使用。血清sEng的检测使用ELISA方法,按照试剂盒要求规范检测sEng浓度,所有检测样本设置2个复孔,检测结果取均值。
1.3 统计学方法
使用SPSS 18.0软件分析处理数据,GraphPad Prism 5.0软件绘图。计量资料正态分布使用均值±标准差,非正态分布使用中位值(P25~P75)表示,组间比较应用独立样本t检验或非参数检验;计数资料使用n(%)表示,组间比较使用χ2检验。相关性分析采用Pearson(正态分布资料)或Spearman(非正态分布资料)相关法。ROC曲线分析诊断价值,曲线下面积(AUC)≥0.750提示诊断价值较高。P<0.05表示差异有统计学意义。
2 结果
2.1 患者一般资料、临床检测指标、血清sEng水平
患者一般资料及临床检测指标结果见表1。PE组与健康对照组相比,年龄、孕周、孕次、吸烟、饮酒等均无统计学差异,PE组平均动脉压、血清Cr、脐动脉S/D值、妊娠前BMI均高于健康对照组。PE组血清sEng水平(4.28±1.34)ng/mL高于健康对照组(2.81±0.92)ng/mL,差异有统计学意义(P<0.001);重度PE患者血清sEng水平(5.17±1.22)ng/mL高于轻度PE(3.61±0.99)ng/mL患者,差异有统计学意义(P<0.001)(图1)。
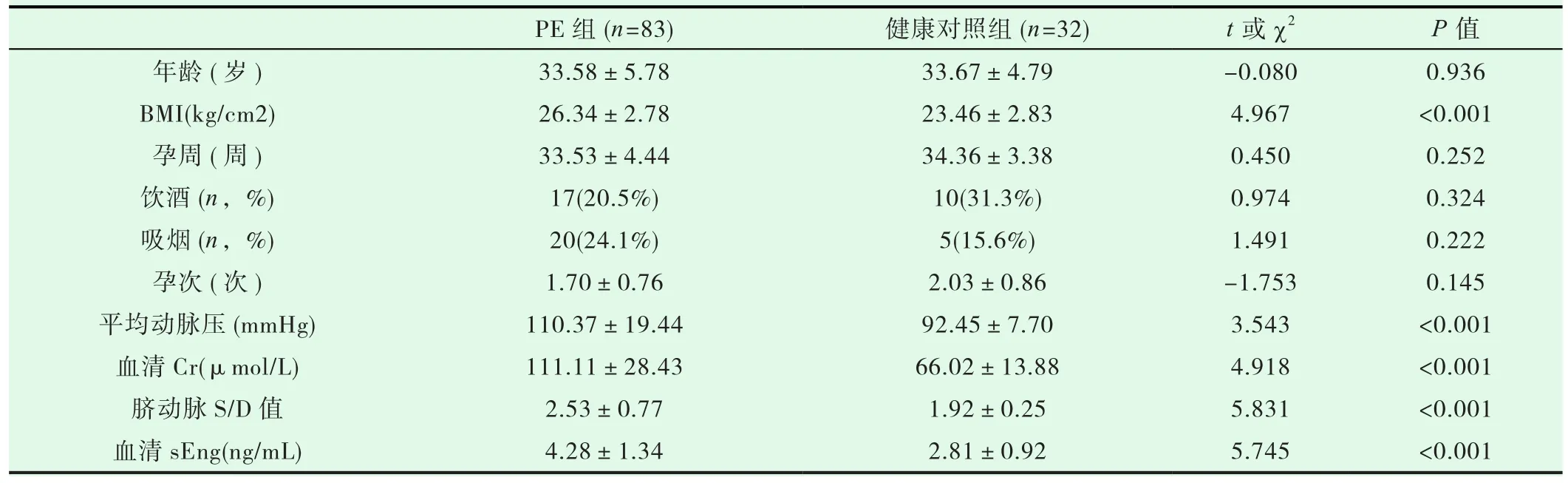
表1 患者一般资料及临床检测指标
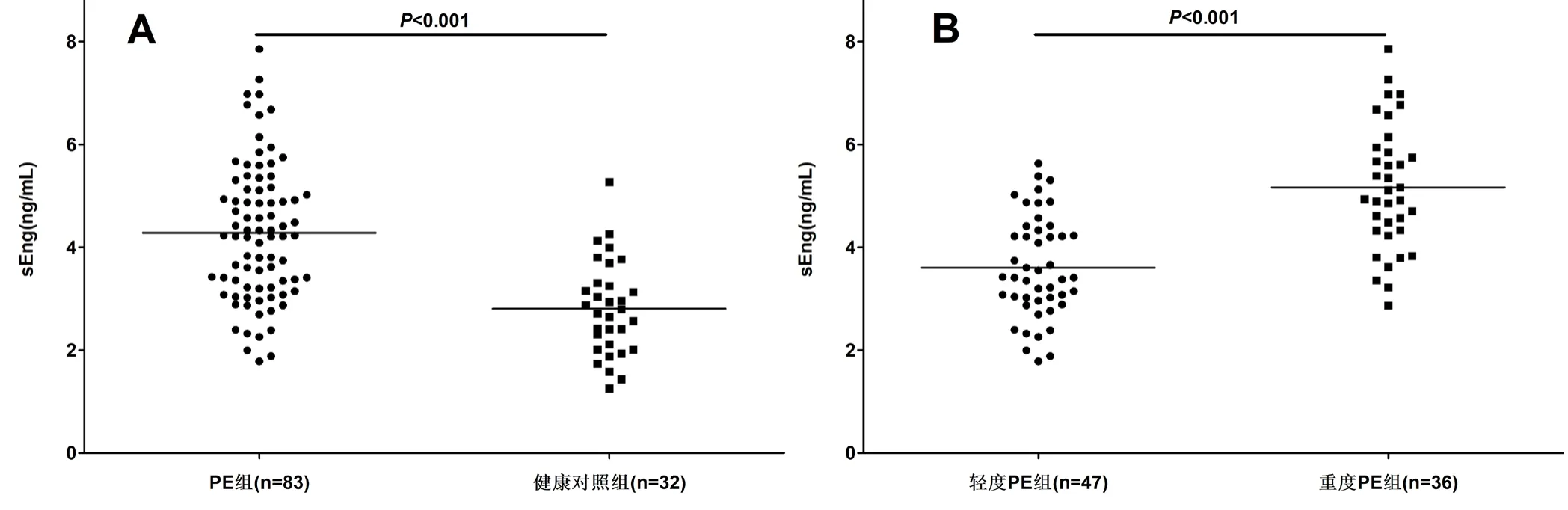
图1 PE组与健康对照组sEng水平(ng/mL)
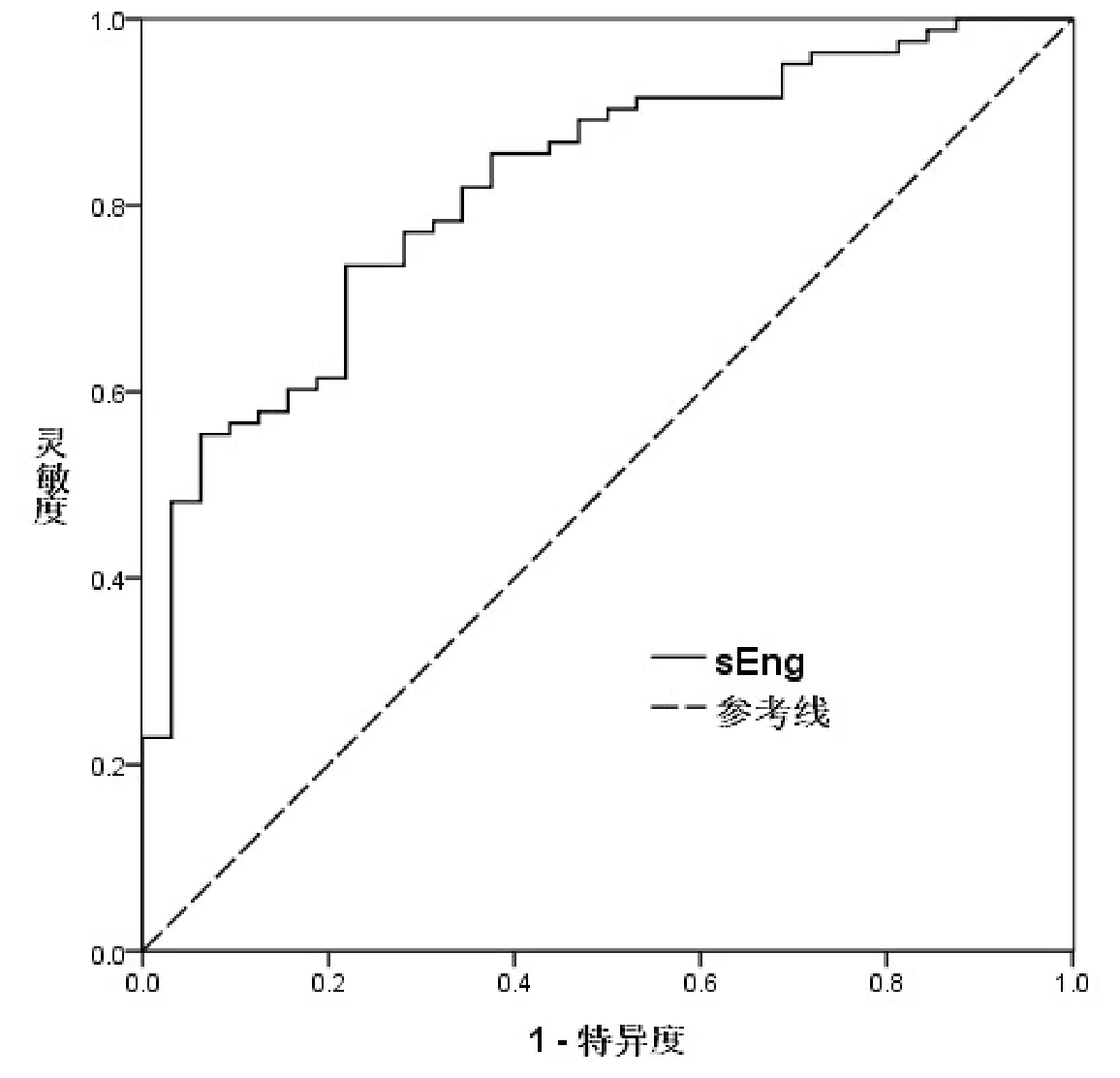
图2 血清sEng用于区别诊断PE及健康对照的ROC曲线
2.2 PE患者血清sEng与临床检测指标的相关性分析
PE 组中,sEng水平与平均动脉压 (R=0.630,P<0.001)、血清Cr(R=0.775,P<0.001)、脐动脉 SD 比值 (R=0.702,P<0.001)呈显著正相关,与年龄 (R=0.160,P=0.149)、BMI(R=0.175,P=0.114)及孕周(R=0.198,P=0.072)无相关性。健康对照组中,血清sEng水平与平均动脉压 (R=148,P=0.420)、血清 Cr(R=0.230,P=0.205)、脐动脉 S/D 比值 (R=0.034,P=0.851)、年龄 (R=-0.139,P=0.449)、BMI(R=0.152,P=0.405)及孕周 (R=-0.298,P=0.098)无相关性。
2.3 血清sEng用于诊断PE的ROC曲线分析
血清sEng水平用于区别诊断PE及健康对照时的AUC为 0.820(95%CI:0.739-0.901),cut-off值取为 3.33ng/mL 时,诊断灵敏度为0.735,特异度为0.781(图2)。血清sEng水平区别诊断重度及轻度PE的AUC为0.842(95%CI:0.758-0.925),cut-off值取4.23ng/mL时,诊断灵敏度为0.806,诊断特异度为0.748(图3)。
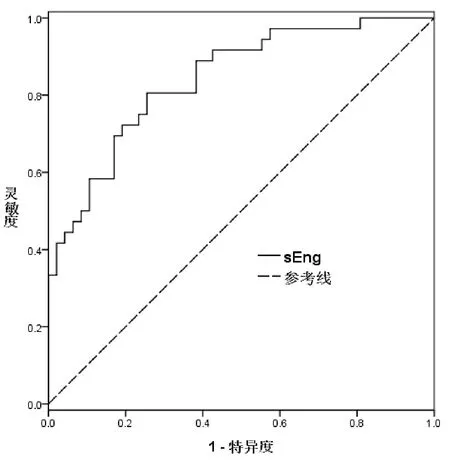
图3 血清sEng用于区别诊断重度及轻度PE的ROC曲线
3 讨论
PE是妊娠期的特发性疾病,也是危及孕妇与胎儿的严重疾病,PE的致病机制十分复杂,目前认为胎盘缺血缺氧及血管内皮损伤在其中发挥重要的核心作用[3]。sEng是血清中反映内皮细胞功能改变的重要标志物,既往的研究也显示在sEng在高血压、恶性肿瘤疾病中存在表达异常,有一定的临床诊断及预后价值[7]。我们的研究观察了血清sEng及sFlt-1在PE患者中的差异性表达,并探讨了这种差异与疾病严重程度及临床转归的相关性。
本研究中也发现,与健康对照相比,PE患者血清sEng水平存在显著升高,而且重度PE患者血清sEng水平高于轻度PE,sEng及sFlt-1水平与反映PE严重程度的临床指标(平均动脉压、血清Cr、脐动脉S/D值等)呈显著相关,在一定程度上可以反映PE的严重程度。此外,本研究还发现,血清sEng用于区别诊断PE时具有较高的准确度,且sEng可用于区别诊断重度及轻度PE,具有一定的临床诊断价值。相关的国内外研究方面,如Zhang等[8]的研究显示,PE患者血清sEng水平存在显著升高,且sEng水平用于诊断PE的AUC高达0.873,诊断灵敏度及特异度分别为0.816及0.905。Leanos-Miranda等[9]的大样本临床研究还发现,在PE患者中,sEng水平与血压、蛋白尿、血清乳酸、ALT等指标存在显著相关性,同时与新生儿体重、孕妇血小板计数等存在显著负相关,高sEng水平的PE患者更容易发生早产(HR=2.23),sEng水平是预测PE孕妇不良预后的独立危险因素。上述研究结果与本研究相似,均提示了sEng具有作为PE无创诊断标志物的重要价值。由于PE致病本身的复杂性,sEng参与PE致病及发展的机制并未完全阐明,但最新的研究也显示,sEng可能通过调控骨生成蛋白(BMP)相关信号通路的表达来参与PE的致病[10,11]。同时,基于细胞和动物模型的研究也显示,通过靶向调控sEng的表达,可能有助于降低PE时血管内皮损伤,从而发挥治疗及阻断PE的作用,也为临床上开发新的PE靶向药物提供了一定的参考[12,13]。
综上所述,本研究结果显示,PE患者存在sEng水平的显著升高,且sEng水平用于PE具有较高的临床诊断及评估价值。研究也存在一定的不足之处,如纳入的总体样本量较小、缺少对sEng指标的动态观察等。下步还需要对sEng在PE的致病及进展中的作用机制进行更深入的研究探讨,并开展更为前瞻性的临床研究来验证sEng的临床诊断及预后价值,从而使更多的患者从中获益。
