急性缺血性脑卒中患者外周血Th17/Treg细胞亚群水平的变化及临床意义
2021-01-05周发英彭泽艳李玲
周发英,彭泽艳,李玲
急性缺血性脑卒中(acute ischemic stroke,AIS)是造成我国居民致残和死亡的主要原因之一,其发病率呈显著上升趋势[1]。研究显示,机体炎症反应的激活是AIS 发生与进展的重要因素[2]。因此,AIS 的免疫防治作为重要的治疗手段,引起了广泛关注。T 淋巴细胞是炎症反应激活的重要组成部分,作为炎症反应的上游调控因子,参与了众多炎症性疾病如冠心病、糖尿病等的发生、发展过程[3,4]。其中,辅助性T 细胞-17(T-helper-17,Th17)和调节性T 细胞(T-Regulatory,Treg)是与炎症性疾病发病及进展相关的重要T 淋巴细胞亚群[5]。有研究显示,机体Th17/Treg 细胞亚群失衡,可促进下游炎性细胞因子合成及分泌显著增加,引起器官持续性炎症反应及相应器官功能损伤[6]。但在AIS 患者体内Th17/Treg 细胞亚群与疾病病情严重程度及预后的相关性如何,目前尚未阐明。因此,本研究通过分析AIS 患者外周血Th17/Treg 细胞亚群及相关下游炎性通路水平的变化情况,探讨外周血Th17/Treg细胞亚群与AIS患者病情严重程度及预后的相关性。
1 资料与方法
1.1 一般资料
连续收集2017年1月1日至2019年12月1日我院收治的AIS 患者190 例纳入观察组,其中男102 例,女88例;年龄62~86岁,平均年龄(73.6±9.8)岁。纳入标准:符合AIS 的诊断标准[7];发病时间至入院时间<24 h。排除标准:严重肝、肾功能不全;合并脑出血;合并严重感染、自身免疫性疾病、恶性肿瘤等疾病。选择同期门诊行健康体检者60例纳入对照组。2组的性别、年龄、体质量指数、基础疾病等差异无统计学意义(P>0.05)。根据美国国立卫生院脑卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分将观察组分为3 亚组,轻度亚组(NIHSS 评分≤4 分)61 例,中度亚组(NIHSS评分5~15分)64例,重度亚组(NIHSS评分≥l6 分)65 例。根据出院后3 个月改良Rankin 量表(modified Rankin Scale,mRS)评分对患者临床预后进行评估,mRS 评分0~2 分纳入预后良好亚组,3~5 分为预后不良亚组。该研究方案获得了本院伦理委员会的批准,并征得了患者及家属书面知情同意。
1.2 主要设备及试剂
FACS 型流式细胞仪购于美国BD 公司。RPMI 1640细胞培养基、离子霉素、莫能霉素、佛波酯、淋巴细胞分离液、细胞固定液及细胞破膜剂购于美国Sigma公司;胎牛血清购于美国Gibco公司;白细胞介素(interleukin,IL)-17、CD4 及CD25 单克隆抗体购于美国Santa 公司;IL-17 和 转 化 生 长 因 子(transforming growth factor,TGF)-β酶联免疫试剂盒购于中国武汉博士德生物公司。
1.3 方法
1.3.1 外周血Th17 和Treg 细胞亚群水平检测 抽取入组患者入院第2日凌晨空腹静脉血3 mL,经肝素抗凝后,取抗凝血300 μL加入等体积的RPMI-1640培养基,接种于培养板,同时加入佛波酯(20 μL,1 μg/mL)、离子霉素(18 μL,40 μg/mL)及莫能霉素(20 μL,0.1 mg/mL),培养箱中孵育6 h。取100 μL 上述培养液,加入抗人CD4和CD25单克隆抗体10 μL,震荡混匀后室温避光孵育20 min,加入100 μL 细胞固定液。再次室温避光孵育20 min 后,经1500 g 离心5 min,弃上清后,加入100 μL 破膜液,同时加入IL-17 单克隆抗体10 μL 和Foxp3抗体10 μL,震荡混匀后,待上机检测。
1.3.2 外周血炎性指标检测 采用ELISA法测定患者外周血炎性指标IL-17和TGF-β水平,具体操作依据试剂盒说明书进行。
1.4 统计学处理
采用SPSS 19.0 软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验或单因素方差分析;相关性采用Pearson相关分析;运用Graphpad 软件做ROC 曲线分析,计算Th17及Treg细胞的ROC曲线下面积(AUC)、最佳工作点(OOP)、敏感性及特异性;P<0.05 为差异有统计学意义。
2 结果
2.1 观察组与对照组间外周血Th17 和Treg 细胞亚群及相关炎性因子水平比较
观察组外周血Th17、Th17/Treg 及IL-17 水平明显高于对照组(P<0.05),Treg 细胞亚群和TGF-β水平显著低于对照组(P<0.05),见表1。
2.2 观察组不同亚组间外周血Th17 和Treg 细胞亚群及相关炎性因子水平比较
重度亚组外周血Th17、Th17/Treg 比值及IL-17 水平明显高于中度亚组和轻度亚组,中度亚组上述指标显著高于轻度亚组(P<0.05);重度亚组外周血Treg细胞亚群和TGF-β水平明显低于中度亚组和轻度亚组,中度亚组上述指标显著低于轻度亚组(P<0.05),见表2。
2.3 不同预后亚组间外周血Th17 和Treg 细胞亚群及相关炎性因子水平比较
根据mRS 评分纳入预后良好亚组139 例,纳入预后不良亚组51 例。预后不良组亚患者外周血Th17、Th17/Treg 比值及IL-17 水平明显高于预后良好亚组(P<0.05),Treg 细胞亚群和TGF-β水平显著低于预后良好亚组(P<0.05),见表3。
表1 观察组与对照组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)

表1 观察组与对照组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)
注:与对照组比较,①P<0.05
组别对照组观察组例数60190 Th17/%2.12±0.879.85±1.24①Treg/%11.50±1.687.12±1.55①Th17/Treg 0.18±0.051.38±0.21①IL-17/(pg/mL)10.20±2.1631.05±5.88①TGF-β/(pg/mL)90.20±6.9060.12±5.34①
表2 观察组不同亚组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)

表2 观察组不同亚组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)
注:与轻度亚组比较,①P<0.05;与中度亚组比较,②P<0.05.
组别轻度亚组中度亚组重度亚组例数616465 Th17/%7.16±0.8310.15±0.92①13.18±1.04①②Treg/%8.50±0.757.06±0.60①5.98±0.55①②Th17/Treg 0.88±0.161.42±0.23①2.21±0.25①②IL-17/(pg/mL)25.30±4.3030.50±4.10①35.80±5.02①②TGF-β/(pg/mL)70.21±6.4259.80±5.28①50.44±5.51①②
表3 不同预后亚组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)

表3 不同预后亚组间外周血Th17和Treg细胞亚群及相关细胞炎性因子水平比较(±s)
注:与预后良好亚组比较,①P<0.05
组别预后良好亚组预后不良亚组例数13951 Th17/%9.05±1.2011.40±1.28①Treg/%7.20±0.786.31±0.69①Th17/Treg 1.38±0.321.95±0.40①IL-17/(pg/mL)28.80±5.3133.58±5.88①TGF-β/(pg/mL)60.30±6.1053.10±6.40①
2.4 相关性分析
相关性分析显示,AIS 患者外周血Th17 细胞水平与IL-17、NIHSS 评分和mRS 评分呈显著正相关(r1=0.820,P<0.001;r2=0.746,P<0.001;r3=0.690,P<0.001),与Treg 细胞水平和TGF-β呈显著负相关(r1=-0.720,P<0.001;r2=-0.658,P<0.001)。
2.5 外周血Th17和Treg细胞对评估AIS患者预后不良的ROC曲线分析
绘制ROC 曲线,其结果显示,外周血Th17 细胞水平的曲线下面积(AUC)为0.864(95%CI0.763~0.965),其最佳工作点(OOP)为11.28%,按此工作点对AIS 患者预后不良进行预测,其敏感性和特异性分别为78.01%和82.50%。外周血Treg 细胞水平的曲线下面积(AUC)为0.818(95%CI0.713~0.923),其最佳工作点(OOP)为6.25%,按此工作点对AIS患者预后不良进行预测,其敏感性和特异性分别为79.17%和74.50%,见图1。
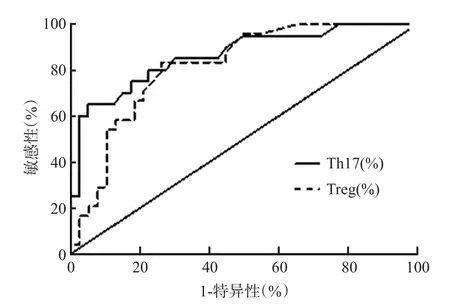
图1 外周血Th17和Treg细胞的ROC曲线分析
3 讨论
因人口老龄化,我国AIS 发生率呈现年轻化和逐年上升趋势[8]。对于AIS病情及预后的评估,有重要的临床意义。机体炎症反应的过度激活是AIS 发生、发展的重要的因素之一[9]。机体免疫功能紊乱可促进炎症反应的激活,参与了AIS的发生、发展过程[10]。Th17细胞是CD4+T细胞亚群,可通过分泌相应炎性细胞因子,介导促炎反应[11]。Treg 细胞也是CD4+T 细胞亚群之一,可调节机体免疫功能,抑制过度免疫反应引起的组织细胞损伤[12]。在生理情况下,机体Th17和Treg细胞亚群维持在一定平衡状态,当受外在刺激作用下,该平衡状态被打破,Th17 细胞活化显著增加,Treg 细胞显著减少,进而促进下游炎性细胞通路激活,产生炎症级联反应[13]。相关研究显示,Th17/Treg与炎症性疾病的发生、发展密切相关,可作为潜在的治疗靶点[14]。在本研究中,随着AIS患者病情严重程度的增加,外周血Th17 细胞及特异性分泌的IL-17 水平显著升高,而外周血Treg 细胞及TGF-β水平显著降低,提示Th17 与Treg 细胞亚群平衡的紊乱,促进了下游炎性信号通路的激活,可能参与了AIS 患者病情的进展。分析外周血Th17/Treg 与AIS 患者预后的关系,结果显示,预后不良组外周血Th17 细胞和IL-17 显著高于预后良好组,Th17 细胞水平与mRS 评分呈显著正相关,而外周血Treg 细胞和TGF-β显著低于预后良好组,提示外周血Th17/Treg 水平可有效的反映AIS 患者临床预后。外周血Th17/Treg 细胞亚群的平衡失调引起AIS 的发生及进展,可能与多种因素相互作用有关。有研究证实,外周血Th17 细胞通过分泌IL-17 可直接促进低密度脂蛋白过氧化,损伤内皮细胞,导致内皮素及炎性因子的进一步释放,促进了动脉粥样硬化的形成,导致卒中的发生[15]。其次,IL-17 分泌增加,而TGF-β显著减少,可激活体内血小板,促进血小板的黏附与聚集,导致血栓形成[16],此外,外周血Th17/Treg 细胞亚群的平衡失调与心房颤动的发生密切相关,间接影响了AIS的发生、病情进展及预后[17]。通过有效调节Th17/Treg细胞亚群的平衡,可显著改善炎症性疾病的进展及预后[18]。Th17/Treg细胞亚群不仅与AIS病情严重程度及预后有关,还是AIS治疗的潜在靶点。
综上所述,外周血Th17/Treg细胞亚群与AIS的病情严重程度及预后密切相关。检测外周血Th17/Treg细胞亚群,有助于评估AIS患者病情严重程度及预后。
