异唑草酮对玉米根际土壤微生物量碳、氮和酶活性的影响
2021-01-04王博马艺倩滕春红刘志华李春杰陶波岳建超冯曦茹顾元琳
王博 马艺倩 滕春红 刘志华 李春杰 陶波 岳建超 冯曦茹 顾元琳


摘要 :為明确异噁唑草酮对玉米根际土壤微生物碳、氮及酶活性的影响,采用田间试验的方法,以1倍、5倍和10倍田间推荐剂量为供试除草剂剂量,测定了异噁唑草酮土壤封闭处理对玉米根际土壤微生物量碳、氮及土壤脲酶、过氧化氢酶、蔗糖酶、脱氢酶和中性磷酸酶活性的影响。结果表明:推荐剂量的异噁唑草酮对玉米根际土壤微生物量碳、氮含量无显著影响,5倍和10倍推荐剂量的异噁唑草酮对玉米根际土壤微生物量碳、氮含量具有抑制作用。推荐剂量的异噁唑草酮对玉米根际土壤脲酶、过氧化氢酶和蔗糖酶影响较小,5倍和10倍推荐剂量的异噁唑草酮对其具有明显的抑制作用。异噁唑草酮对土壤脱氢酶活性具有抑制作用,且施用剂量越高,抑制作用越强。异噁唑草酮对土壤中性磷酸酶活性的影响表现为前期促进,后期抑制,且施用剂量越大,促进或抑制作用越强。研究表明:推荐剂量的异噁唑草酮对玉米根际土壤微生物量碳、氮及土壤脲酶、过氧化氢酶和蔗糖酶活性的影响较小,但对土壤脱氢酶、中性磷酸酶活性有影响。
关键词 :异噁唑草酮; 玉米; 根际土壤; 微生物; 酶活性
中图分类号:
S 481.8, S154
文献标识码: A
DOI: 10.16688/j.zwbh.2020398
Effects of isoxaflutole on soil microbial biomass C, N and soil enzyme activities in maize rhizosphere
WANG Bo1#, MA Yiqian1#, TENG Chunhong1*, LIU Zhihua2, LI Chunjie3,
TAO Bo1, YUE Jianchao1, FENG Xiru1, GU Yuanlin1
(1.College of Agriculture, Northeast Agricultural University, Harbin 150030, China;
2.College of Resources and Environment, Northeast Agricultural University, Harbin 150030, China;
3.China Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Harbin 150081, China)
Abstract
To evaluate the effect of isoxaflutole on the soil microbial biomass C, N and enzyme activities in maize rhizosphere soil, a field experiment was conducted to investigate the effect of isoxaflutole at 1, 5 and 10 times of the field recommended dose on the soil microbial biomass C, N, soil urease, catalase, invertase, dehydrogenase and neutral phosphatase activity in maize rhizosphere soil.The results showed that there was no significant effect on the microbial biomass C, N in the rhizosphere soil of maize after application with the recommended field dose, and the microbial biomass C, N in the rhizosphere soil of maize was inhibited seven days after application with 5 and 10 times the recommended dose.The recommended dose of isoxaflutole had little effect on urease, catalase and sucrase in rhizosphere soil of maize, while 5 and 10 times the recommended dose of isoxaflutole had obvious inhibitory effect on them.Isoxaflutole inhibited the activity of soil dehydrogenase, and the higher the dosage, the stronger the inhibition.Soil neutral phosphatase activity showed early promotion and later inhibition after application of isoxaflutole, and the higher the dose, the stronger the stimulation or inhibition.The results showed that the recommended dose of isoxaflutole had little effect on microbial biomass C, N and soil urease, catalase and invertase activity in rhizosphere soil of maize, but it had effect on soil dehydrogenase and neutral phosphatase activity.
Key words
isoxaflutole; maize; rhizosphere soil; microorganism; enzyme activity
现今,农业生产过程离不开农药的使用。虽然农药能够最大程度地减少病虫草害引起的经济损失,同时提高作物产量,但其广泛使用也可能影响土壤生态,包括土壤微生物,导致土壤肥力受损,削弱土壤生态系统的功能,从而降低农作物质量[12]。土壤微生物活性及酶活性在土壤养分循环中起着关键作用,其活性对土壤生态系统中有机质和植物养分的矿化和转化至关重要[3]。土壤酶作为一种生物催化剂,对于土壤的碳、氮和磷循环具有积极的作用。因为土壤酶活性极不稳定,易受到多种因素的影响,且一旦土壤污染,土壤酶的活性会受到很大影响,因此,酶活性可被视为监测由环境胁迫或管理措施引起的土壤质量变化的有效指标[45]。
异噁唑草酮(isoxaflutole)的作用机理为抑制4-羟基苯基丙酮酸双加氧酶(HPPD),该酶对生育酚和质体醌生物合成至关重要[6]。异噁唑草酮使用适期灵活,既可进行土壤处理,又可在苗后早期使用,应用于玉米田和甘蔗田,杀草谱广,对一年生禾本科杂草及马齿苋Portulaca oleracea L.、铁苋菜Acalypha australis L.、苍耳Xanthium strumarium L.、苘麻Abutilon theophrasti Medicus、鸭跖草Commelina communis L.、柳叶刺蓼Polygonum bungeanum Turcz.和苣荬菜Sonchus wightianus DC.等有很好的防除效果[79]。异噁唑草酮控草时间久,用药量极低,是比较理想的玉米田除草剂[78]。目前,国内外对于异噁唑草酮的研究主要集中于除草活性和对作物的安全性等方面,关于其影响土壤微生物和酶活性的研究未见报道[1012]。本研究采用田间试验的方法测定了不同剂量的异噁唑草酮对玉米根际土壤微生物量碳、氮含量及土壤酶活性的影响,观测其对玉米田土壤环境的影响,为其在玉米田的合理使用提供参考。
1 材料与方法
1.1 试验地概况
土壤样品取自黑龙江省东北农业大学试验基地(45.74°N,126.73°E),土壤类型为松嫩平原退化黑土,有机质含量32.1 g/kg,全氮1.35 g/kg,碱解氮190.4 mg/kg,速效钾138.7 mg/kg,酸碱度7.19。
1.2 试验材料
1.2.1 供试除草剂
20%异噁唑草酮悬浮剂(SC),潍坊先达化工有限公司。
1.2.2 供试试剂
高锰酸钾、浓硫酸、甲苯、尿素、草酸、过氧化氢、柠檬酸、氢氧化钠、氢氧化钾、乙醇、甲醇、苯酚、丙酮、硫酸铵、次氯酸钠、酒石酸钾钠、二硝基水杨酸、磷酸二氧钾、磷酸氢二钠、苯甲酸、葡萄糖、蔗糖等。SDHA试剂盒、S-NP试剂盒,苏州科铭生物技术有限公司。
1.2.3 供试仪器设备
双光束紫外分光光度计(TU-1901),北京普析通用仪器有限责任公司;消煮炉(SH220N),上海洪纪仪器设备有限公司;背负式喷雾器(KNAPSACK Hydraulic Sprayer),KNAPSACK;凯氏定氮仪(KDN-4C),海能仪器股份有限公司;高速冷冻离心机(ST 16R),美国赛默飞世尔科技公司;抽滤机(SHZ-D),瑞鑫达化玻仪器有限公司;摇床(HY-5A),威尔实验用品有限公司。
1.3 试验设计
玉米(‘嫩单8’)播种时间为2019年5月11日,播种后3 d进行土壤处理,异噁唑草酮的施药量(有效成分用量,下同)分别为120 g/hm2(T1,田间推荐剂量,下同)、600 g/hm2(T5,5倍田间推荐剂量)和1 200 g/hm2(T10,10倍田间推荐剂量),设置清水对照处理(CK),每个处理4次重复,喷液量为300 L/hm2,小区面积为21 m2,采用随机区组设计,每个小区间设置1 m隔离带。于施药后7、14、21 d和28 d,按“S”形在小区内随机选取4个点,采用破坏根际法来收取根际土样[13],而后立即测定土壤微生物量碳、氮和酶活性。以5点取样法采集未施药的对照土壤,放入无菌取样袋,风干、过筛后测定理化性质[14]。
1.4 测定项目及方法
土壤微生物量碳测定方法:称取新鲜土样,用K2SO4溶液浸提振荡测定,取等量土壤用氯仿进行熏蒸, 24 h后取出浸提,以熏蒸和未熏蒸的土壤样品提取液中全碳含量的差值乘以系数进行计算[15]。
土壤微生物量氮测定方法:采用凯氏定氮仪测定土壤提取液全氮含量,以熏蒸和未熏蒸土壤提取液全氮含量的差值除以系数进行计算[16]。
土壤酶活性的测定及表示方法[17]如表1所示。
1.5 數据处理与分析
采用Microsoft Excel 2010进行数据统计,采用SPSS 21.0软件进行单因素方差分析。
2 结果与分析
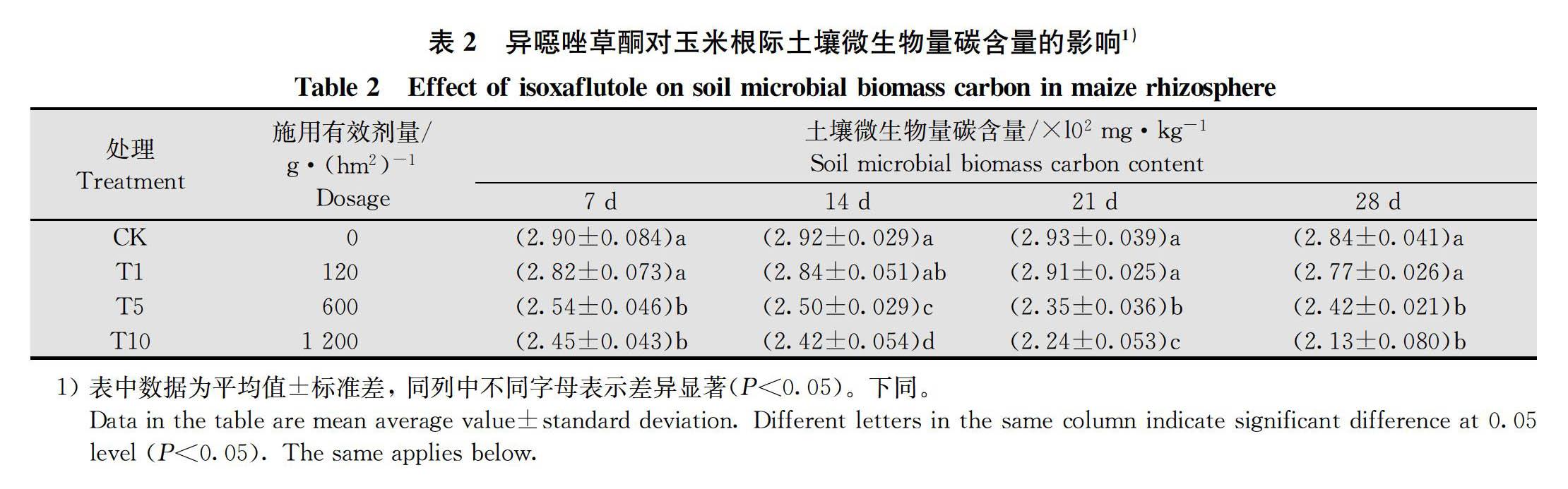
2.1 异噁唑草酮对玉米根际土壤微生物量碳、氮含量的影响
2.1.1 异噁唑草酮对玉米根际土壤微生物量碳含量的影响
异噁唑草酮对玉米根际土壤微生物量碳的影响如表2所示,结果表明,在整个试验过程中,120 g/hm2处理下土壤微生物量碳含量与CK无显著差异,600 g/hm2和1 200 g/hm2处理下土壤微生物量碳含量与CK相比显著下降。
120、600 g/hm2和1 200 g/hm2处理下土壤微生物碳含量在施药后7 d分别比CK降低了2.76%、12.41%和15.52%;施药后14 d分别降低了2.74%、14.38%和17.12%;施药后21 d分别降低了0.68%、19.80%和23.55%;施药后28 d分别降低了2.46%、14.79%和25.00%。
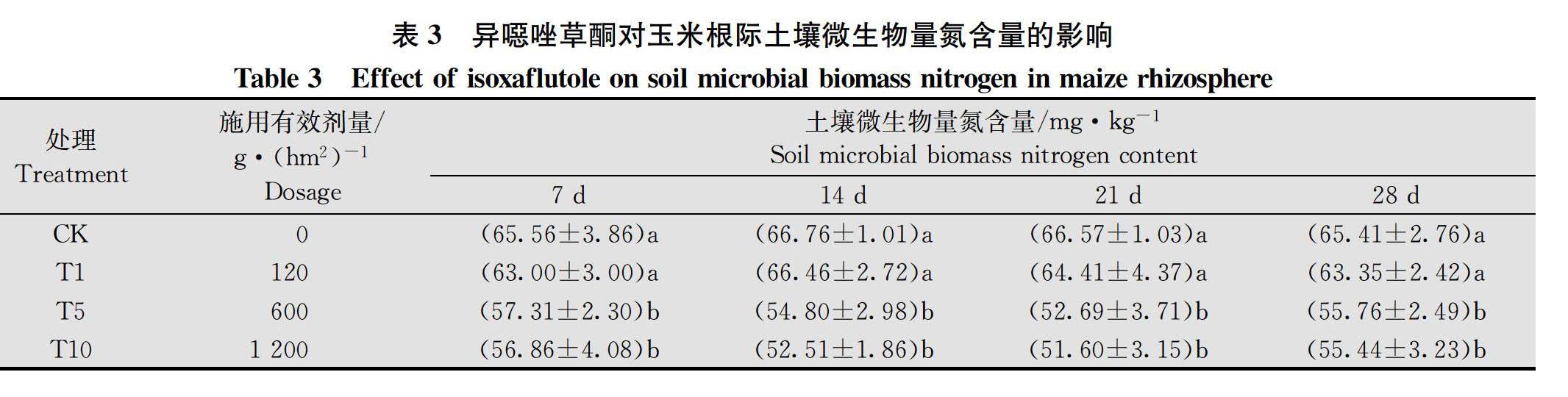
2.1.2 异噁唑草酮对玉米根际土壤微生物量氮含量的影响
异噁唑草酮对玉米根际土壤微生物量氮的影响如表3所示,结果表明,在整个试验过程中,120 g/hm2处理下土壤微生物量氮含量与CK无显著差异, 600 g/hm2和1 200 g/hm2处理下土壤微生物量氮含量与CK相比显著下降。120、600 g/hm2和1 200 g/hm2处理的土壤微生物量氮含量在施药后7 d与CK相比分别降低了3.90%、12.58%和13.27%;施药后14 d分别降低了0.45%、17.91%和21.35%;施药后21 d分别降低了3.24%、20.85%和22.49%;施药后28 d分别降低了3.15%、14.75%和15.24%。
2.2 异噁唑草酮对玉米根际土壤酶活性的影响
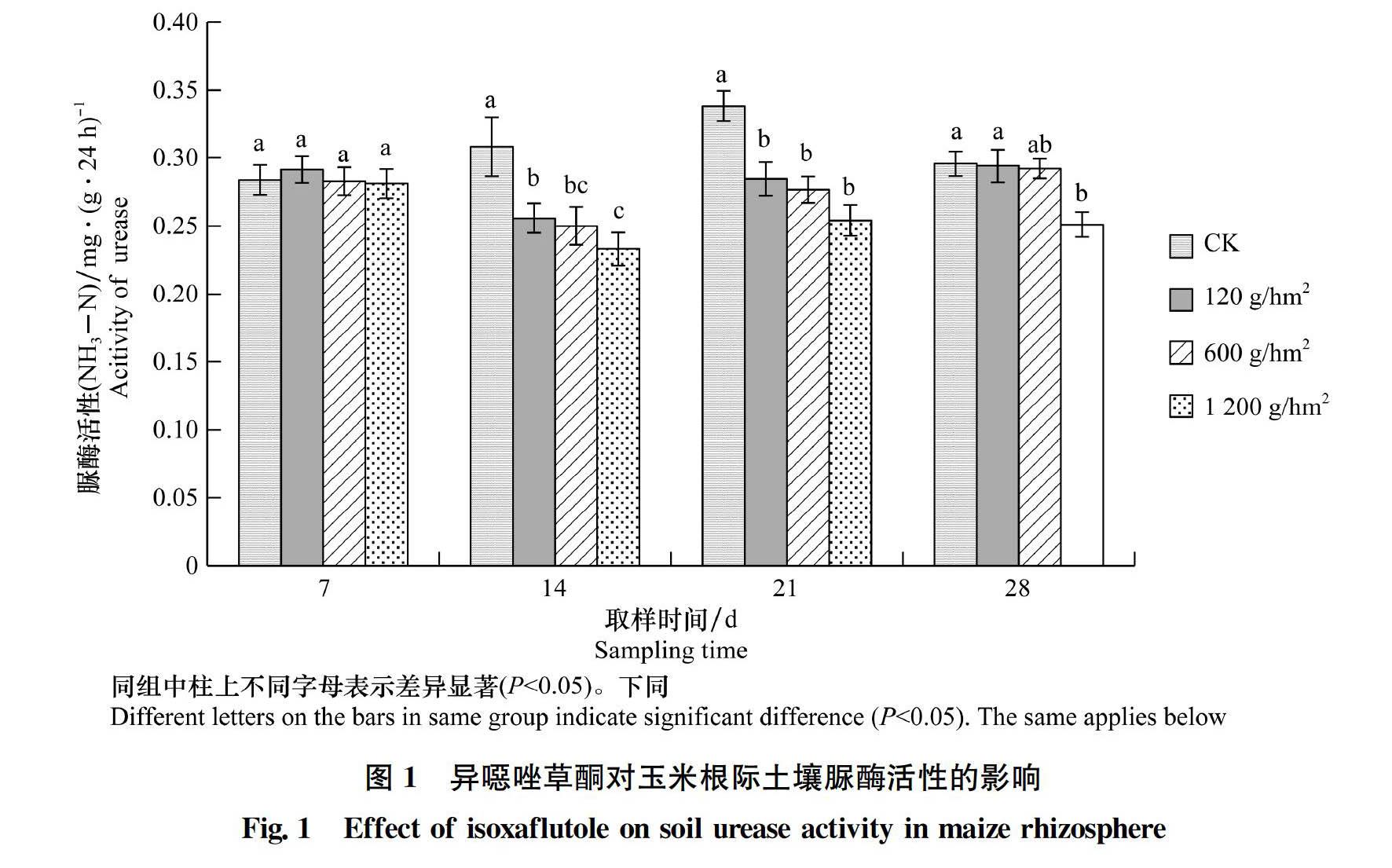
2.2.1 异噁唑草酮对玉米根际土壤脲酶活性的影响
异噁唑草酮对玉米根际土壤脲酶活性的影响如图1所示。从图中可以看出:施药后7 d,与CK相比,120 g/hm2处理下土壤脲酶活性增加了2.68%,600 g/hm2和1 200 g/hm2处理下土壤脲酶活性降低了0.35%和0.95%,但各个处理之间差异不显著。施药后14 d和21 d,土壤脲酶活性受到抑制,且异噁唑草酮施药量越高,抑制作用越明显,且各处理均与CK存在显著差异。施药后28 d,120 g/hm2和600 g/hm2处理下土壤脲酶活性基本恢复至对照水平,无显著差异,但1 200 g/hm2处理土壤脲酶活性显著降低,与CK相比降低了15.12%。
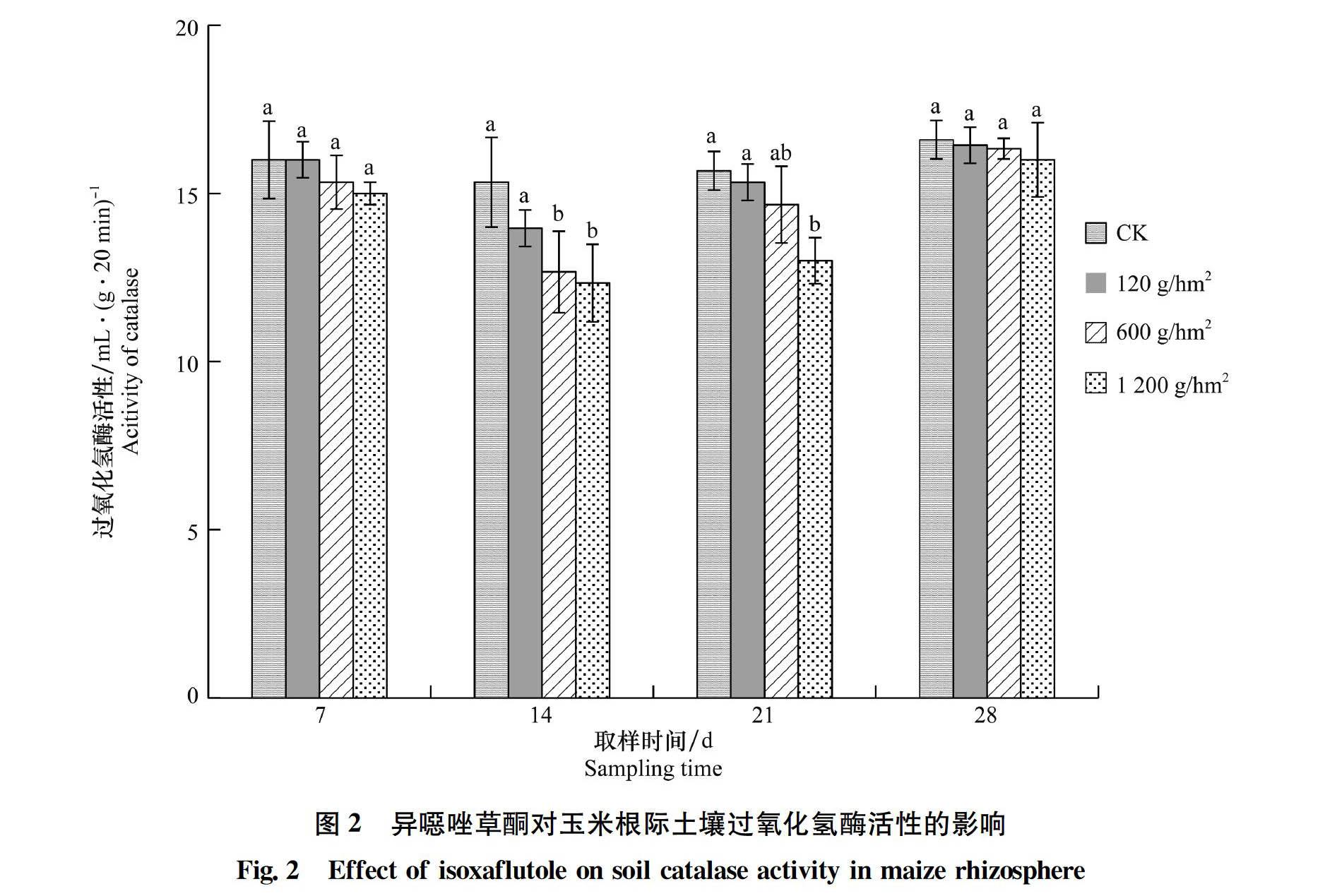
2.2.2 异噁唑草酮对玉米根际土壤过氧化氢酶活性的影响
异噁唑草酮对玉米根际土壤过氧化氢酶活性的影响如图2所示。从图中可以看出:施药后7 d,120、600 g/hm2和1 200 g/hm2处理下土壤过氧化氢酶活性与CK没有显著差异。施药后14 d,600 g/hm2和1 200 g/hm2处理下土壤过氧化氢酶活性分别降低了17.39%和19.57%,与CK存在显著差异。施药后21 d,120、600 g/hm2和1 200 g/hm2处理下土壤过氧化氢酶活性分别降低了2.15%、6.40%和17.03%。施药后28 d,各处理下土壤过氧化氢酶活性基本恢复至对照水平。
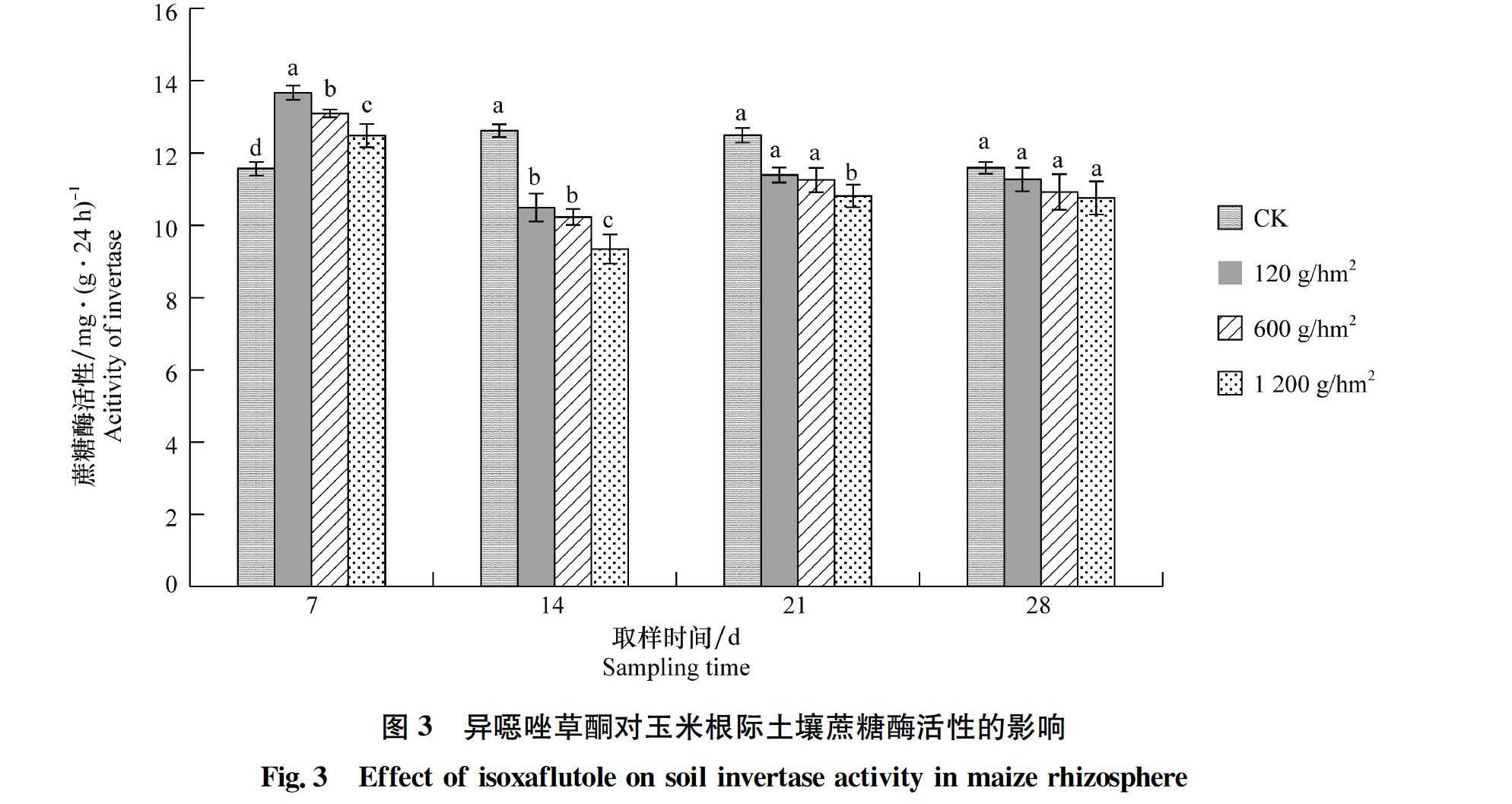
2.2.3 异噁唑草酮对玉米根际土壤蔗糖酶活性的影响
异噁唑草酮对玉米根际土壤蔗糖酶活性的影响如图3所示。从图中可以看出:施药后7 d,各处理的蔗糖酶活性均高于CK,分别增加了18.17%、13.19%和7.87%,与CK差异显著。施药后14 d和21 d,各剂量的异噁唑草酮对土壤蔗糖
酶活性均有抑制作用,且施药量越高,抑制作用越明显。施药后14 d,120、600 g/hm2和1 200 g/hm2处理的土壤蔗糖酶活性分别下降了16.87%、18.93%和25.93%,且与CK差异显著。施药后21 d,120、600 g/hm2和1 200 g/hm2处理的土壤蔗糖酶活性与CK相比分别下降了8.81%、9.94%和13.47%。施药后28 d,各处理的土壤蔗糖酶活性与CK差异不显著。
2.2.4 异噁唑草酮对玉米根际土壤脱氢酶活性的影响
异噁唑草酮处理对玉米根际土壤脱氢酶活性的影响如图4所示。从图中可以看出:在整个试验过程中,各剂量的异噁唑草酮对玉米根际土壤脱氢酶活性均具有一定的抑制作用,且抑制作用随施药量的增加而增强。施药后7 d,120、600 g/hm2和1 200 g/hm2处理的土壤脱氢酶活性与CK相比分别下降了13.88%、36.45%和47.57%,与CK差异显著。施药后14 d,120、600 g/hm2和1 200 g/hm2处理的土壤脱氢酶活性分别下降了7.77%、19.17%和35.28%。施药后21 d,120、600 g/hm2和1 200 g/hm2处理的土壤脱氢酶活性分别下降了21.98%、35.00%、40.16%,与CK存在显著差异。施药后28 d,各剂量的异噁唑草酮对土壤脱氢酶活性的抑制作用逐渐恢复,但其活性仍显著低于CK。
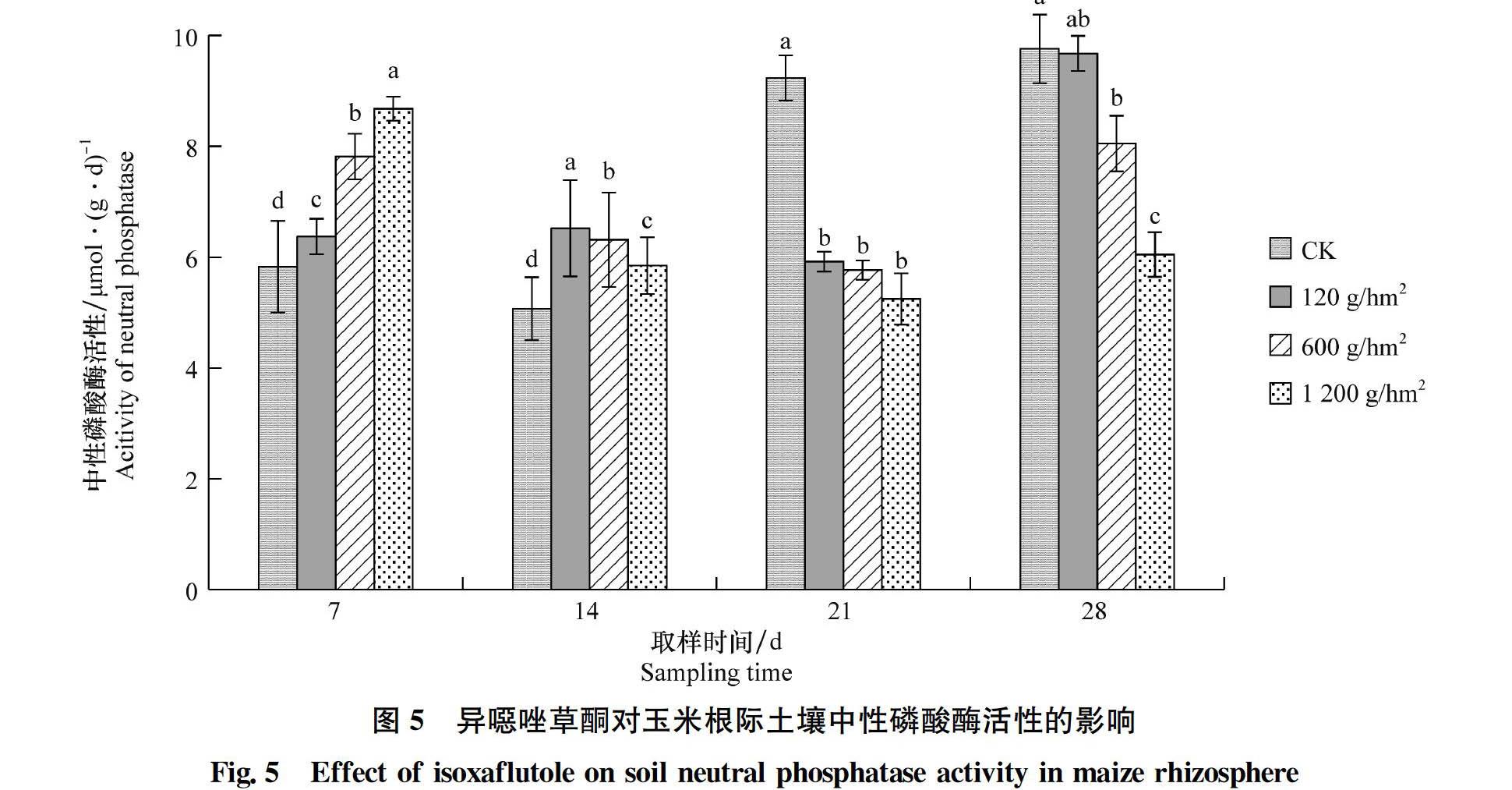
2.2.5 异噁唑草酮对玉米根际土壤中性磷酸酶活性的影响
异噁唑草酮对玉米根际土壤中性磷酸酶活性的影响如图5所示。从图中可以看出:施药后7 d,各处理的玉米根际土壤中性磷酸酶活性随施药量的增加而增强,120、600 g/hm2和1 200 g/hm2处理的土壤中性磷酸酶活性分别增加了9.32%、34.10%和48.92%,均与CK差异显著。施药后14 d,120、600 g/hm2和1 200 g/hm2处理的土壤中性磷酸酶活性均显著高于CK,分别增加了28.64%、24.58%和15.36%。施药后21 d,120、600 g/hm2和1 200 g/hm2處理的土壤中性磷酸酶活性分别降低了35.89%、37.54%和43.18%,且与CK差异显著。施药后28 d,120 g/hm2处理的土壤中性磷酸酶活性逐渐恢复,与CK差异不显著,600 g/hm2和1 200 g/hm2处理的土壤中性磷酸酶活性分别降低了17.50%和38.04%,仍与CK存在显著差异。
3 结论与讨论
土壤中微生物生物量碳、氮是土壤有机质重要的组成部分,它们对外界环境的变化十分敏感。本试验发现,推荐剂量的异噁唑草酮会降低玉米根际土壤微生物量碳、氮含量,但与对照差异不显著。而5倍和10倍推荐剂量的异噁唑草酮会明显抑制玉米根际土壤生物量碳、氮含量,且剂量越高,抑制作用越强,试验后期也无法恢复至对照水平,这一结果与张超兰等[18]对莠去津影响土壤微生物量碳、氮含量的研究结果相似。 这可能是因为施药量的增加会抑制土壤微生物量,随时间的延长,异噁唑草酮逐渐分解,对微生物的毒性也随之减弱[19]。
土壤酶可以催化有机物和某些矿物质转化为一些营养物质以及有用元素,这些元素可以促进外源性化合物的降解以及植被的生长,同时土壤酶能够增强作物的抗逆性,因此土壤酶活性是监测土壤质量的重要指标[2021]。研究表明,在田间喷施除草剂会对土壤酶产生不同程度的影响[22]。本试验发现,5倍和10倍推荐剂量的异噁唑草酮处理会抑制脲酶活性,施药后14~21 d抑制作用较为强烈,之后逐渐恢复,但经10倍剂量的异噁唑草酮处理后,土壤脲酶活性最终不能恢复至对照水平,说明高剂量的异噁唑草酮可能对玉米根际土壤脲酶具有一定毒性,这一结果与周世雄等[13]对氟磺胺草醚影响大豆根际土壤脲酶活性的研究结果相似。各剂量的异噁唑草酮均会抑制玉米根际土壤过氧化氢酶活性,且剂量越高,抑制作用越强,但短时间内该酶活性能够恢复,这与Kucharski等[23]的研究结果基本一致。佘晓云等[24]的研究表明双氟磺草胺对麦田土壤蔗糖酶的影响表现为先促进后抑制。本试验研究结果显示异噁唑草酮对玉米根际土壤蔗糖酶活性的影响表现为短时间内激活,然后抑制,最后酶活性基本恢复至对照水平。本试验的研究结果与前人有相似之处,但不完全相同。这可能是因为随时间变化,土壤微生物对异噁唑草酮的毒害渐渐产生了适应性,土壤蔗糖酶活性便渐渐恢复。本研究发现,异噁唑草酮会抑制玉米根际土壤脱氢酶活性,且剂量越高,抑制作用越强,姜虎生等[25]的研究结果表明,乙草胺和氟乐灵均会对土壤脱氢酶活性产生不同程度的抑制,且随浓度的提高,抑制作用愈发明显,这与本文的研究结果一致。异噁唑草酮对玉米根际土壤中性磷酸酶活性的影响表现为激活抑制,且剂量越高,抑制作用越明显,这与Tomkiel等[26]对氟噻草胺和异噁唑草酮的混剂对碱性磷酸酶活性的影响的研究结果相似。这可能是因为除草剂为土壤微生物提供了一定的能量来源,进而表现出激活作用,但随时间变化,能量被充分利用,高剂量的异噁唑草酮逐渐对微生物产生了毒性,降低了土壤中有机磷的转化速度,进而表现出抑制作用。
不同施药量、剂型和环境条件下,除草剂对土壤微生物和酶活性的影响不同。本试验研究结果表明在推荐剂量下,异噁唑草酮对玉米根际土壤微生物量碳、氮及土壤脲酶、过氧化氢酶和蔗糖酶活性几乎无影响,但施药后28 d,异噁唑草酮会抑制土壤脱氢酶和中性磷酸酶的活性,且随施药量的增加,抑制作用愈发明显。因此在推荐剂量下,异噁唑草酮可在玉米田应用,并可用土壤脱氢酶和中性磷酸酶作为指标来监测土壤质量。
参考文献
[1] KALIA A, GOSAL K S. Effect of pesticide application on soil microorganisms [J]. Archives of Agronomy and Soil Science, 2011, 57(6): 569596.
[2] ZAIN M, MOHMAD R B, SIJAM K, et al. Effect of selected herbicides in vitro in soil growth and development of soil fungi from oil palm plantation [J]. International Journal of Agriculture & Biology, 2013, 15(5): 820826.
[3] DICK W A, TABATABAI M A. Significance and potential uses of soil enzymes [M]∥Soil microbial ecology: Application in agricultural and environmental management. New York:1993: 95127.
[4] 王理德, 王方琳, 郭春秀, 等. 土壤酶學硏究进展[J]. 土壤, 2016, 48(1): 1221.
[5] 周启星, 孔繁翔, 朱琳. 生态毒理学[M]. 北京: 科学出版社, 2006.
[6] PALLETT K E, LITTLE J P, SHEEKEY M, et al. The mode of action of isoxaflutole: physiological effects, metabolism and selectivity [J]. Pesticide Biochemistry & Physiology, 1998, 62: 113124
[7] 刘洋. 未来玉米田除草剂的开发思路[J]. 农药市场信息, 2015(29): 3235.
[8] 牛纪凤. 异噁唑草酮的合成工艺研究[D]. 上海:华东理工大学, 2013.
[9] SMITH A, SOLTANI N, KAASTRA A C, et al. Isoxaflutole and metribuzin interactions in isoxaflutole-resistant soybean[J]. Weed Science, 2019, 67(5): 485496.
[10]ZHAO Ning, ZUO Lan, LI Wei, et al. Greenhouse and field evaluation of isoxaflutole for weed control in maize in China [J/OL]. Scientific Reports, 2017, 7: 12690. DOI: 10.1038/s41598-017-12696-7.
[11]苏少泉. 异噁唑草酮的开发、使用与除草剂新品种筛选的思考[J]. 农药研究与应用, 2008, 12(1): 16.
[12]PALLETT K E, CRAM S M, LITTLE J P, et al. Isoxaflutole: the background to its discovery and the basis of its herbicidal properties [J]. Pest Management Science, 2001, 57(2): 133142.
[13]周世雄, 魏朝俊, 胡海燕, 等. 氟磺胺草醚对大豆根际土壤微生物和酶活性的影响及其在根际的降解[J]. 植物营养与肥料学报, 2018, 24(1): 203211.
[14]鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2005.
[15]崔正果, 李秋祝, 张恩萍, 等. 玉米秸秆不同还田方式对土壤有机质及微生物数量的影响[J]. 玉米科学, 2018, 26(6): 104109.
[16]赵伟, 孙泰朋, 田宗泽, 等. 秸秆配施低温菌剂直接还田对黑土土壤碳、氮的影响[J]. 玉米科学, 2018, 26(3): 147152.
[17]关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1987.
[18]张超兰, 徐建民, 姚斌. 外加阿特拉津土壤的微生物生物量对氮磷肥料的动态响应[J]. 农业环境科学学报, 2004, 23(1): 159161.
[19]姚斌, 张超兰. 除草剂对土壤微生物生物量碳、氮及呼吸的影响[J]. 生态环境, 2008, 17(2): 580583.
[20]刘善江, 夏雪, 陈桂梅, 等. 土壤酶的研究进展[J]. 中国农学通报, 2011, 27(21): 17.
[21]宋福强, 范晓旭, 常伟, 等. 苜蓿菌根对土壤中阿特拉津降解及酶活性影响[J]. 中国农学通报, 2016, 32(30): 182187.
[22]严岩, 文波龙, 徐惠风, 等. 除草剂苄嘧磺隆对盐碱化沼泽芦苇生长及土壤酶活性影响的实验研究[J]. 湿地科学, 2016, 14(1): 117121.
[23]KUCHARSKI J, TOMKIEL M, BACMAGA M, et al. Enzyme activity and microorganisms diversity in soil contaminated with the Boreal 58WG herbicide [J]. Journal of Environmental Science and Health. Part. B, Pesticides, Food Contaminants and Agricultural Wastes, 2016, 51(7): 446454.
[24]佘曉云, 殷会德, 胡占丽, 等. 双氟磺草胺对麦田残留及土壤酶活性的影响[J]. 应用与环境生物学报, 2018, 24(6): 14181422.
[25]姜虎生, 王宏燕. 除草剂对土壤脱氢酶活性及呼吸强度的影响[J]. 吉林农业科学, 2011, 36(5): 5355.
[26]TOMKIEL M, BACMAGA M, BOROWIK A, et al. Effect of a mixture of flufenacet and isoxaflutole on population numbers of soil-dwelling microorganisms, enzymatic activity of soil, and maize yield [J]. Journal of Environmental Science and Health. Part. B, Pesticides, Food Contaminants, and Agricultural Wastes, 2019, 54(10): 111.
(责任编辑:杨明丽)
