NLRP3基因敲除对DSS诱导小鼠溃疡性结肠炎的影响研究
2021-01-04范彦秋聂莹莹
步 楠 范彦秋 聂莹莹
溃疡性结肠炎(UC)是常见的慢性非特异性炎性肠病,其发病机制复杂且尚未完全明确,目前临床上缺乏有效的治疗方法。研究显示,肠道炎性反应及免疫应答异常、肠道菌群紊乱及肠黏膜屏障破坏与UC的发生密切相关[1-2]。Nod样受体家族蛋白3(NLRP3)炎症小体由NLRP3、凋亡凝集样蛋白(ASC)、天冬氨酸特异性半胱氨酸蛋白酶-1前体(Pro-Caspase-1)组成,其在炎性反应调控中起着关键作用。NLRP3炎症小体活化后,Pro-Caspase-1转化为有活性的天冬氨酸特异性半胱氨酸蛋白酶-1(Caspase-1),进而将白细胞介素-1β前体(Pro-IL-1β)及Pro-IL-18裂解为有活性的白细胞介素-1β(IL-1β)及IL-18。有研究显示,在UC的发病过程中,NLRP3炎症小体过度活化,IL-1β及IL-18的分泌增多,提示NLRP3炎症小体可能是UC治疗的靶点[3-4]。本研究建立葡聚糖硫酸钠(DSS)诱导的小鼠溃疡性结肠炎模型,以验证NLRP3基因敲除对小鼠UC的保护作用,报道如下。
1 材料与方法
1.1 材料
C57BL/6小鼠购自上海西普尔-必凯实验动物有限公司[生产许可SCXK(沪)2018-0006];NLRP3基因敲除杂合子C57BL/6小鼠(NLRP3+/-)购自北京唯德生物科技有限公司,采用TALEN技术获得。RIPA蛋白裂解液、BCA蛋白定量试剂盒均购自上海贝博生物科技公司;NLRP3、ASC、Caspase-1、闭锁小带蛋白-1(ZO-1)、闭锁蛋白(Occludin)的单克隆抗体均购自英国Abcam公司;IL-1β、IL-18、二胺氧化酶(DAO)、D-乳酸(D-LA)的酶联免疫吸附法(ELISA)试剂盒均购自上海西唐生物科技有限公司。
1.2 方法
1.2.1 NLRP3基因敲除纯合子小鼠的制备 NLRP3+/-雄性与雌性小鼠按照1∶2的比例合笼,配种后获得的后代进行基因鉴定。剪取尾巴末端0.5 cm,采用基因组DNA提取试剂盒提取DNA,采用引物(购自北京唯德生物科技有限公司)对DNA进行聚合酶链反应(PCR)扩增,PCR产物中加入T7E1酶、37 ℃酶切30 min,酶切产物进行琼脂糖凝胶并判断NLRP3的基因型:野生型(WT)小鼠(NLRP3+/+)的片段为301 bp,NLRP3基因敲除杂合子小鼠(NLRP3+/-)为301 bp及198 bp,NLRP3基因敲除纯合子小鼠(NLRP3-/-)为198 bp。
1.2.2 动物分组及造模 将雄性C57BL/6小鼠随机分为NLRP3-WT组、NLRP3-WT+DSS组,将雄性NLRP3基因敲除纯合子小鼠(NLRP3-/-)随机分为NLRP3-KO组、NLRP3-KO+DSS组,每组各8只小鼠。NLRP3-WT+DSS组和NLRP3-KO+DSS组给予含有30 g/L DSS的高压灭菌饮用水,NLRP3-WT组和NLRP3-KO组给予高压灭菌饮用水,均自由饮用6 d。
1.2.3 肠黏膜组织病理评分 造模后处死小鼠,收集适量结肠组织,用0.9%NaCl溶液清洗,4%多聚甲醛固定,石蜡包埋切片,苏木精-伊红(HE)染色,在显微镜下观察肠黏膜的病理改变,参照文献[5]进行组织病理评分:(1)炎性细胞浸润 无浸润为0分,轻度浸润为1分,重度浸润为2分;(2)炎性细胞浸润深度 黏膜层浸润为1分,黏膜及黏膜下层浸润为2分,肠壁全层浸润为3分;(3)溃疡深度 无溃疡为0分,溃疡累及上皮为1分,溃疡累及黏膜固有层为2分,溃疡累及黏膜肌层为3分。3项评分之和为组织病理评分,评分越高则肠黏膜病理损伤越严重。
1.2.4 肠黏膜中NLRP3、ASC、Caspase-1、ZO-1、Occludin表达水平检测 取适量结肠组织,分离肠黏膜,采用RIPA裂解液提取组织中的总蛋白,采用BCA试剂盒测定蛋白含量,取含有20 μg总蛋白的样本进行蛋白免疫印迹法(Western Blot)检测,将样本加入SDS-聚丙烯酰胺凝胶后进行电泳、电转PVDF膜,5%脱脂牛奶室温封闭PVDF膜1 h,NLRP3、ASC、Caspase-1、ZO-1、Occludin一抗4 ℃孵育PVDF膜过夜。次日,HRP二抗室温孵育PVDF膜1 h,最后在凝胶成像仪中显影得到蛋白条带,根据条带灰度值计算蛋白表达水平。
1.2.5 肠黏膜中IL-1β、IL-18水平检测 按照1.2.4中的方法获得肠黏膜组织的蛋白样本并测定总蛋白含量,采用ELISA试剂盒测定IL-1β、IL-18水平,计算每mg总蛋白中IL-1β、IL-18的水平。
1.2.6 血清中DAO、D-LA水平检测 造模后处死小鼠,收集外周血3~5 mL,静置0.5 h,3 000 r/min离心获得血清样本,采用ELISA试剂盒测定血清中DAO、D-LA的水平。
1.3 统计学方法
采用SPSS 22.0软件录入数据,计量资料采用均数±标准差表示,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠肠黏膜HE染色及组织病理评分的比较
与NLRP3-WT组比较,NLRP3-WT+DSS组的小鼠肠黏膜上皮细胞广泛缺失,局部出现糜烂,腺体不完整、炎性细胞大量浸润,组织病理评分明显升高(P<0.05);与NLRP3-WT+DSS组比较,NLRP3-KO+DSS组小鼠肠黏膜上皮细胞及腺体基本完整,未出现明显糜烂,可见少量炎性细胞浸润,组织病理评分明显降低(P<0.05)。见图1、图2。
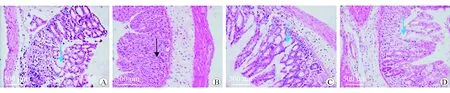
注:蓝色箭头为隐窝细胞,黑色箭头为炎性细胞图1 4组小鼠肠黏膜病理 HE染色 ×200 A NLRP3-WT组 B NLRP3-WT+DSS组 C NLRP3-KO组 D NLRP3-KO+DSS组

注:与NLRP3-WT组比较,*P<0.05;与NLRP3-WT+DSS组比较,#P<0.05图2 4组小鼠肠黏膜组织病理评分比较
2.2 4组小鼠肠黏膜中NLRP3炎症小体表达水平的比较
与NLRP3-WT组相比,NLRP3-WT+DSS组小鼠肠黏膜中NLRP3、ASC、Caspase-1的表达水平均明显升高(P均<0.05)。与NLRP3-WT+DSS组相比,NLRP3-KO+DSS组黏膜中NLRP3不表达,ASC、Caspase-1的表达水平明显降低(P<0.05)。见图3、表1。
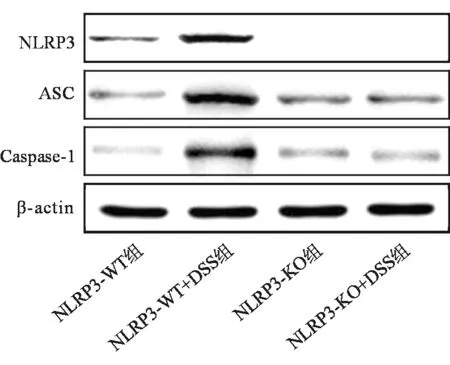
图3 4组小鼠肠黏膜中NLRP3、ASC、Caspase-1的表达

表1 4组小鼠肠黏膜中NLRP3、ASC、Caspase-1表达水平的比较
2.3 4组小鼠肠黏膜中炎性因子水平的比较
与NLRP3-WT组相比,NLRP3-WT+DSS组小鼠肠黏膜中IL-1β、IL-18水平均明显升高(P均<0.05)。与NLRP3-WT+DSS组相比,NLRP3-KO+DSS组小鼠黏膜中IL-1β、IL-18水平均明显降低(P均<0.05)。见表2。
2.4 4组小鼠肠黏膜屏障功能的比较
与NLRP3-WT组相比,NLRP3-WT+DSS组血清中DAO、D-LA水平明显升高,肠黏膜中ZO-1、Occludin的表达水平明显降低(P均<0.05)。与NLRP3-WT+DSS组相比,NLRP3-KO+DSS组血清中DAO、D-LA水平明显降低,肠黏膜中ZO-1、Occludin的表达水平明显升高(P均<0.05)。见图4、表3~4。

表2 4组小鼠肠黏膜中IL-1β、IL-18水平的比较/ng·mgPro-1

图4 4组小鼠肠黏膜中ZO-1、Occludin的蛋白条带

表3 4组小鼠血清中DAO、D-LA水平的比较

表4 4组小鼠肠黏膜中ZO-1、Occludin表达水平的比较
3 讨论
UC的发病机制较为复杂,其中炎性反应及免疫应答异常、肠黏膜屏障损伤已被多项研究证实与UC的发病有关[6-7]。本研究采用DSS诱导小鼠发生UC,在UC小鼠肠黏膜中可见黏膜上皮及腺体损伤、大量炎性细胞浸润,与既往赵闪闪等[5]和Gao等[8]关于UC病理特征的研究结果一致。由NLRP3、ASC、Pro-Caspase-1组成的NLRP3炎症小体在炎性反应及免疫应答的调控中起着关键作用,该小体活化后,Pro-Caspase-1转化为有活性的Caspase-1并裂解pro-IL-1β、pro-IL-18,产生成熟的IL-1β、IL-18,从而调控炎性反应及免疫应答[9-11]。既往关于UC的研究[3-4]及本实验对UC小鼠肠黏膜中NLRP3炎症小体的研究均证实,肠黏膜中NLRP3、ASC、Caspase-1的表达水平及IL-1β、IL-18水平均明显升高,提示NLRP3炎症小体过度活化与UC发病有关。
在此基础上,本实验采用敲除NLRP3基因的方法来抑制炎症小体的活化、拮抗炎症小体活化在UC发病中的作用,旨在观察敲除NLRP3基因对UC的保护作用。NLRP3基因敲除纯合子小鼠肠黏膜中不表达NLRP3,说明NLRP3被完全敲除。对NLRP3基因敲除纯合子小鼠使用DSS诱导UC,与WT小鼠诱导的UC相比,前者的UC病理改变明显减轻,肠黏膜上皮细胞及腺体基本完整,未出现明显糜烂,仅少量炎性细胞浸润。进一步分析NLRP3炎症小体的活化可知,DSS诱导NLRP3基因敲除纯合子小鼠发生UC的过程中,ASC、Caspase-1的表达水平及IL-1β、IL-18水平明显降低。上述结果提示NLRP3基因敲除对DSS诱导的小鼠UC具有保护作用,能减轻组织病理损伤,抑制NLRP3介导炎性反应的激活。
UC发病过程中,炎性反应和免疫应答异常最终作用于肠黏膜,引起肠黏膜屏障功能损伤,并导致腹泻、黏液脓血便等临床症状[12-13]。DAO是特异性表达于肠上皮细胞的代谢酶,D-LA是肠道内细菌代谢的产物,肠黏膜屏障完整时DAO和D-LA不会释放进入血液循环,当肠黏膜屏障受损时,DAO和D-LA可释放进入血液循环[14]。本实验DSS诱导WT小鼠发生UC的过程中血清DAO及D-LA水平均明显升高,而DSS诱导NLRP3基因敲除小鼠发生UC过程中血清DAO及D-LA水平均较前者降低,说明NLRP3基因敲除对DSS诱导的UC小鼠的肠黏膜屏障损伤具有保护作用。
ZO-1和Occludin是维持肠黏膜屏障功能的紧密连接蛋白,其表达缺失与肠黏膜屏障受损直接相关[15-17]。本实验结果显示,DSS诱导WT小鼠发生UC的过程中ZO-1和Occludin表达水平均明显降低,而DSS诱导NLRP3基因敲除小鼠发生UC过程中ZO-1和Occludin的表达水平均较前者升高。该结果与血清中肠黏膜屏障相关指标的分析结果一致,进一步提示NLRP3基因敲除对DSS诱导的UC小鼠的肠黏膜屏障损伤具有保护作用。
综上所述,NLRP3基因敲除对DSS诱导的小鼠UC具有保护作用,能改善肠黏膜组织病理及肠黏膜屏障功能,未来有望成为UC治疗的新靶点。
