张家界大叶黄杨炭疽病的病原菌鉴定
2021-01-04吴曼颖熊兴耀
吴曼颖,熊兴耀
张家界大叶黄杨炭疽病的病原菌鉴定
吴曼颖1,熊兴耀2*
(1.吉首大学土木工程与建筑学院,湖南 张家界 427000;2.中国农业科学研究院农业基因组研究所,广东 深圳 518000)
对从湖南省张家界市永定区采集的疑似炭疽病的大叶黄杨病叶进行分离培养,获得1类纯化菌株,挑选代表菌株进行致病性测定,通过柯赫氏法则确定其为致病菌。依据菌落特征、分生孢子的形态特征,结合多基因的系统发育分析,代表分离菌株与暹罗炭疽菌()聚为一支。
大叶黄杨;炭疽病;形态鉴定;分子鉴定;张家界
大叶黄杨(Thumb)又名冬青卫矛、正木,为卫矛科(Celastraceae)卫矛属(L)常绿灌木或小乔木,在生长发育过程中主要受炭疽病、白粉病、褐斑病和疮痂病的危害,其中炭疽病发病率较高,病害多发生于叶部,严重时导致植株死亡。大叶黄杨作为园林观赏植物在湖南省大面积种植。已有的研究发现,中国浙江省[1]、四川省[2]、江苏省[3]大叶黄杨炭疽病的病原菌为,而韩国科学家LEE[4]则认为是大叶黄杨炭疽病的病原体。2019年笔者在湖南省张家界市对大叶黄杨真菌性病害调查时,在永定区大庸桥公园发现大叶黄杨叶片发生类似炭疽病的症状。为查明病因,采集了发病的大叶黄杨病叶样,对病原菌进行分离,并进行形态学观察、构建多基因系统发育树,以及柯赫氏法则验证,旨在为准确鉴定和及时有效防治该病害提供依据。
1 材料与方法
1.1 材料
2019年8—9月,在湖南省张家界市永定区大庸桥公园,发现大叶黄杨叶片出现类似炭疽病症状,遂采集大叶黄杨疑似炭疽病病叶。
1.2 方法
1.2.1病原菌的分离纯化及形态学鉴定
观察记录发病部位、发病症状,并进行病原菌分离和纯化。洗净病叶,用0.5%NaClO浸泡1 min后,用75%乙醇漂洗30 s,再用无菌水漂洗3次,取无菌滤纸吸干叶片表面水分。将病样剪成0.2~0.3 cm大小的方块,接种在PDA培养基上,在培养箱中26 ℃培养(暗培养)3 d后进行纯化,纯化培养物于26 ℃暗培养,定时观察记录菌落形态。
将分离得到的菌株接种在PDA培养基上,观察记录菌落的形态、色泽,并利用显微镜观察菌株孢子的形态特征。
1.2.2分离菌株的致病力检测
参照文献[5]的方法,以孢子悬浮液为接种体,选用健康叶片,用砂纸擦拭方法接种。于26 ℃恒温箱中保湿培养。接种后,每天观察记录发病情况。叶片发病后,从病部分离菌株,完成柯赫氏法则验证。
1.2.3多基因联合鉴定
菌落于PDA培养皿中长满后,挑取菌核,按照“DNAsecure Plant Kit”说明书提取菌株DNA,进行rDNA-ITS(ITS)[6]、部分肌动蛋白(ACT)基因[7]、甘油醛-3-磷酸脱氢酶(GAPDH)基因、部分β-微管蛋白(TUB2)[8]基因组区域、钙调蛋白(CAL)基因[9]、几丁质合酶(CHS-1)基因[10]的分析。
使用引物(表1)进行PCR扩增。每个反应体系包括25 μL Premix酶,上、下游引物各1 μL,1 μL DNA模板和22 μL水,总体积为50 μL。PCR扩增条件:94 °C预变性10 min;94 °C变性30 s,退火45 s,72 °C延伸1 min,共35个循环;72 ℃延伸7 min,4 ℃保存。将PCR扩增产物进行电泳检测,并送湖南省擎科生物技术有限公司进行双向测序。所产生的序列保存在NCBI基因库中。利用数据库已发表的序列与测序结果进行同源性对比分析。采用软件(MEGA 6)的最大似然法构建系统进化树,以确定病原菌的分类地位。
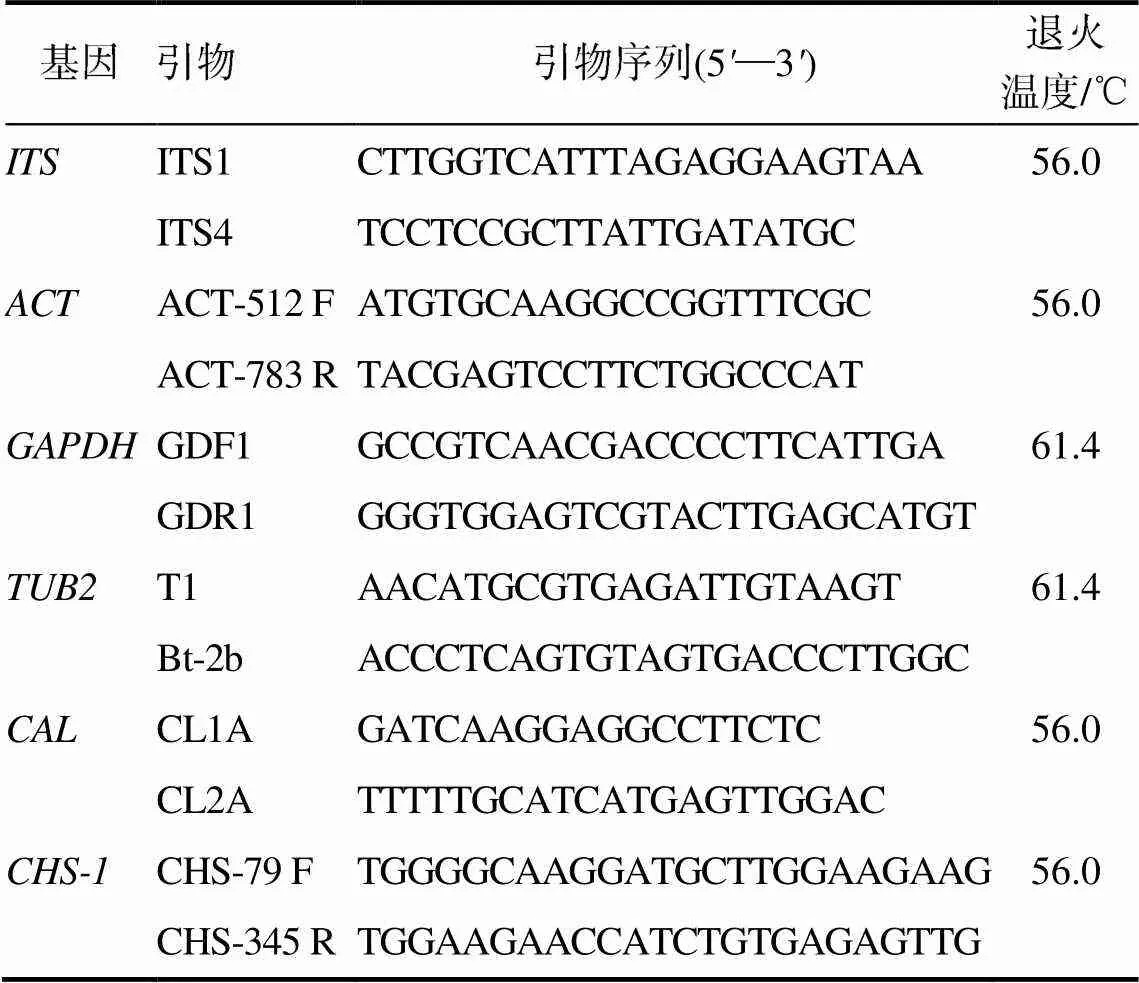
表1 引物序列及其退火温度
2 结果与分析
2.1 供试大叶黄杨病叶的病害症状与病原菌形态
大叶黄杨叶片出现的疑似炭疽病症状(图1-1、图1-2),发病初期,叶片的正面出现一些不规则的褪绿斑点(直径0.3~1.2 mm、平均0.7 mm),这些斑点扩大并聚结形成大的、规则的或不规则的褪绿到坏死斑点(图1-3)。大多数斑点最后会形成褐色或深褐色病斑(图1-4、图1-5)。病斑上有许多小黑点(分生孢子盘,图1-6),严重时病斑连片,叶片脱落。

1、2 发病严重的大叶黄杨;3 发病初期的症状;4 发病中期的症状;5 发病较重的症状;6 病斑上形成的小黑点。
将分离的菌株纯化后得到一类菌落,代表菌株EJ.W01菌落正面产生白色的气生菌丝(图2-1),背面为浅橙色(图2-2),培养10 d左右有少量橙色孢子堆产生。分生孢子单孢,透明,圆柱形,两端钝圆(图2-3)。随机选取100个分生孢子,测得孢子大小为( 12.3~18.1) μm ×( 3.4~7.2) μm。初步鉴定引起大叶黄杨炭疽病的病原菌为炭疽菌属真菌(spp.)。
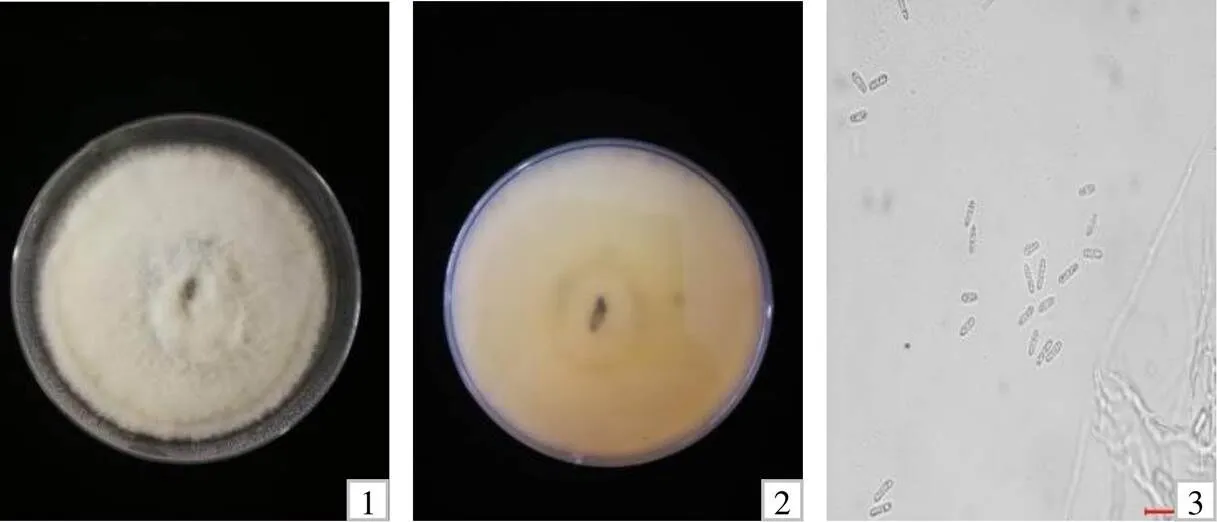
1 菌株EJ.W01培养7 d后正面;2 培养7 d后的背面;3 孢子形态。
2.2 病原菌的致病性
将分离的代表菌株EJ.W01的孢子悬浮液回接至擦伤的健康大叶黄杨叶片后,置于26 ℃保湿培养。接种5 d后,涂抹EJ.W01的孢子悬浮液的叶片均发病,病斑形态与林间发病症状相似,病斑大小无明显差异(图3),对照叶片未发病。将人工接种感病的叶片进行病原菌的分离,完成柯赫氏法则验证,原接种病原菌与所得病原菌形态特征一致,说明EJ.W01为大叶黄杨病叶的病原菌。

1 健康叶片;2 接种后发病叶片。
2.3 致病菌基因序列分析
以菌株EJ.W01的DNA为模板进行PCR扩增。以为外群构建,运用MEGA6.0进行多基因系统发育分析,比较来自代表菌株EJ.W01和.复合物的参考菌株的、、、、-和核苷酸序列。结果表明,EJ.W01与暹罗炭疽菌()形成进化支(图4),确定病原菌为暹罗炭疽菌()。

图4 运用MEGA6对分离菌株EJ.W01的多基因联合序列构建的系统进化树
3 结论与讨论
对湖南省张家界市永定区大叶黄杨炭疽病的病原菌进行鉴定,确定大叶黄杨叶片炭疽病的病原菌是暹罗炭疽菌()。炭疽病一直存在一病多菌的现象,大叶黄杨生长的环境不同,患病样本优势种群存在差异。在张家界采集的大叶黄杨炭疽病叶片中,没有发现、,这可能与患病样本的采集地有关,也可能是因为分离菌株的数量有限。
炭疽属真菌遗传多样性丰富,其分类较混乱。属于复合物的物种,由至少22种物种组成[11],仅凭形态特征和分生孢子并不能区分这些物种[12]。菌株形态学特征只能将菌株初步鉴定为炭疽属真菌。笔者分离纯化的菌株EJ.W01在形态特征上与复合物相似,可以初步判断属于炭疽属真菌。为进一步确认其分类水平,通过多基因位点分析来鉴定该菌株的分类地位。ITS区域虽然是最常用的区分真菌的区域[6],但普遍认为该序列不能较好地区分胶胞复合种里的近缘种sp.[11],而多基因位点分析广泛应用于炭疽菌(sp.)的分类[13]。笔者选择了6个基因区域(ITS,GAPDH,CAL,ACT,CHS-1和TUB2)对分离株进行分类,并成功地将分离株鉴定为。
[1] 桑华春,邱德勋.大叶黄杨炭疽病的病原初步研究[J].四川农业大学学报,1992,10(1):189-199. SANG H C,QIU D X.A preliminary study of etiology of anthracnose ofThunb.[J].Journal of Sichuan Agricultural University,1992,10(1):189-199.
[2] 王建伟,赖顺银,徐晓明.大叶黄杨炭疽病初步研究[J].浙江林学院学报,1986,3(2):73-82. WANG J W,LAI S Y,XU X M.A preliminary study on[J].Journal of Zhejiang Forestry University,1986,3(2):73-82.
[3] 陈新宏.大叶黄杨常见病虫害及其防治[J].安徽农学通报,2007,13(12):144-145. CHEN X H.Common diseases and insect pests ofand their control[J].Anhui Agricultural Science Bulletin,2007,13(12),144-145.
[4] LEE H B,PARK J Y,JUNG H S,et al.First report of leaf anthracnose caused by Colletotrichum boninense on spindle trees[J].Plant Pathology,2005,54(2):254.
[5] 李沛利,李娟,龚国淑,等.四川省鹅掌柴炭疽病病原菌的初步鉴定[J].植物病理学报,2017,47(3):296-304. LI P L,LI J,GONG G S,et al.Pathogen identification of anthracnose onin Sichuan Province[J].Acta Phytopathologica Sinica,2017,47(3):296-304.
[6] WHITE T J,BRUNS T,LEE S,et al.Amplification and direct seqencing of fungal ribosomal RNA genes for phylogenetics[M]// PCR Protocols. Amsterdam:Elsevier,1990:315-322.
[7] CARBONE I,KOHN L M..A method for designing primer sets for speciation studies in filamentous ascomycetes[J].Mycologia,1999,91(3):553.
[8] CANNON P F,DAMM U,JOHNSTON P R,et al.current status and future directions[J]. Studies in Mycology,2012,73:181-213.
[9] GLASS N L,DONALDSON G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology,1995,61:1323-1330.
[10] O’DONNELL K,NIRENBRG H I,AOKI T,et al.A multigene phylogeny of thespecies complex:detection of additional phylogenetically distinct species[J].Mycoscience,2000,41(1):61-78.
[11] WEIR B S,JOHNSTON P R,DAMM U.Thespecies complex[J]. Studies in Mycology,2012,73:115-118.
[12] LIU F L,TANG G T,ZHENG X J,et al.Molecular and phenotypic characterization ofspecies associated with anthracnose disease in peppers from Sichuan Province,China[J].Scientific Reports,2016,6:32761.
[13] CAI L,HYDE K D,TAYLOR P,WEIR B,et al.A polyphasic approach for studying[J]. Fungal Diversity,2009,39:183-204.
Pathogen identification of anthracnose onin Hunan Province
WU Manying1,XIONG Xingyao2*
(1.School of Civil Engineering and Architectural, Jishou University, Zhangjiajie, Hunan 427000, China; 2.Institute of Agricultural Genomics, Chinese Academy of Agricultural Sciences, Shenzhen, Guangdong 518000, China)
The diseased leaves ofcollected from Yongding District, Zhangjiajie City, Hunan Province were collected, and pathogen isolation and cultivation were conducted. A purified class 1 strain was obtained, and the representative strains were selected for pathogenicity test and identified as pathogenic fungi by Koch’s law. According to the characteristics of colony and conidia morphology,combined with the phylogenetic analysis of polygenes, the representative isolates were clustered withto one branch.
; anthracnose; pathogen identification; molecular identification; Zhangjiajie City
S763.15
A
1007-1032(2020)06-0706-05
吴曼颖,熊兴耀.张家界大叶黄杨炭疽病的病原菌鉴定[J].湖南农业大学学报(自然科学版),2020,46(6):706-710.
WU M Y,XIONG X Y. Pathogen identification of anthracnose onin Hunan Province[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 706-710.
http://xb.hunau.edu.cn

2020-05-26
2020-11-09
湖南省作物种质创新与资源利用重点实验室开放项目(17KFXM07)
吴曼颖(1983—),女,湖南慈利人,博士,讲师,主要从事园林植物研究,wumanying911@126.com;*通信作者,熊兴耀,博士,教授,主要从事马铃薯病害研究,xiongxingyao@caas.cn
10.13331/j.cnki.jhau.2020.06.011
责任编辑:罗慧敏
英文编辑:罗维
