生长素在烟草表皮毛中的极性运输及对细胞伸长的影响
2021-01-04潘嘉立赵燕黄丽华高晗黄妤陈金军张学文
潘嘉立,赵燕,黄丽华,高晗,黄妤,陈金军,张学文
生长素在烟草表皮毛中的极性运输及对细胞伸长的影响
潘嘉立,赵燕,黄丽华,高晗,黄妤,陈金军,张学文*
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
利用生长素极性运输转运蛋白PIN1与增强绿色荧光蛋白EGFP的融合,对PIN1进行了荧光标记,并以烟草表皮毛为模式,开展了PIN1对生长素极性运输及对细胞伸长生长影响的研究。采用DNA重组技术,将融合标记基因置于拟南芥表皮毛特异表达基因的启动子调控下,构建成含的Ti质粒,以根癌农杆菌叶盘共培转化法将重组标记基因转化至烟草WS38中,筛选鉴定出多株转基因烟草。通过对这些转基因烟草表皮毛进行显微荧光观察,结果发现,标记的绿色荧光信号集中分布在表皮毛细胞的间隔区,表现为明显的极性分布现象。用生长素极性运输抑制剂三碘苯甲酸(TIBA)处理后,表皮毛的伸长生长受到抑制,细胞中荧光的分布极性减弱。说明生长素在烟草表皮毛中的极性分布对烟草表皮毛伸长起关键作用,抑制生长素的极性运输不只抑制表皮毛的细胞伸长,同时还影响到生长素极性运输蛋白PIN的极性分布。
烟草;生长素;极性运输;表皮毛;细胞伸长
植物细胞的伸长生长是细胞初生生长的主要过程,决定了细胞成熟后的长度和大小。这一过程涉及细胞骨架的方向性延展、细胞膜的增大及细胞壁的延伸等细胞变化。对于纤维植物而言,细胞初生生长是决定纤维长度,进而决定其产量品质的重要因素。在研究植物细胞伸长生长过程中,多细胞的表皮毛提供了一个较好的模式[1-2]。在拟南芥表皮毛细胞中过表达生长素合成基因,可以显著增加叶片表皮毛的分布密度,但表皮毛长度无显著变化[3]。而在烟草的表皮毛细胞中过表达,则可促进其细胞的伸长生长[4]。对这两者的差异性有必要进行深入研究。
植物生长素是调节细胞生长发育的重要激素,它参与细胞伸长的调节,是构成植物向性生长的基础。在拟南芥向光性生长中,通过对生长素响应分子标记的研究,发现拟南芥的下胚轴背光侧有更高浓度的生长素分布,促进背光侧细胞相对更多的伸长生长,使胚轴向光的方向弯曲[5]。在植物叶原基、侧枝原基、侧根原基及花原基等器官启动时,都在原基位点形成生长素极高值的分布点[6]。生长素的极性分布主要依赖于1种关键转运蛋白(PIN)对生长素在临近细胞间的极性运输来实现。事实上PIN是植物中广泛存在的一类生长素输出载体家族蛋白[7],在拟南芥中已鉴定出8个家族成员,分别在不同的组织或信号反应中参与生长素的极性运输[8]。通过对PIN蛋白进行标记,结合对生长素响应的启动子,如GH3、Dr5等调控报告基因,进行GUS标记,是目前研究生长素极性运输和浓度分布的常用方法[9-10]。
为了验证烟草表皮毛细胞中生长素的极性运输,本研究中,以增强型绿色荧光蛋白EGFP对拟南芥生长素极性运输载体蛋白PIN1进行了融合标记,采用拟南芥表皮毛细胞特异表达的GL2启动子,构建1个含融合基因的Ti质粒载体,通过根癌农杆菌介导的叶盘共培养法转化烟草WS38,对转基因烟草表皮毛细胞开展荧光观察,探究烟草表皮毛细胞中PIN存在的极性分布情况;以生长素极性运输阻断试剂TIBA进行处理,观察表皮毛中PIN的分布情况及表皮毛形态的变化,旨在研究烟草单向伸长性多细胞的表皮毛细胞中生长素的极性运输对其表皮毛伸长的影响。
1 材料与方法
1.1 材料
烟草()品种 WS38。大肠埃希菌()InvaF¢、根癌农杆菌()LBA4404和Ti质粒载体pEGAD均为湖南农业大学细胞生物学实验室保存。
1.2 方法
1.2.1标记载体pEGAD-的构建
从Nucleotide数据库中获得拟南芥生长素极性运输载体蛋白核心序列(登录号AF089085.1),根据其cds序列设计2条特异性引物,上游引物为5¢-CC CATGATTACGGCGGCGGA-3¢,下游引物为5¢-CGGTTTTGGTAATATCTCTTCATA GACC-3¢,其中下划线部分分别为限制性内切酶RⅠ和HⅠ酶切位点。根据载体序列设计2条同源重组引物,上游引物为5¢-GCTGCGGCA GCGGCCGAATTCATGATTACG GCGGCGGA-3¢,下游引物为5¢-CAGTTATCTAGATCCGGTGGATC CGTTTTGGTAATATCTCTTCATAGACC-3¢,用同源重组引物对PIN1片段cDNA进行PCR扩增,同时用限制性内切酶RⅠ和HⅠ对载体进行双酶切,纯化2种产物,进行同源重组并转化大肠埃希菌。小量提取构建的重组质粒,用电激法转化根癌农杆菌LBA4404,获得工程化根癌农杆菌。
构建的EGFP对PIN1标记表达载体pEGAD-T-DNA区如图1所示。
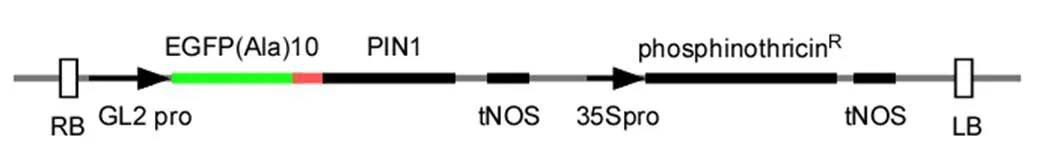
图1 植物表达载体pEGAD-GL2pro::EGFP- PIN1 T-DNA区
1.2.2转基因烟草和拟南芥的转化和筛选
选取烟草WS38野生型无菌苗幼嫩的叶片,切成0.5 cm小块,接种于愈伤组织诱导培养基上,预培养2 d后侵染,28 ℃暗培养3 d,将共培养的外植体转移至加有10.0 g/mL 草胺膦(phosphinothricin, ppt)和羧苄青霉素(Carbenicillin, carb)的分化培养基(MS+0.1 mg/L NAA+1.0 mg/L 6-BA+500.0 mg/L Carb+7 g/L Agar)上。待选择培养3周后,将外植体转化细胞分化出的抗性不定芽转移到继代培养基上,待不定芽长至1 cm左右时将其切下,并转移至含有选择压力的生根培养基(1/2 MS+0.05 mg/L NAA+10.0 g/mL ppt+7.0 g/L Agar)上培养,2~3周长出不定根。将再生的抗性植株进行炼苗和移栽,用CTAB法提取单株植株DNA,用PCR扩增的方法鉴定植株转基因情况。
1.2.3烟草转基因苗的分子检测
用CTAB法提取经过抗性筛选的烟草叶片总DNA,取100 ng DNA为模板,以GL2启动子区域特异性引物5¢-CCCGAGCTCTTTCCTTCACTATAC -3¢和5¢-CCCACCGGTCAAATCCTGTCCCT-3¢进行PCR检测,琼脂糖凝胶电泳后鉴定转基因烟草。
1.2.4转基因烟草表皮毛的观察
分别取烟草幼嫩叶芽及成熟叶片的叶尖、叶缘中部或叶基部置于显微镜下,以395 nm波长紫外光作为激发光,观察转基因烟草表皮毛的荧光分布并拍照记录,以非激发状态为对照。
配置浓度为7.0 mg/L生长素极性运输抑制剂三碘苯甲酸(TIBA),对转基因烟草进行浇灌与顶端喷洒。1~2 d后,取新长的幼叶进行表皮毛荧光观察并拍照,记录表皮毛的长度。
2 结果与分析
2.1 转基因烟草植株的鉴定
转化筛选培育的试管苗经炼苗后移栽至基质中,获得5株独立转化的烟草抗性苗。
利用检测引物对5株抗性烟草苗进行PCR检测,以质粒模板作为阳性对照,野生型烟草作为阴性对照。经鉴定,5株烟草抗性苗全为转基因植株(图2)。
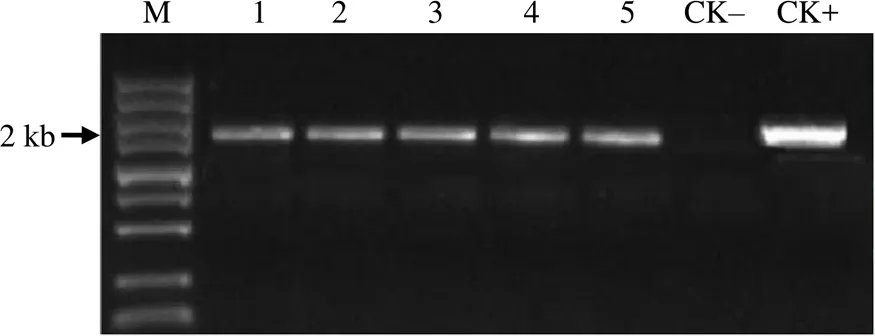
M DNA Marker;泳道1~5为5株独立转基因苗;CK-为非转基因烟草DNA模板的阴性对照;CK+为质粒模板的阳性对照。
2.2 转基因烟草表皮毛标记的荧光观察结果
以OLYMPUS BX41显微镜观察叶尖、叶中和叶基部3个部位叶沿位置伸展的表皮毛细胞,对比395 nm波长激发荧光和无激发的普通光学下表皮毛中荧光的分布。结果如图3所示。

a1、a2 叶基部叶沿;b1、b2 叶中部叶沿;c1、c2 叶尖部叶沿;d1、d2 野生型对照叶中部;a1、b1、c1及d1均为荧光激发观察结果,a2、b2、c2和d2分别为对应的非激发状态的观察结果。
从图3可以看出,转基因烟草表皮毛中绿色荧光大部分集中分布在表皮毛的细胞间隔处,并朝细胞长轴的顶端分布,说明生长素极性运输蛋白在细胞的长极端存在极性分布现象。根据烟草表皮毛发育的进程,其叶尖部位表皮毛发育较早,表皮毛细胞相对成熟,而叶基部发育相对较迟,细胞正处于快速伸长生长期,细胞间的荧光较为均匀。野生型对照烟草表皮毛在激发状态下,其腺性表皮毛顶端细胞及细胞间可以观察到微弱橘红色荧光,但没有观察到绿色荧光分布,可能是其腺细胞内含物的激发荧光。
2.3 TIBA处理后烟草表皮毛的观察结果
经TIBA处理1~2 d后的烟草表皮毛,在395 nm波长激发光照射下观察表皮毛中荧光分布情况(图4),发现绿色荧光在表皮毛中极性减弱或游离分布在表皮毛细胞中,表明TIBA抑制生长素的极性运输,使PIN的极性分布受阻。
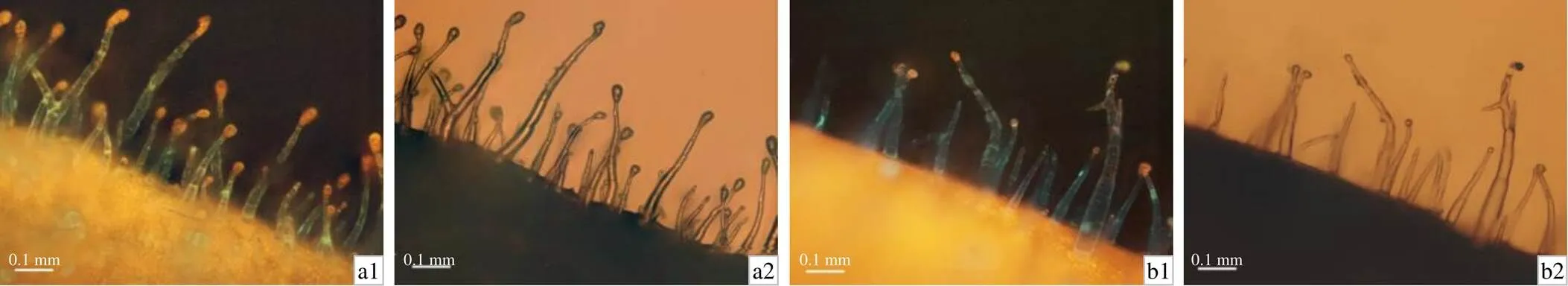
a1、a2 叶中部叶沿;b1、b2 叶尖部叶沿。a1和b1为激发荧光下的观察结果,a2和b2为非激化状态的观察结果。
在体视显微镜下,选取5个视野分别进行表皮毛长度统计,幼嫩区叶片叶沿表皮毛长度平均值为0.289 mm,成熟区叶片叶沿表皮毛长度平均值为0.465 mm;经TIBA处理后的幼嫩区叶片叶沿表皮毛长度平均值为0.253 mm,成熟区叶片叶沿表皮毛长度平均值为0.319 mm。结果如图5所示。经TIBA处理的烟草叶片表皮毛与未经处理的表皮毛发育早期其长度无显著性差异,表皮毛发育成熟期叶片表皮毛长度存在显著性差异。

A 叶片幼嫩区表皮毛;B TIBA处理后幼嫩区叶片表皮毛;C 表皮毛发育成熟区表皮毛;D TIBA处理后表皮毛发育成熟区表皮毛。“**”示差异极显著。
3 结论与讨论
生长素的浓度和分布对不同细胞类型的影响不同。近十几年来,随着对生长素极性运输研究的不断深入,发现生长素在植物中不仅存在于茎尖向根的长距离极性运输,也存在植物局部组织中细胞间的极性运输,极性运输在根尖还造成生长素的环流[11-12]。生长素在植物局部组织细胞间的极性运输主要依靠PIN来实现。如果相邻细胞内的PIN都朝向一个中心点分布,就可以使生长素汇聚到中心区的细胞,形成生长素浓度的极值分布点,这是促进器官原基形成的基础。
本研究中,通过绿色荧光蛋白对生长素极性运输进行PIN的标记,在烟草表皮毛中观察到PIN的极性分布,验证了生长素对烟草表皮毛的极性促伸长作用。当用生长素极性运输抑制剂TIBA处理烟草后,其表皮毛伸长作用被显著抑制,PIN在表皮毛细胞中的分布极性也受到了影响,荧光标记在细胞中出现更多弥散性的信号。说明在烟草的表皮毛中,PIN的极性分布与生长素的极性运输对细胞伸长的作用是直接相关的。
[1] SWEN S,MARTIN H. Epidermal differentiation: trichomes in Arabidopsis as a model system[J]. International Journal ofDevelopment Biology,2005,49:579-584.
[2] HÜLSKAMP M.Plant trichomes:a model for cell differentiation[J].Nature Reviews Molecular Cell Biology,2004,5:471480.
[3] ZHAO Y,HUANG L H,PENG Y,et al.Trichome expression oftransgene influences their development and elongation in tobacco[J].Russian Journal of Plant Physiology,2013,60(6):839-844.
[4] 谢德雄,潘嘉立,赵燕,等.烟草和拟南芥表皮毛中特异表达后的遗传效应[J].湖南农业大学学报(自然科学版),2018,44(3):284-289. XIE D X,PAN J L,ZHAO Y,et al.The genetic effect analysis ofspecific expressed in trichome in tobacco and[J].Journal of Hunan Agricultural University(Natural Sciences),2018,44(3):284-289.
[5] FRIML J,WIŚNIEWSKA J,BENKOVÁ E,et al.Lateral relocation of auxin efflux regulator PIN3mediates tropism in[J].Nature,2002,415(6873):806-809.
[6] DEMASON D A,POLOWICK P L.Patterns ofexpression in organs of pea()[J]. International Journal of Plant Sciences,2009,170(1):1-11.
[7] ADAMOWSKI M,FRIML J.PIN-dependent auxin transport:action,regulation,and evolution[J].The Plant Cell,2015,27(1):20-32.
[8] KŘEČEK P,SKŮPA P,LIBUS J,et al.The PIN- FORMED(PIN) protein family of auxin transporters[J]. Genome Biology,2009,10(12):249.
[9] HÜLSKAMP M.Plant trichomes:a model for cell differentiation[J].Nature Reviews Molecular Cell Biology,2004,5(6):471-480.
[10] HAGEN G,GUILFOYLE T.Auxin-responsive gene expression:genes,promoters and regulatory factors[M]// PERROT-RECHENMANN C,HAGEN G.Auxin Molecular Biology.Dordrecht:Springer,2002.
[11] 何静,丁兰,李芃,等.Leukamenin E调节拟南芥幼苗根部生长素极性运输及根系生长发育[J].生态学杂志,2019,38(10):2959-2967. HE J,DING L,LI P,et al.Regulation of leukamenin E on polar auxin transport and root growth and development inseedlings[J]. Chinese Journal of Ecology,2019,38(10):2959-2967.
[12] 邹纯雪,门淑珍.生长素的外输载体PIN蛋白家族研究进展[J].中国细胞生物学学报,2013,35(5):574-582. ZOU C X,MEN S Z.Research advances in auxin efflux carrier PIN proteins[J].Chinese Journal of Cell Biology,2013,35(5):574-582.
The polar transport of the auxin in tobacco trichome and its effect on cell elongation
PAN Jiali, ZHAO Yan, HUANG Lihua, GAO Han, HUANG Yu, CHEN Jinjun, ZHANG Xuewen*
(College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha, Hunan 410128, China)
In this study, the enhanced green fluorescent protein(EGFP) was combined with auxin polar transporter PIN1 and made it fluorescently labeled. The effects of PIN1 on auxin polar transport and cell elongation growth were studied in tobacco trichome. The fusion label genewas recombined under the promoter of the trichome specific expression genefromto enable it specific expression in the transgenic. The recombinantwas constructed in the Ti plasmid pEGAD and then transformed into tobacco WS38 bymediated leaf disc co-culture transformation. Several transgenic tobacco plantlets were screened out and identified. The fluorescence observation of these transgenic tobacco trichome showed that the labeled green fluorescence signals appeared in the interval area of the trichome cells with an obvious polarity distribution. It enables the polarity transport of auxin in trichrome cells and forms a polarity distribution of axuin. After treatment with the auxin polar transport inhibitor triiodobenzoic acid (TIBA), the elongation growth of trichome was significantly inhibited and the polarity distribution of fluorescence in cells was also weakened. Thus, we conclude that the polarity distribution of auxin in tobacco trichome plays a key role in the elongation of tobacco trichome. Inhibition of auxin polar transport not only inhibited cell elongation of trichome, but also affected the polarity distribution of auxin polar transport protein PIN.
tobacco; auxin; polarity transport; trichome; cell elongation
S572;Q943
A
1007-1032(2020)06-0686-05
潘嘉立,赵燕,黄丽华,高晗,黄妤,陈金军,张学文.生长素在烟草表皮毛中的极性运输及对细胞伸长的影响[J].湖南农业大学学报(自然科学版),2020,46(6):686-690.
PAN J L, ZHAO Y, HUANG L H, GAO H, HUANG Y, CHEN J J, ZHANG X W. The polar transport of the auxin in tobacco trichome and its effect on cell elongation[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 686-690.
http://xb.hunau.edu.cn

2019-12-16
2020-01-17
湖南省教育厅重点科研项目(18A104)
潘嘉立(1995—),男,湖南岳阳人,硕士研究生,主要从事植物遗传学研究,284774653@qq.com;*通信作者,张学文,博士,教授,主要从事细胞生物学研究,xwzhang@hunau.edu.cn
10.13331/j.cnki.jhau.2020.06.008
责任编辑:毛友纯
英文编辑:柳正
