NPHP3-AS1通过调控miR-30a-5p影响缺氧诱导的心肌细胞增殖及凋亡的研究
2021-01-04王苗王裕岱黄玉冰陈芬王圣李斌董小莉
王苗,王裕岱,黄玉冰,陈芬,王圣,李斌,董小莉
急性心肌梗死是临床常见的一种疾病类型,随着现代生活节奏的加快,急性心肌梗死的发病率逐年升高,且呈年轻化趋势,已严重影响人类生活质量,目前临床主要采用经皮冠状动脉介入治疗等手段治疗急性心肌梗死,但随之产生的再灌注损伤问题已引起高度重视,研究表明心肌细胞凋亡增多与心肌缺血再灌注损伤的严重程度呈正相关[1-4]。目前关于心肌缺血再灌注损伤的发病机制尚未完全阐明,因而深入探究心肌缺血再灌注损伤发生及发展的分子机制对提高治疗效果及改善患者预后均具有重要意义。长链非编码RNA(Long non-coding RNA,LncRNA)广泛参与信号传导,影响细胞代谢、生长、分化、凋亡和死亡等过程,在心血管疾病的发生发展中有重要意义。在研究外泌体lncRNA HCG15在急性心肌梗死中的作用机制时发现,与对照组对比,NPHP3-AS1在急性心肌梗死患者中显著上调[5]。但NPHP3-AS1在心肌缺血再灌注损伤过程中的作用机制尚未可知。通过生物信息学分析显示微小RNA(miRNA)的靶基因包括NPHP3[6]。又有研究表明miR-30a-5p在心力衰竭患者中表达下调,并可能作为早期诊断心力衰竭的重要指标[7]。因此,本研究主要探讨NPHP3-AS1对缺氧诱导的心肌细胞增殖及凋亡的影响,并探究其对miR-30a-5p的靶向调控作用,为心肌缺血再灌注损伤的治疗提供新方向。
1 材料与方法
1.1 实验材料与试剂大鼠心肌细胞H9C2购自美国ATCC公司;杜氏改良培养基(DMEM)购自美国Gibco公司;胎牛血清购自上海玉博生物科技有限公司;Lipofectamine2000与Trizol试剂购自美国Invitrogen公司;反转录与实时荧光定量PCR试剂盒购自日本TaKaRa公司;NPHP3-AS1小分子干扰RNA(si-NPHP3-AS1)、乱序无意义阴性序列(si-NC)、miR-30a-5p寡核苷酸模拟物(miR-30a-5p mimics)及阴性对照mimic NC序列(miR-NC)、miR-30a-5p特异性寡核苷酸抑制剂(anti-miR-30a-5p)购自上海吉玛制药技术有限公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒购自北京博尔迈生物技术有限公司;兔抗鼠半胱氨酰天冬氨酸特异性蛋白酶3(cysteinyl aspartatespecific protease 3,Caspase3)、增殖标记蛋白细胞增殖核抗原 67(Antigen identified by monoclonal antibody,Ki67)抗体购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自美国Abcam公司。
1.2 研究方法
1.2.1 实验分组取对数生长期心肌细胞接种于不含血清的培养基内,继续培养24 h,转移至厌氧培养箱(95%N2、5%CO2)内培养3 h,建立心肌细胞损伤模型,随后将其转移至37 ℃、体积分数5%CO2培养箱常规培养1 h[8]。将缺氧处理的心肌细胞作为模型组。同时将正常培养的心肌细胞作为对照组。分别将si-NC、si-NPHP3-AS1、antimiR-30a-5p、si-NPHP3-AS1与anti-miR-30a-5p转染至心肌细胞,随后进行缺氧处理,分别记作模型组+si-NC组、模型组+si-NPHP3-AS1组、模型组+anti-miR-30a-5p组、模型组+si-NPHP3-AS1+anti-miR-30a-5p组。
1.2.2 实时荧光定量聚合酶链反应(Quantitative Real-time PCR,qRT-PCR)检测细胞中NPHP3-AS1、miR-30a-5p的表达水平收集各组心肌细胞,采用Trizol法提取细胞总RNA。应用紫外分光光度计测定RNA浓度。反转录体系:5×gDNA Buffer 2 μl,10×King RT Buffer 2 μl,FastKing RT Enzyme Mix 1 μl,FQ-RT Primer Mix 2 μl,RNA(2 μg),RNase-Free dd H2O补足体系至20 μl;反应条件:42 ℃ 15 min,95 ℃3 min。反转录得到cDNA。NPHP3-AS1正向引物5’-AGGCAATG TGTCATCCTGGA-3’,反向引物5’-AAAATCCATTGCCCAGCCAG-3’;miR-30a-5p正向引物5’-GGCAAGGAGGAC AAATACGC-3’,反向引物5’-TCCTGGAC TCAAGCAAACCT-3’;GAPDH正向引物5’-AACGGATTTGGTCGTATTG-3’,反向引物5’-GGAAGATGGTG ATGGGATT-3’;U6正向引物5’-ATTGGAACGATACAGAG AAGATT-3’,反向引物5’-GGAAC GCT TCACGAATTTG-3’,引物均由上海生工生物工程股份有限公司合成。以cDNA为模板进行qRTPCR扩增,反应体系:10×PCR Buffer 2.5 μl,MgSO4 2.5 μl,dNTPs 2.5 μl,正反向引物各0.5 μl,cDNA 2 μl,RNase-Free dd H2O补足体系至25 μl;反应条件:95 ℃预变性60 s,95 ℃变性60 s,56 ℃退火30 s,72 ℃延伸30 s,共36次循环,NPHP3-AS1以GAPDH为内参,miR-30a-5p以U6为内参,采用2-ΔΔCt法计算NPHP3-AS1、miR-30a-5p的相对表达量。
1.2.3 检测细胞周期收集各组对数生长期心肌细胞,使用0.25%胰蛋白酶消化,调整细胞密度为1×106个/ml,4 ℃条件下经3000 r/min离心5 min,加入预冷PBS洗涤,加入500 μl预冷PBS重悬细胞,分别加入70%乙醇(3.5 ml),充分混匀,4 ℃条件下孵育24 h,4 ℃条件下经3000 r/min离心5 min,弃上清,加入PBS洗涤,相同条件下离心后其上清,收集细胞沉淀,加入50 μl RNaseA,37 ℃条件下水浴30 min,加入PI染液孵育30 min,应用流式细胞仪检测细胞周期,并计算G0-G1期、S期、G2-M期细胞比例。
1.2.4 流式细胞术检测细胞凋亡率收集各组对数生长期心肌细胞,加入预冷PBS洗涤,4 ℃条件下经3000 r/min离心6 min,其上清,相同条件下再次洗涤,弃上清,收集细胞沉淀,向细胞沉淀中加入500 μl结合缓冲液重悬细胞,依次分别加入5 μl Annexin V-FITC与5 μl PI,室温振荡孵育10 min,应用FACS Calibur流式细胞仪检测细胞凋亡率。
1.2.5 双荧光素酶报告基因检测NPHP3-AS1的靶基因starBase预测显示NPHP3-AS1与miR-30a-5p存在结合位点,采用基因突变技术将结合位点进行突变,分别将含有结合位点与突变位点的基因序列插入荧光素酶报告基因载体分别构建野生型载体WT-NPHP3-AS1与突变型载体MUTNPHP3-AS1,参照荧光素酶活性检测试剂盒说明书检测各组荧光素酶活性。分别将si-NC、si-NPHP3-AS1转染至心肌细胞,采用qRT-PCR检测各组细胞中miR-30a-5p的表达水平。
1.2.6 蛋白免疫印迹(Western blot)检测Caspase3、Ki67蛋白表达收集各组心肌细胞,加入RIPA裂解液提取细胞总蛋白,采用BCA法检测蛋白浓度,严格按照试剂盒说明书进行操作,取蛋白样品,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜,封闭,分别加入Caspase3(1:1000)、Ki67(1:1000)与内参蛋白GAPDH(1:1000)一抗稀释液,4 ℃条件下孵育24 h,TBST洗涤,分别加入二抗稀释液(1:2000),室温孵育1 h,暗室内曝光显影,应用Quantityone软件检测条带灰度值。
1.3 统计学分析采用SPSS 21.0统计学软件分析数据,本研究计量资料均符合正态分布,以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 NPHP3-AS1在缺氧诱导的心肌细胞中的表达与对照组比较,模型组心肌细胞中NPHP3-AS1的表达水平显著升高(P<0.05)(表1)。
2.2 干扰NPHP3-AS1对缺氧诱导的心肌细胞增殖、凋亡的影响与对照组比较,模型组G0-G1期细胞比例显著升高(P<0.05),S期细胞比例显著降低(P<0.05),细胞凋亡率显著升高(P<0.05);与模型组、模型组+si-NC组比较,模型组+si-NPHP3-AS1组G0-G1期细胞比例显著降低(P<0.05),S期细胞比例显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),各组间G2-M期细胞比例比较差异无统计学意义(P>0.05)(图1、表2)。
2.3 干扰NPHP3-AS1对缺氧诱导的心肌细胞中Caspase3及Ki67表达的影响与对照组比较,模型组Caspase3蛋白水平显著升高(P<0.05),Ki67蛋白水平显著降低(P<0.05);与模型组、模型组+si-NC组比较,模型组+si-NPHP3-AS1组Caspase3蛋白水平显著降低(P<0.05),Ki67蛋白水平显著升高(P<0.05)(图2、表3)。
2.4 NPHP3-AS1靶向调控miR-30a-5pstarBase预测显示NPHP3-AS1与miR-30a-5p存在结合位点见图3。双荧光素酶报告实验结果显示,共转染突变型载体WT-NPHP3-AS1的细胞实验中,与miR-NC组比较,miR-30a-5p组荧光素酶活性显著降低(P<0.05);共转染野生型载体MUT-NPHP3-AS1的细胞实验中,miR-30a-5p组荧光素酶活性与miR-NC组比较差异无统计学意义(P>0.05)(表4)。与si-NC组比较,si-NPHP3-AS1组miR-30a-5p的表达水平显著升高(P<0.05)(表5)。
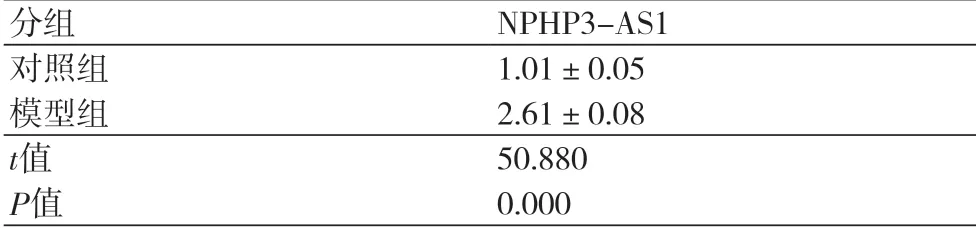
表1 NPHP3-AS1在缺氧诱导的心肌细胞中的表达
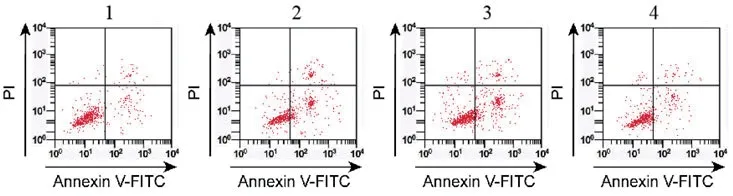
图1 干扰NPHP3-AS1对缺氧诱导的心肌细胞凋亡率的影响

表2 干扰NPHP3-AS1对缺氧诱导的心肌细胞增殖凋亡的影响

图2 Caspase3和Ki67蛋白的表达
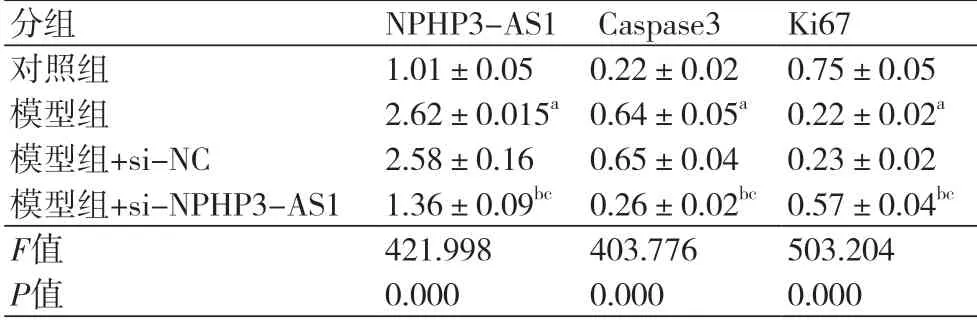
表3 Caspase3和Ki67蛋白的表达
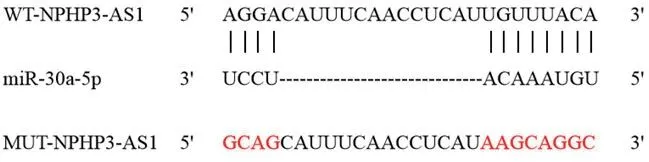
图3 NPHP3-AS1靶向miR-30a-5p

表4 双荧光素酶报告实验

表5 miR-30a-5p的表达
2.5 干扰miR-30a-5p能逆转干扰NPHP3-AS1对缺氧诱导的心肌细胞增殖凋亡的作用与模型组比较,模型组+anti-miR-30a-5p组G0-G1期细胞比例显著升高(P<0.05),S期细胞比例显著降低(P<0.05),细胞凋亡率显著升高(P<0.05);与模型组+si-NPHP3-AS1组比较,模型组+si-NPHP3-AS1+anti-miR-30a-5p组G0-G1期细胞比例显著升高(P<0.05),S期细胞比例显著降低(P<0.05),细胞凋亡率显著升高(P<0.05);与模型组+anti-miR-30a-5p组比较,模型组+si-NPHP3-AS1+anti-miR-30a-5p组G0-G1期细胞比例显著降低(P<0.05),S期细胞比例显著升高(P<0.05),细胞凋亡率显著降低(P<0.05)(图4、表6)。

图4 干扰miR-30a-5p能逆转干扰NPHP3-AS1对缺氧诱导的心肌细胞凋亡率的影响

表6 干扰miR-30a-5p能逆转干扰NPHP3-AS1对缺氧诱导的心肌细胞增殖凋亡的影响
2.6 干扰miR-30a-5p能逆转干扰NPHP3-AS1对缺氧诱导的心肌细胞中Caspase3及Ki67表达的作用与模型组比较,模型组+si-NPHP3-AS1组miR-30a-5p的表达水平显著升高(P<0.05),Caspase3蛋白水平显著降低(P<0.05),Ki67蛋白水平显著升高(P<0.05),而模型组+antimiR-30a-5p组miR-30a-5p的表达水平显著降低(P<0.05),Caspase3蛋白水平显著升高(P<0.05),Ki67蛋白水平显著降低(P<0.05);与模型组+si-NPHP3-AS1组比较,模型组+si-NPHP3-AS1+anti-miR-30a-5p组miR-30a-5p的表达水平显著降低(P<0.05),Caspase3蛋白水平显著升高,Ki67蛋白水平显著降低(P<0.05);与模型组+anti-miR-30a-5p组比较,模型组+si-NPHP3-AS1+anti-miR-30a-5p组miR-30a-5p的表达水平显著升高(P<0.05),Caspase3蛋白水平显著降低(P<0.05),Ki67蛋白水平显著升高(P<0.05)(图5、表7)。

图5 Caspase3和Ki67蛋白的表达

表7 Caspase3和Ki67蛋白的表达
3 讨论
LncRNA属于内源性非编码RNA分子,其本身不具有编码蛋白的功能,但其可通过充当miRNA的海绵分子而调控其靶基因表达从而参与急性心肌梗死等多种心血管疾病的发生及发展过程,还可能通过调节心肌细胞增殖及凋亡过程从而参与心肌细胞损伤过程[9-13]。但仍有部分LncRNA在心肌缺血再灌注损伤过程中的作用机制尚未完全阐明。
本研究结果显示缺氧处理后心肌细胞中NPHP3-AS1的表达水平显著升高,提示NPHP3-AS1在心肌缺血再灌注损伤过程中可能发挥重要调控作用。为探究NPHP3-AS1在心肌缺血再灌注损伤中的作用机制,本研究将si-NPHP3-AS1转染至心肌细胞,结果显示缺氧处理后G0-G1期细胞比例显著升高,S期细胞比例显著降低,而细胞凋亡率显著升高,说明缺氧处理可诱导心肌细胞周期阻滞从而抑制细胞增殖并可促进细胞凋亡,进一步分析显示干扰NPHP3-AS1表达后G0-G1期细胞比例显著降低,S期细胞比例显著升高,细胞凋亡率显著降低,提示干扰NPHP3-AS1表达可通过调控细胞周期而促进缺氧诱导的心肌细胞增殖及抑制细胞凋亡。研究表明细胞接收到凋亡信号时,线粒体释放细胞色素C进而激活Caspase3级联反应从而诱导细胞凋亡,而Ki67表达上调可促进细胞增殖[14,15]。本研究结果显示缺氧处理后心肌细胞中Caspase3蛋白水平显著升高,Ki67蛋白水平显著降低,而干扰NPHP3-AS1表达后心肌细胞中Caspase3蛋白水平显著降低,Ki67蛋白水平显著升高,进一步证实干扰NPHP3-AS1表达可通过调控细胞增殖及凋亡相关蛋白表达而影响缺氧诱导的心肌细胞周期及细胞凋亡。
为进一步探究NPHP3-AS1在缺氧诱导的心肌细胞损伤中的作用机制,本研究通过双荧光素酶与qRT-PCR实验证实NPHP3-AS1可靶向结合miR-30a-5p,还可负向调控miR-30a-5p的表达,研究表明ADAR1通过ADAR1-miR-30a-SOCS3轴而减轻小鼠败血症模型中的炎症反应[16]。抑制LINC00707可通过调控miR-30a-5p/ Neurod 1而减轻脂多糖诱导的PC-12细胞炎症及细胞凋亡[17]。miR-30b-5p表达异常还可在儿童急性肺损伤、非小细胞肺癌等疾病中发挥重要调控作用[18,19]。由此猜测NPHP3-AS1可能通过调控miR-30a-5p的表达从而影响缺氧诱导的心肌细胞增殖及凋亡。为验证上述猜测,本研究将si-NPHP3-AS1与antimiR-30a-5p共转染至心肌细胞,结果显示干扰miR-30a-5p能逆转干扰NPHP3-AS1对缺氧诱导的心肌细胞增殖凋亡的作用,提示干扰NPHP3-AS1表达可通过上调miR-30a-5p的表达从而抑制缺氧诱导的心肌细胞凋亡及促进细胞增殖。
综上所述,干扰NPHP3-AS1表达可促进缺氧诱导的心肌细胞增殖及抑制细胞凋亡,其作用机制可能与靶向调控miR-30a-5p的表达有关,可为急性心肌梗死等心血管疾病的治疗提供新方向。
