刚性氢化诺卜基双子季铵盐的合成与抗菌作用
2020-12-31冯雪贞肖转泉范国荣秦金梦王宗德
冯雪贞, 肖转泉, 范国荣, 秦金梦, 王宗德*
(1.江西农业大学 林学院,国家林草局木本香料(华东)工程技术研究中心,国家林草局/江西省樟树工程技术研究中心,江西 南昌 330045; 2.江西师范大学 化学化工学院,江西 南昌 330027)
真菌病害是植物病害中数量最大的一类,约占植物病害总数的70%~80%[1]。植物病原真菌不仅危害植物正常生长,给农林牧生产造成重大损失,还会分泌对人畜有害的毒素和代谢物,严重威胁人和动物的生命健康[2]。因此,安全高效地抑制植物病原真菌的活性已成为防治植物病害的关键[3-4]。化学抗真菌药物能有效地抑制植物病原真菌的生长,然而,长期使用同一种抗真菌药物往往会使植物病原真菌产生抗药性[5-6]。不断开发新的抗真菌药物仍是当前防治病原真菌的迫切需求,也一直是农药研究的热点。β-蒎烯是由松节油分离出的一种绿色可再生化合物,具有抗菌活性[7-9],通过化学修饰可以合成大量的β-蒎烯衍生物,其中一些衍生物已被证实具有较好的抗真菌活性[10-12]。Gao等[13]合成了40个萜烯基酰基硫脲衍生物,并测试其对3种植物病原真菌的抑制活性,结果表明:桃金娘烯基酰基硫脲对黄瓜枯萎病菌(EC50=0.412 mg/L)的抗真菌活性高于多菌灵(EC50=0.436 mg/L)。由此可见,β-蒎烯是开发植物源农药的良好前体化合物,以β-蒎烯为原料合成的一系列氢化诺卜基季铵盐对多种植物病原真菌具有良好的抗真菌活性[14-15]。因此本研究介绍了以β-蒎烯为原料合成的6种新型含刚性碳氢链联结基的氢化诺卜基双子季铵盐,并采用菌丝生长速率法测定了它们对8种植物病原真菌的抑菌效果,可为开发新型高效植物源抑真菌药物提供参考。
1 实 验
1.1 试剂、仪器及菌种
N,N-二甲基氢化诺卜基胺、N,N-二乙基氢化诺卜基胺、N,N-二正丙基氢化诺卜基胺,参照文献[16]制备;1,4-二溴化苄、 1,4-二氯化苄、石油醚(60%~90%)、石油醚(30%~60%)均为市售分析纯试剂;百菌清为标准品,HPLC纯度≥98%;马铃薯葡萄糖琼脂(PDA)培养基来自北京奥博星生物技术有限责任公司。
Nicolet IR 6700红外光谱仪(美国赛默飞世尔科技有限公司);AmaZon SL质谱仪(德国Bruker Daltonics公司);AVANCE400 型核磁共振仪(瑞士Bruker公司);44X-6T显微熔点测定仪(上海光学仪器六厂);LDZX-50KBS立式压力蒸汽灭菌锅(上海申安医疗器械厂);SW-CJ-ID型无菌超净工作台(苏州净化设备有限公司);GHP-250型智能培养箱(上海三发科学仪器有限公司)。
水稻纹枯病菌菌(Rhizocyoniasolani)、油茶炭疽病菌(Colletotrichumgloeosporioides)、枇杷炭疽病菌(Colletotrichumacutatum)、松枯梢病菌(Sphaeropsissapinea)、七叶树壳梭孢菌(Fusicoccumaesculi)、彩绒革盖菌(Coriolusversicolor)、烟草黑胫病菌(Phytophthoraparasiticavar.nicotianae)和西瓜枯萎病菌(Fusariumoxysporum),8种植物病原真菌菌种均由国家林草局木本香料(华东)工程技术研究中心提供。
1.2 氢化诺卜基双子季铵盐的合成
1.2.1合成路线 含氢化诺卜基的叔胺化合物和1,4-二溴化苄或1,4-二氯化苄在弱极性溶剂中加热回流条件下反应,制得6种新型含刚性碳氢链联结基的氢化诺卜基双子季铵盐,分别为二苄基-1,4-双(氢化诺卜基二甲基溴化铵)(3a)、二苄基-1,4-双(氢化诺卜基二乙基溴化铵)(3b)、二苄基-1,4-双(氢化诺卜基二正丙基溴化铵)(3c)、二苄基-1,4-双(氢化诺卜基二甲基氯化铵)(3d)、二苄基-1,4-双(氢化诺卜基二乙基氯化铵)(3e)、二苄基-1,4-双(氢化诺卜基二正丙基氯化铵)(3f)。合成路线见图1:
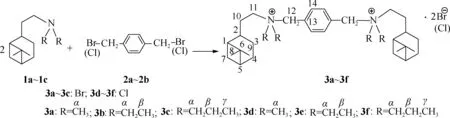
图1 刚性氢化诺卜基双子季铵盐的合成路线
1.2.2合成方法 分别取0.06 moL含氢化诺卜基的叔胺化合物,0.03 moL 1,4-二溴化苄或1,4-二氯化苄,35~40 mL 乙酸乙酯置于150 mL磨口锥形瓶中,于磁力加热搅拌器上搅拌并加热回流,24 h后停止反应,冷却,吸滤,得滤饼,用乙酸乙酯淋洗3次,洗出液与滤出母液合并,滤液合并后经旋转蒸发去除大部分溶剂后,可再得到部分结晶物,此结晶物与前面的滤饼合并后真空干燥。
1.3 抑菌活性测试
采用菌丝生长速率法[17]测定新化合物对8种植物病原真菌的抑制作用。以无任何化合物的PDA培养基平板作为空白对照组,以98%百菌清为阳性对照。将新化合物用无菌水配制成质量浓度2 000 mg/L的溶液,通过二倍稀释法将溶液配成1 000、 500、 250和125 mg/L等梯度浓度。将其与灭菌过的PDA培养基以体积比1 ∶9 混合,得到化合物质量浓度为200、 100、 50、 25、 12.5、 6.25、 3.13和1.56 mg/L的含药培养基,将含药培养基倒入培养皿中,得到含药液的平板,每种菌重复3个培养皿。接种后置于25 ℃恒温培养箱中培养数天,待空白对照组平板的菌落直径生长到整个培养皿的三分之二左右,用十字交叉法测量菌落直径,根据菌落直径求菌丝生长抑制率,公式如下:
校正直径=菌落平均直径-菌饼直径
菌丝生长抑制率=(对照组校正直径-处理组校正直径)/对照组校正直径×100%
利用DPS 7.0建立毒力回归方程,以化合物质量浓度的对数值为横坐标(x),抑制率经软件转换得到的机率值为纵坐标(y),毒力回归方程为:y=a+bx,当y=50%时,求出其抑菌的半数有效质量浓度(EC50)。
2 结果与讨论
2.1 双子季铵盐的表征
二苄基-1,4-双(氢化诺卜基二甲基溴化铵)(3a):白色粉末状固体,得率84%, m.p.239.3~241.4 ℃。IR(νmax,cm-1):2937,2902,2864(C—H),1468(CH2),1384,1368(C(CH3)2),1224(C—N);1H NMR(CDCl3)δ:7.83(4H,s,Ar-H),5.29(4H,s,12-CH2),3.61(4H,m,11-CH2),3.23(12H,s,α-CH3),2.35(2H,m,2-CH),2.10~1.82(16H,m,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.35(2H,m,3-CH),1.20(6H,s,9-CH3),1.04(6H,s,8-CH3),0.88(2H,d,J=9.6Hz,7-CH);13C NMR(CDCl3)δ:38.60(C-1),46.19(C-2),22.21(C-3),26.11(C- 4),41.10(C-5),38.64(C- 6),30.25(C-7),23.40(C-8),27.99(C-9),33.41(C-10),58.50(C-11),61.23(C-12),129.97(C-13),134.20(C-14),49.17(C-α);MS(C34H58N2Br2):573.4,575.4[M+-Br];733.5,735.5[M++Br]。
二苄基-1,4-双(氢化诺卜基二乙基溴化铵)(3b):白色粉末状固体,得率78%,m.p.256.5~258.1 ℃。IR(νmax,cm-1):2981,2939,2908,2866(C—H),1468(CH2),1384,1368(C(CH3)2),1222(C—N);1H NMR(CDCl3)δ:7.69(4H,s,Ar-H),5.05(4H,s,12-CH2),3.51(8H,m,α-CH2),3.33(4H,m,11-CH2),2.36(2H,m,2-CH),2.05~1.82(16H,m,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.50(14H,t,J=6.0Hz,β-CH3,3-CH),1.20(6H,s,9-CH3),1.03(6H,s,8-CH3),0.90(2H,d,J=8 Hz,7-CH);13C NMR(CDCl3)δ:38.79(C-1),45.93(C-2),22.33(C-3),26.18(C- 4),41.08(C-5),38.64(C- 6),29.78(C-7),23.43(C-8),28.04(C-9),33.48(C-10),57.09(C-11),61.25(C-12),129.89(C-13),138.70(C-14),54.05(C-α),8.93(C-β);MS(C38H66N2Br2):629.5,631.5[M+-Br],789.5,791.5[M++Br]。
二苄基-1,4-双(氢化诺卜基二正丙基溴化铵)(3c):白色粉末状固体,得率75%,m.p.194.4~196.2 ℃。IR(νmax,cm-1):2967,2937,2909,2879(C—H),1470(CH2),1383,1366(C(CH3)2),1222(C—N);1H NMR(CDCl3)δ:7.71(4H,s,Ar-H),5.20(4H,s,12-CH2),4.40(4H,m,11-CH2),3.23(8H,m,α-CH2), 2.35(2H,m,2-CH),2.09~1.76(24H,m,β-CH2,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.45(2H,m,3-CH),1.20(6H,s,9-CH3),1.02(6H,s,8-CH3),0.99(12H,t,J=5.6Hz,γ-CH3),0.87(2H,d,J=8Hz,7-CH);13C NMR(CDCl3)δ:38.68(C-1),45.80(C-2),22.27(C-3),26.15(C- 4),41.05(C-5),38.60(C-6),29.85(C-7),23.31(C-8),28.02(C-9),33.42(C-10),58.23(C-11),62.54(C-12),130.17(C-13),133.64(C-14),60.64(C-α),16.53(C-β),10.88(C-γ);MS(C42H74N2Br2):685.6,687.6[M+-Br],845.6,847.6[M++Br]。
二苄基-1,4-双(氢化诺卜基二甲基氯化铵)(3d):白色粉末状固体,得率84%,m.p.286.8~289.1 ℃。IR(νmax,cm-1):2983,2939,2907,2866(C—H),1469(CH2),1383,1367(C(CH3)2),1223(C—N);1H NMR(CDCl3)δ:7.58(4H,m,Ar-H),4.47(4H,s,12-CH2),3.13(4H,t,J=7.6Hz,11-CH2),2.98(12H,s,α-CH3),2.23(2H,m,2-CH),1.89~1.72(16H,m,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.37(2H,m,3-CH),1.08(6H,s,9-CH3),0.78(d,J=9.2Hz,7-CH);13C NMR(CDCl3)δ:38.32(C-1),45.56(C-2),21.51(C-3),25.89(C- 4),41.04(C-5),38.12(C- 6),29.54(C-7),22.64(C-8),27.61(C-9),32.96(C-10),62.97(C-11),66.51(C-12),129.88(C-13),133.45(C-14),50.36(C-α);MS(C34H58N2Cl2):529.4,531.4[M+-Cl],599.5,601.5[M++Cl]。
二苄基-1,4-双(氢化诺卜基二乙基氯化铵)(3e):白色粉末状固体,得率79%,m.p.226.2~228.4 ℃。IR(νmax,cm-1):2980,2938,2909,2866(C—H),1469 (CH2),1385,1367(C(CH3)2),1220(C—N);1H NMR(CDCl3)δ:7.60(4H,s,Ar-H),4.95(4H,s,12-CH2),3.34(8H,m,α-CH2),3.29(4H,m,11-CH2),2.28(2H,m,2-CH),1.95~1.77(16H,m,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.41(14H,t,J=6.8 Hz,β-CH3,3-CH),1.12(6H,s,9-CH3),0.96(6H,s,8-CH3),0.81(2H,d,J=10 Hz,7-CH);13C NMR(CDCl3)δ:38.75(C-1),45.91(C-2),22.27(C-3),26.13(C- 4),41.02(C-5),38.57 (C- 6),29.64(C-7),23.36(C-8),28.00(C-9),33.44(C-10),56.87(C-11),61.07(C-12),129.96(C-13),133.63(C-14),53.86(C-α),8.73(C-β);MS(C38H66N2Cl2):585.5,587.5[M+-Cl],657.5,659.5[M++Cl]。
二苄基-1,4-双(氢化诺卜基二正丙基氯化铵)(3f):白色粉末状固体,得率73%,m.p.177~179.4 ℃。IR(νmax,cm-1):2968,2938,2919,2874(C—H),1461(CH2),1383,1367(C(CH3)2),1222(C—N);1H NMR(CDCl3)δ:7.63(4H,s,Ar-H),5.11(4H,s,12-CH2),3.29(4H,m,11-CH2),3.15(8H,m,α-CH2),2.27(2H,m,2-CH),1.94-1.70(24H,m,β-CH2,7-CH,10-CH2,5-CH,1-CH,4-CH2,3-CH),1.36(2H,m,3-CH),1.11(6H,s,9-CH3),0.94(6H,s,8-CH3),0.91(12H,t,J=6.4Hz,γ-CH3),0.79(2H,d,J=8.8Hz,7-CH);13C NMR(CDCl3)δ:38.57(C-1),45.83(C-2),22.23(C-3),26.11(C- 4),41.02(C-5),38.66(C-6),29.72(C-7),23.28(C-8),27.99(C-9),33.41(C-10),58.02(C-11),62.39 (C-12),130.31(C-13),133.63(C-14),60.47(C-α),16.34(C-β),10.80(C-γ);MS(C42H74N2Cl2):641.5,643.5[M+-Cl],711.5,713.5[M++Cl]。
2.2 双子季铵盐的抑菌活性
6种含刚性碳氢链联结基的氢化诺卜基双子季铵盐对8种植物病原真菌的抑菌活性见表1。
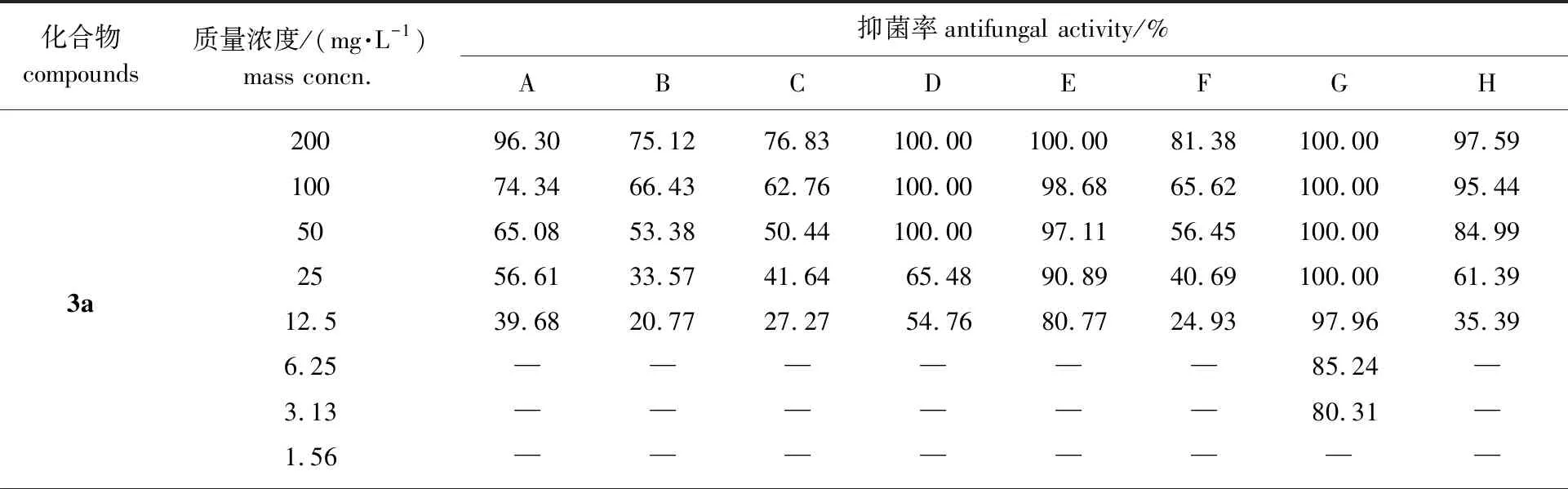
表1 双子季铵盐对8种植物病原真菌的抑菌活性1)
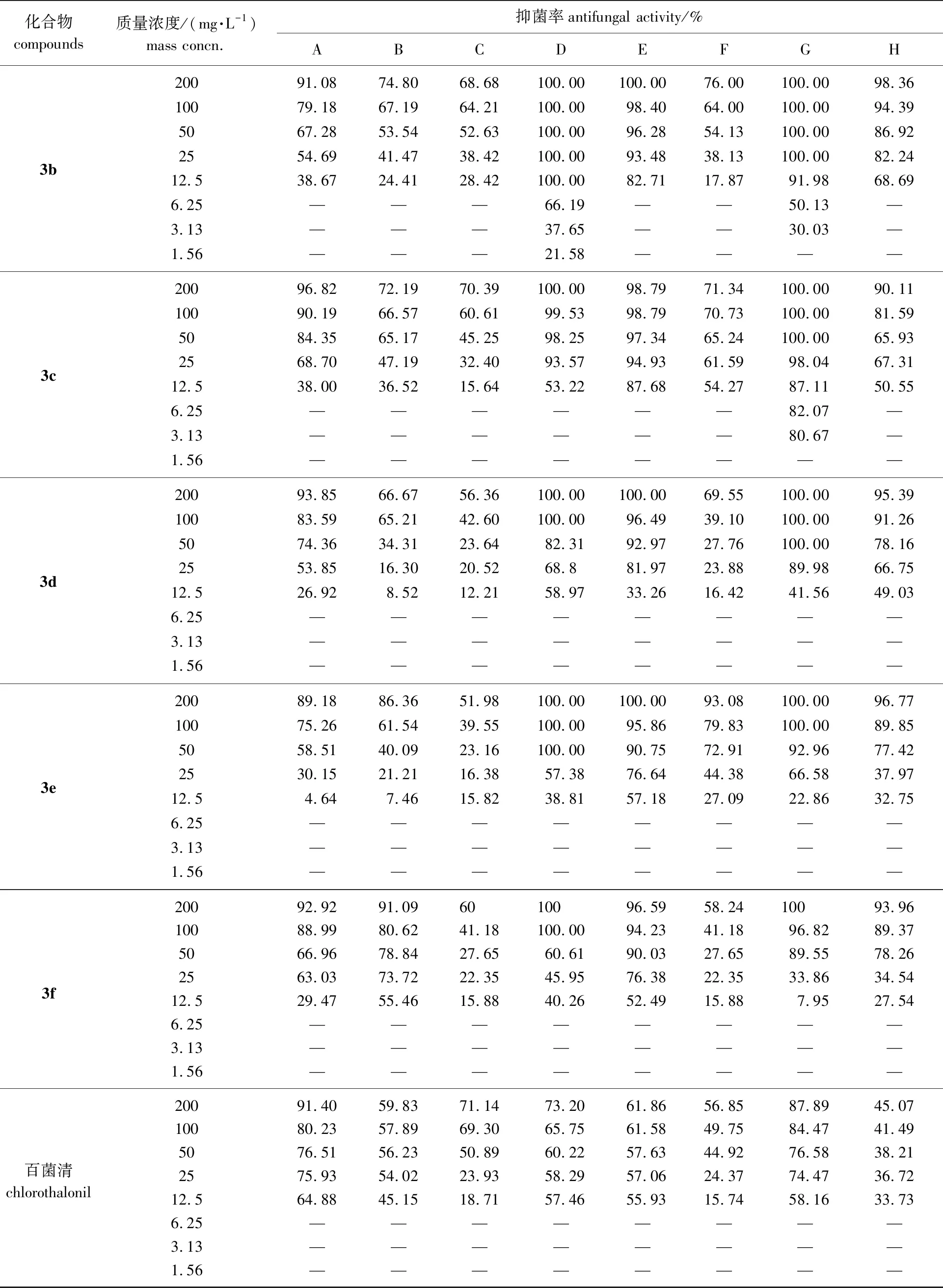
续表1
由表1可知,6个化合物对松枯梢病菌的抑制率很高,在药液质量浓度大于等于100 mg/L时,3a、3b、3d、3e和3f对其的抑制率均为100%。在药液质量浓度大于50 mg/L时,3a、3b、3c和3d对烟草黑胫病菌的抑制率也都达100%。由抑菌率计算得到毒力回归方程及EC50值见表2。
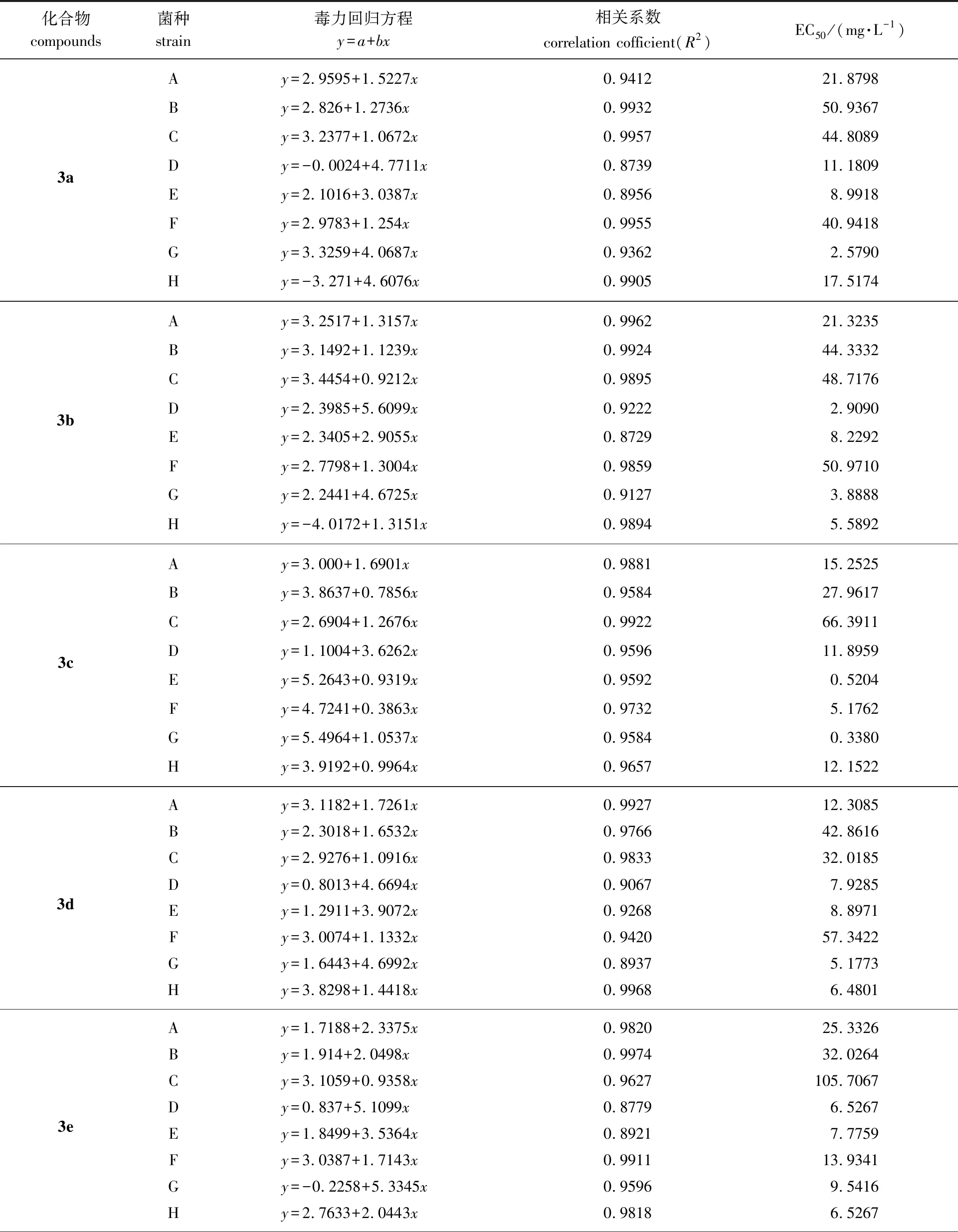
表2 双子季铵盐对8种植物病原真菌的毒力回归方程及EC50
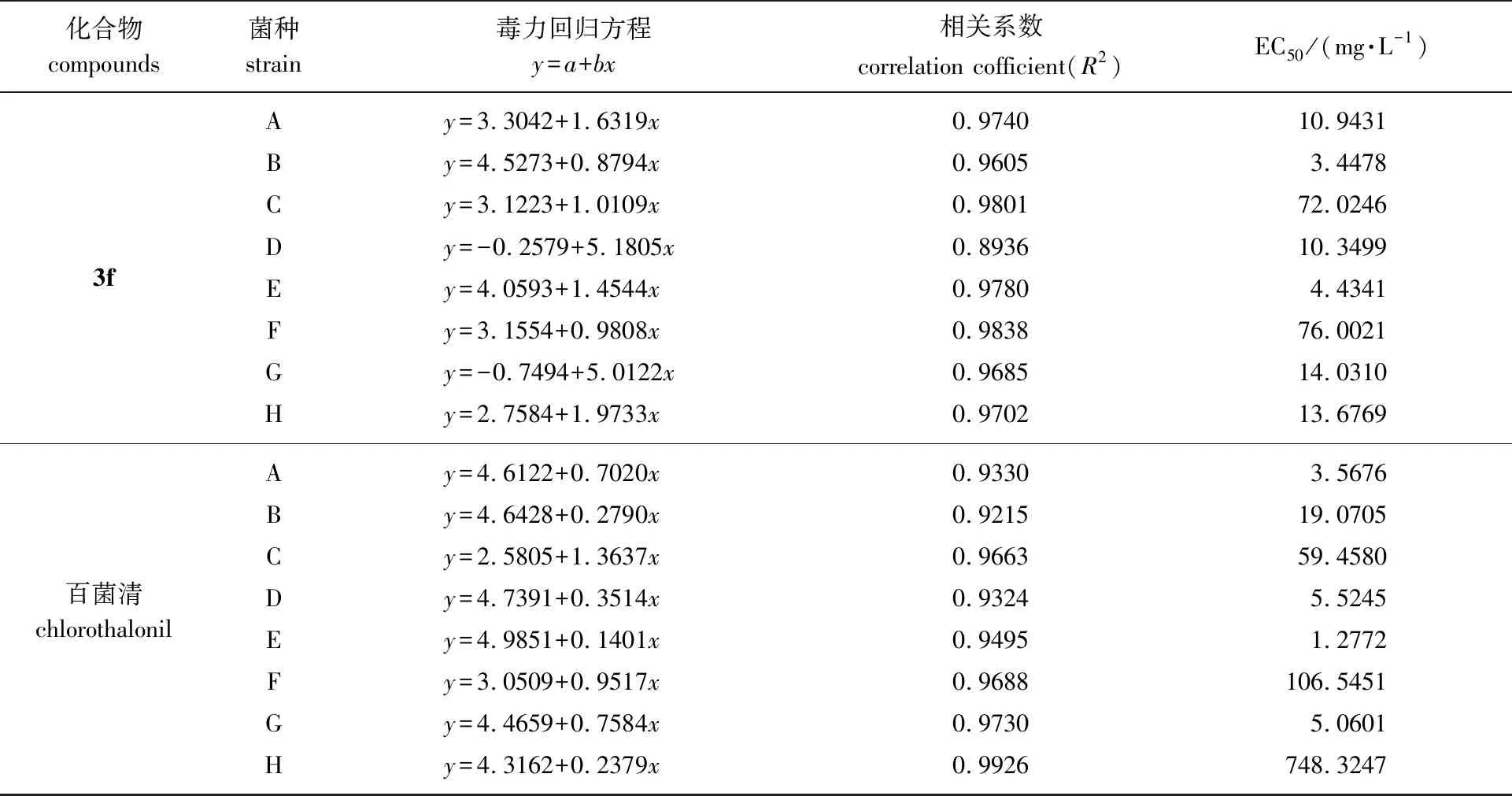
续表2
从表2所列的数据可以看出:6种新化合物对于七叶树壳梭孢菌有良好的抑制效果,其EC50值都低于10 mg/L,并且对彩绒革盖菌和西瓜枯萎病菌的EC50值都低于百菌清对其的EC50值,其中对西瓜枯萎病菌的EC50值都低于20 mg/L,抑菌效果明显优于百菌清(748.324 7 mg/L);N+上连接正丙基的化合物3c和3f有较广谱的抑制效果,对水稻纹枯病菌、松枯梢病菌、七叶树壳梭孢菌、烟草黑胫病菌和西瓜枯萎病菌的EC50值都低于20 mg/L;含溴离子的3个化合物对烟草黑胫病菌有较明显的抑制效果,3a、3b和3c的EC50值分别为2.579、 3.888 8和0.338 mg/L,均小于百菌清的EC50值(5.060 1 mg/L);大部分化合物所建立的毒力回归方程的相关系数均能达到0.9以上,相关性较好;当都含有溴离子时,N+上连接正丙基的化合物对水稻纹枯病菌、油茶炭疽病菌、松枯梢病菌和七叶树壳梭孢菌的抑制效果大于连接乙基的化合物大于连接甲基的化合物(3c>3b>3a);6个化合物中,化合物3c对七叶树壳梭孢菌、彩绒革盖菌和烟草黑胫病菌的抑制效果最好,其EC50值最小,分别为0.520 4、 5.176 2和0.338 mg/L。化合物3b对松枯梢病菌和西瓜枯萎病菌的抑制效果最好,其EC50值最小,分别为2.909和5.589 2 mg/L。化合物3f对水稻纹枯病菌和油茶炭疽病菌均有良好的抑菌活性,EC50值分别达到10.943 1和3.447 8 mg/L。化合物3d对枇杷炭疽病菌有较好的抑菌活性,EC50值为32.018 5 mg/L。
3 结 论
3.1由含氢化诺卜基的叔胺化合物与1,4-二溴(氯)化苄反应制得了二苄基-1,4-双(氢化诺卜基二甲基溴化铵)、二苄基-1,4-双(氢化诺卜基二乙基溴化铵)、二苄基-1,4-双(氢化诺卜基二正丙基溴化铵)、二苄基-1,4-双(氢化诺卜基二甲基氯化铵)、二苄基-1,4-双(氢化诺卜基二乙基氯化铵)和二苄基-1,4-双(氢化诺卜基二正丙基氯化铵)。通过FT-IR、MS和NMR确认了合成的化合物为目标产物。
3.2合成的6个新化合物对上述植物病原真菌皆有一定的抑制作用,建立的毒力回归方程相关系数基本均达0.9以上,相关性较好,对七叶树壳梭孢菌EC50值都低于10 mg/L,并且对彩绒革盖菌和西瓜枯萎病菌的EC50值都低于百菌清对其的EC50值。含溴离子的3个新化合物对烟草黑胫病菌有较明显的抑制效果,对水稻纹枯病菌、油茶炭疽病菌、松枯梢病菌和七叶树壳梭孢菌的抑制效果随着连接基团的相对分子质量的增加而增强。N+上连接正丙基的化合物3c和3f有较广谱的抑制效果,对5种供试植物病原菌的EC50值都低于20 mg/L。
