金枪鱼暗色肉酶解优势肽鉴定及其体外抗氧化和血管紧张素转换酶抑制活性分析
2020-12-31张迪雅苏秀榕
王 锐,张迪雅,李 晔*,苏秀榕
(1.宁波大学海洋学院,浙江 宁波 315211;2.宁波大学食品与药学学院,浙江 宁波 315211)
金枪鱼又称鲔鱼、吞拿鱼,是对硬骨鱼纲(Osteichthyes)、鲈形目(Pereiformes)、鲭科(Scombridae)鱼类中具有胸甲的几个属鱼类的总称[1],金枪鱼肉质鲜美、蛋白含量高、脂肪和热量低,并含有丰富的二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)和多种必需氨基酸。研究表明,DHA和EPA具有改善记忆力、降低血脂和胆固醇等多种保健功效[2]。金枪鱼在加工过程中会产生大量副产物,如暗色肉、鱼皮等,其中含有丰富的蛋白质和生物活性物质,但副产物大多被加工成饲料鱼粉,利用率较低且造成环境污染。金枪鱼暗色肉整体呈红褐色并分布在体侧线附近[3],粗蛋白作为其主要构成占鱼体质量的21%~22%,粗脂肪含量经检测约为普通肉的3 倍,富含多种不饱和脂肪酸,其中EPA和DHA含量占总脂的17%~20%,并且含有丰富的Ca、Fe、Zn等矿物质元素[4]。但由于暗色肉肉质粗糙、腥味浓郁、难以加工和储存[5],因而一直被制成罐装宠物食品[6]或被低值化加工成生产饲料。因此对此类副产物进行深入的开发利用,生产高附加值的产品具有重要意义。
蛋白酶水解技术是常用的制备生物活性肽的方法。因其反应条件温和,不易造成氨基酸变性,具有较高的回收率和高效的反应速率,对环境污染较小,较酸法与碱法提取更为安全,被广泛用于功能性产品的开发[7]。孙婷婷等[8]对金枪鱼胰脏进行酶解,所得多肽对患有db/db糖尿病小鼠的血清胰岛素、糖化血红蛋白、血脂水平等具有明显改善作用。刘建华等[9]通过胰蛋白酶酶解金枪鱼暗色肉,发现其酶解液氨基酸组成丰富,可用作食品的营养补充剂。胡旭阳等[10]以日本黄姑鱼鱼肉为原料,通过木瓜蛋白酶制备出具有生理活性的免疫活性肽。
本研究以金枪鱼暗色肉为原料,通过胰蛋白酶和碱性蛋白酶双酶酶解制备富含活性多肽分子的酶解液,并利用基质辅助激光解吸电离飞行时间串联质谱仪(matrix-assisted laser desorption/ionization time-of-flight tandem mass spectrometry,MALDI-TOF MS/MS)测定酶解液中多肽分子质量,分析优势肽序列。进一步采用Discover Studio软件通过分子对接技术对酶解优势肽功能进行预测,并通过体外活性实验对多肽分子的抗氧化和降血压活性进行验证。以期为金枪鱼暗色肉高值利用提供理论参考和研究方向。
1 材料与方法
1.1 材料与试剂
新鲜的金枪鱼暗色肉取自宁波今日食品有限公司,取回实验室后,4 ℃冰箱暂存,备用。
胰蛋白酶(4×103U/g)、碱性蛋白酶(2×105U/g)广西南宁庞博生物工程有限公司;总氨基酸检测试剂盒 南京建成生物工程研究所;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furylacryloyl)]-L-phenyalanyl-glycylglycine,FAPGG)、血管紧张素转换酶(angiotensinconverting enzyme,ACE)、2-[4-(羟乙基)-1-哌嗪基]乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES) 美国Sigma-Aldrich公司;谷胱甘肽(glutathione,GSH)、卡托普利北京索莱宝科技有限公司。
1.2 仪器与设备
5800 MALDI-TOF MS/MS仪 美国AB SCIEX公司;数显恒温水浴锅HH-8 常州国华电器有限公司。
1.3 方法
1.3.1 金枪鱼暗色肉酶解工艺优化
参考Wang Xiaonan等[11]的方法并略作调整,新鲜暗色肉从冰箱中取出,蒸馏水洗净,清除杂物后,按一定固液比加入蒸馏水于组织匀浆机中,搅碎制成匀浆,调节温度和pH值,加酶置于摇床水解。使用水解度作为评判指标,初始提取条件为鱼肉组织与蒸馏水固液比为1∶4、酶解温度45 ℃、酶解时间3 h、按底物质量3%的加酶量加入对应蛋白酶,在此基础上通过单因素试验对酶质量比、固液比、加酶量、酶解温度和酶解时间进行参数优化。
单因素水平:胰蛋白酶与碱性蛋白酶的质量比:1∶1、1∶2、2∶1、1∶3、3∶1、2∶3、3∶2;固液比:1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7;加酶量:1%、2%、3%、4%、5%、6%、7%;酶解温度:35、40、45、50、55、60、65 ℃;酶解时间:1、2、3、4、5、6、7 h。
进一步根据Box-Behnken原理设计,以水解度作为响应值,加酶量、酶解温度和酶解时间作为自变量,设计三因素三水平的响应面分析试验[9,12]。
水解度计算如公式(1)所示。

1.3.2 酶解多肽的制备
利用优化后的酶解条件对暗色肉进行酶解,酶解结束后,90 ℃、10 min灭酶。酶解液于8 000 r/min离心20 min,取上清液,冻存备用[13]。多肽固相合成由上海生工生物工程有限公司完成。
1.3.3 酶解多肽序列分析
酶解液高速离心,取上清液40 μL,加水稀释40 倍,吸取1 μL于5800 MALDI-TOF MS/MS仪靶版上点样,待干后,再加入1 μLα-氰基-4-羟基肉桂酸基质,待干后进样。采用MALDI-TOF MS/MS对酶解液进行序列分析。分别通过一级和二级质谱先后确定多肽分子质量和氨基酸序列。收集分析得到的样品质谱图,通过MASCOT软件与谱库对照后,确认多肽的一级结构[14]。
1.3.4 酶解多肽分子的功能筛选和分子对接
1.3.4.1 功能筛选
以1.3.2节所取得蛋白酶酶解液中的主导多肽作为分子对接中的配体,通过Discover Studio 2018软件中的Build and Edit Protein模块,输入多肽氨基酸序列以获得初步预测的多肽3D结构,再通过Minimize Ligands模块中的Full Minimization功能对其能量进行最优化,使获得的多肽3D结构同时具有最低能量。进一步用Pharma DB数据库进行反向找靶[15],运行Pharmacophore模块中的Ligand Profiler工具筛选可与配体相互作用的靶标蛋白,预测多肽功能。
1.3.4.2 分子对接
在PDB数据库中检索并下载筛选靶标蛋白的三维结构,利用Discover Studio 2018软件的Prepare Protein模块处理蛋白,对其进行去水、加氢和优化蛋白质结构。在Tools Explorer模块中的Define Receptor功能将处理好的蛋白分子设定为受体,利用CDocker工具对配体和受体进行分子对接[16]。
1.3.5 酶解多肽的体外活性分析
1.3.5.1 DPPH自由基清除率的测定
取0.1 mL待测样品与等体积0.1 mmol/L DPPH-甲醇溶液混合摇匀,常温避光静置30 min,于517 nm波长处测定其吸光度,记作A1;同时测定0.1 mL待测样品和等体积甲醇混合液的吸光度,记作A2;将0.1 mL 0.1 mmol/L DPPH溶液加入等体积蒸馏水所测得的吸光度,记作A3。以蒸馏水调零校准,选择GSH作为阳性对照[17]。每组各设有3 个平行实验,DPPH自由基清除率参照公式(2)计算。计算DPPH自由基清除率达50%时待测样品浓度,称为半抑制浓度(half maximal inhibitory concentration,IC50),表示清除50%自由基活性所需多肽分子的有效浓度。
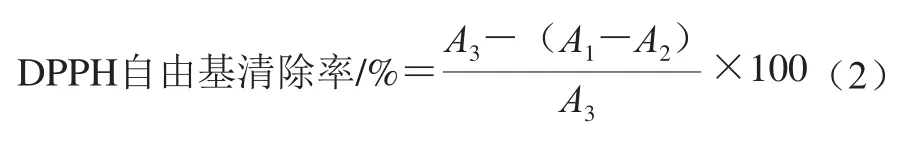
1.3.5.2 ACE抑制率的测定
以FAPGG溶液作为底物用于测定ACE抑制活性。取10 μL的ACE(0.1 U/mL)与4 倍体积的待测样品混匀后,再加入50 μL的1 mmol/L FAPGG溶液(由pH 8.3、80 mmol/L HEPES缓冲液配制)。在37 ℃下记录30 min内340 nm波长处吸光度的变化量,记作A0。空白对照将样品溶液替换为HEPES缓冲液,相同条件下记录于340 nm波长处吸光度的变化量,记作A1。阳性对照选用卡托普利[18]。每组各设有3 个平行实验,抑制率参照公式(3)计算。计算ACE抑制率达50%时样品浓度IC50,表示抑制50% ACE活性所需的样品浓度。

1.4 数据统计分析
通过SPSS 19.0软件进行单因素方差分析,并对最小显著差异进行两两比较,P<0.05表示差异显著。同时使用GraphPad Prism 5.0软件通过非线性回归曲线拟合计算IC50。实验结果均以±s表示。
2 结果与分析
2.1 单因素试验结果

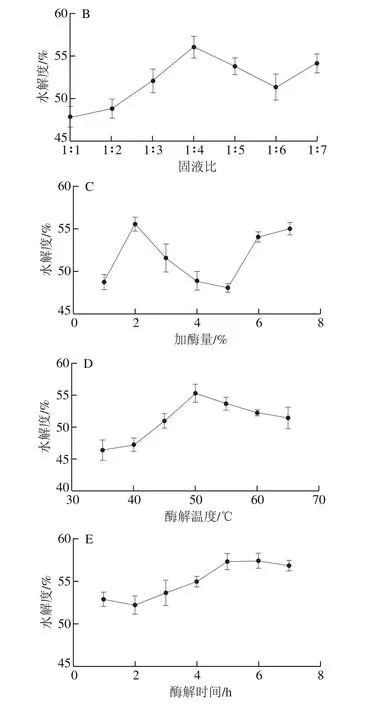
图1 优化双酶水解条件的单因素试验结果Fig.1 Effects of various variables on the degree of hydrolysis
利用胰蛋白酶和碱性蛋白酶对金枪鱼暗色肉进行酶解,以水解度为指标,通过单因素试验分别优化酶质量比、固液比、加酶量、酶解温度和酶解时间。结果如图1所示,水解度随着固液比、加酶量、酶解温度的增加以及酶解时间的延长总体呈现先上升后下降的趋势,确定最佳酶解条件为:酶质量比1∶1、固液比1∶4、加酶量2%、酶解温度50 ℃、酶解时间5 h。
2.2 响应面试验结果
在单因素试验优化基础上,根据Box-Behnken设计确定暗色肉酶解条件:A酶解温度(45、50 ℃和55 ℃)、B加酶量(1%、2%和3%)、C酶解时间(4、5 h和6 h),响应面试验设计和结果见表1。利用Design Expert V8.0.6软件进行多元回归拟合,得到双酶酶解时各变量的回归方程:Y=59.05+1.20A-0.30B+0.11C-0.022AB-0.082AC+0.085BC-4.83A2-0.85B2-1.91C2。
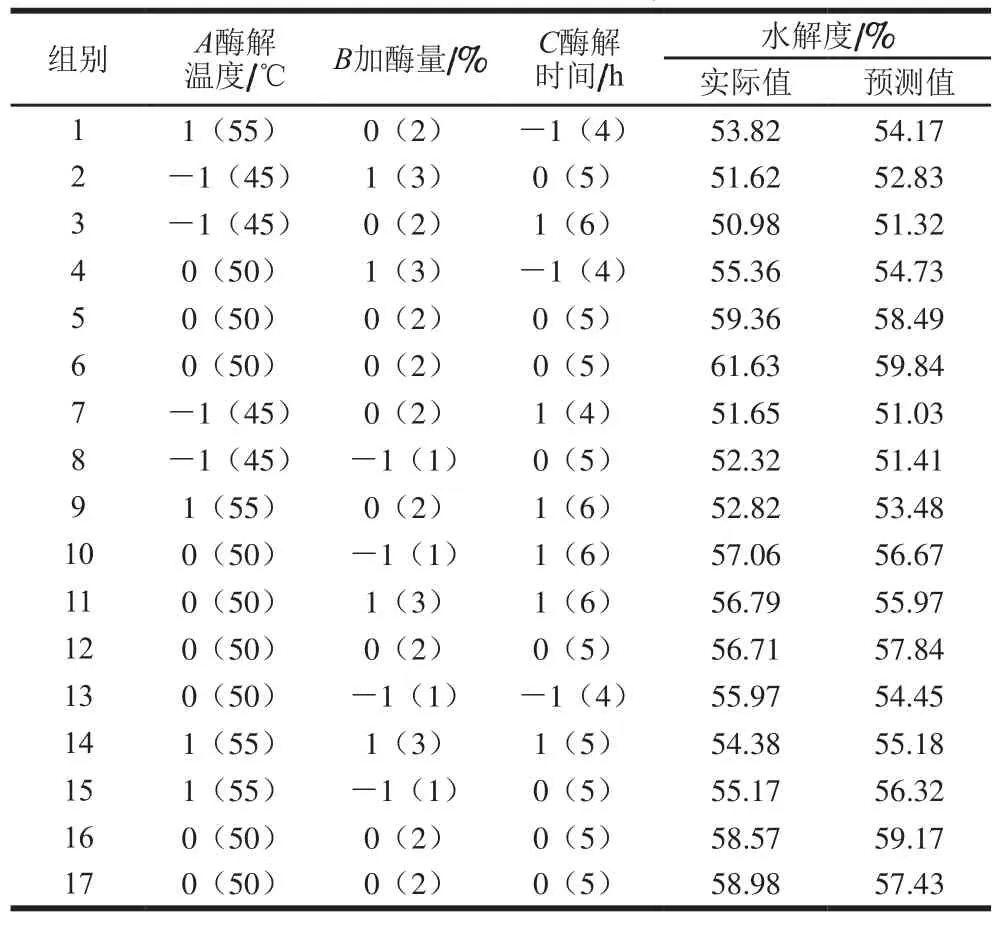
表1 金枪鱼暗色肉双酶酶解条件响应面试验设计与结果Table 1 Box-Behnken design with experimental and predicted values for response surface analysis

表2 金枪鱼暗色肉双酶酶解条件响应面优化回归方程分析结果Table 2 Analysis of variance of quadratic polynomial regression equation
由表2可知,金枪鱼暗色肉双酶水解的回归模型极显著(P<0.01),且回归方程的失拟项不显著(P>0.05),这表明酶解时间、酶解温度、加酶量对金枪鱼暗色肉水解的影响显著程度较高,并能与水解度同时进行高水平的拟合。此外,该模型的决定系数(R2)为0.991 8,调整决定系数(R2Adj)为0.986 5,都接近于1.0,表明该回归方程能对金枪鱼暗色肉双酶水解工艺结果进行很好的预测。由此可知,三因素水平设计合理、方法可靠、操作稳定,该模型可用作分析数据。如图2所示,3 个因素与水解度呈抛物线关系,等高线呈椭圆状,表明各因素对金枪鱼暗色肉水解度的影响呈非简单的线性关系。回归模型各项的方差分析结果还表明二次项A2对双酶水解度影响高度显著,二次项C2对双酶水解度影响显著,其他因素则影响不显著。

图2 金枪鱼暗色肉双酶酶解条件优化的响应面三维图Fig.2 Response surface plots for the effects of the cross-interaction among factors on the degree of hydrolysis
随着各因素水平增加,在一定范围内,水解度呈不同程度的增加,当达到最高值时则又会呈现下降趋势。响应面中最大响应值和各因素的变化程度均符合上述回归方程。综合响应面数学分析,确定最佳酶解条件为:酶解温度51 ℃、加酶量2%、酶解时间5 h,水解度理论预测值为59.15%。采用上述优化酶解条件测得实际金枪鱼暗色肉水解度为61.01%。实验值与理论预测值具有较好的拟合性,表明此次响应面优化参数方案可应用于实践中。
2.3 金枪鱼暗色肉酶解多肽序列的分析结果
采用MALDI-TOF MS/MS对酶解液进行多肽分子质量测定,图3为一级质谱(MS)和二级质谱(MS/MS)处理的结果。MALDI-TOF MS/MS检测出2 个相对较强的质谱峰,双酶酶解多肽中母离子m/z401.087 5的信号强度最高,m/z420.089 8信号强度次之,其余母离子信号强度偏低。故而,选择其作为母离子进行二级质谱分析,所得结果进行谱库对比,得到2 个优势肽,分别为EPR(Glu-Pro-Arg)和VSSK(Val-Ser-Lys)。


图3 金枪鱼暗色肉双酶酶解多肽的质谱图Fig.3 Mass spectra of peptides from tuna dark muscle hydrolysate
2.4 酶解多肽(VSSK和EPR)的分子对接结果
利用Pharma DB模块进行反向找靶,VSSK和EPR这2 种优势肽对21 种靶标蛋白具有潜在的相互作用,如Antigen peptide transporter 1、Beta-secretase 1、Protein SCAF8、Interleukin-2、Replicase polyprotein 1ab等。其中,Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)与ACE为VSSK与EPR所共有的能够发生交互作用的靶标蛋白,并进一步利用CDocker模块对多肽与靶标蛋白进行分子对接。
2.4.1 VSSK、EPR多肽分子与Keap1的分子对接结果
CDocker分子对接主要根据配体与受体相互作用的能量(-CDocker interaction energy,-EC)和相互作用的氨基酸位点等信息来确定结合的程度。其中-Ec亦反映配体和受体之间亲和力的强弱。Keap1与各多肽的分子对接结果见表3和图4。由表3可知,VSSK(63.361 9 kJ/mol)显示出比EPR(59.209 3 kJ/mol)同Keap1具有更高的亲和力。由图4A可知,VSSK参与同Keap1中的5 个氨基酸残基相互作用,并与His129、Lys131、Lys150和Cys151共形成4 个氢键;图4B表明EPR与Keap1中7 个氨基酸残基相互作用,其中与Gln86和Cys151形成2 个氢键。

表3 多肽分子与Keap1蛋白的分子对接结果Table 3 Results of molecule docking between peptides and Keap1

图4 多肽分子与Keap1蛋白的相互作用Fig.4 Schematic of interaction between peptides and Keap1
2.4.2 VSSK、EPR多肽分子与ACE的分子对接结果
酶解多肽与ACE的分子对接结果见表4和图5。如表4所示,VSSK(75.173 4 kJ/mol)相较EPR(60.105 4 kJ/mol),与ACE的亲和力更为紧密。如图5A所示,可知配体小分子VSSK同ACE中的5 个氨基酸残基相互作用,其中与Ala356、Asp358和Ser355形成3 个氢键;如图5B所示,可知配体小分子EPR与ACE中的5 个氨基酸相互作用,分别与Asn66与Ala356共形成2 个氢键。由此可知,多肽VSSK和EPR通过与ACE蛋白相互作用形成氢键等作用方式,从而抑制ACE活性。此外,VSSK的对接能量-EC较EPR更大,表明其对ACE活性抑制发挥更强的作用,推测其具有更好的降压活性。

表4 多肽分子与ACE蛋白的分子对接结果Table 4 Results of molecule docking between peptides and ACE

图5 多肽分子与ACE蛋白的相互作用Fig.5 Schematic of interaction between peptides and ACE
2.5 酶解液与合成多肽的体外活性比较结果
2.5.1 DPPH自由基清除活性
金枪鱼暗色肉酶解液对DPPH自由基的清除率见图6。当质量浓度在0~0.5 mg/mL变化时,DPPH自由基清除率变化幅度最大。比较酶解液与合成多肽的抗氧化活性,随着其质量浓度的增加,抗氧化活性也相对上升。阳性对照GSH的IC50为0.045 mg/mL,双酶酶解液的IC50为0.204 mg/mL,合成多肽的抗氧化活性相近,IC50分别为VSSK 3.050 mg/mL、EPR 3.368 mg/mL。与酶解液相比,合成多肽抗氧化活性相对较弱,在达到相近的DPPH自由基清除率前提下,需要更高的底物浓度。
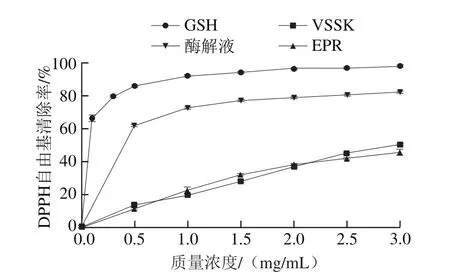
图6 酶解液与合成多肽的DPPH自由基清除活性Fig.6 DPPH radical scavenging activities of hydrolysate of tuna dark muscle and synthesized peptides
2.5.2 ACE抑制活性
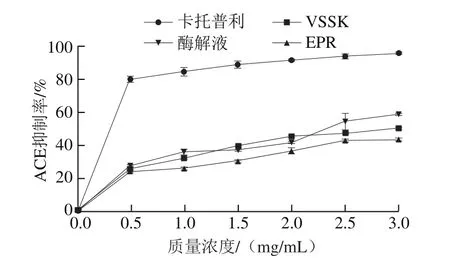
图7 酶解液与合成多肽的ACE抑制活性Fig.7 ACE inhibitory activities of hydrolysis of tuna dark muscle and synthesized peptides
酶解液与合成多肽的ACE抑制活性见图7。结果发现,阳性对照卡托普利的质量浓度从0增加到0.5 mg/mL时,抑制率迅速上升至80%。此后,随着质量浓度增加,抑制率上升缓慢,其IC50为0.094 mg/mL。酶解液(IC50为2.321 mg/mL)与合成多肽的ACE抑制率曲线相似。当质量浓度从0升高到0.5 mg/mL时,抑制率上升至27.89%,之后随质量浓度增加,抑制率缓慢提高;当质量浓度达到2.0 mg/mL时,合成多肽VSSK的抑制率达45.25%,酶解液抑制率次之,为41.84%;当质量浓度达到3.0 mg/mL时,酶解液抑制率达到最大(58.59%),合成多肽VSSK和EPR的抑制率分别为50.18%和43.51%。VSSK的IC50为2.914 mg/mL,而EPR的IC50为4.857 mg/mL。上述结果表明,酶解液的抗氧化活性和ACE抑制率均优于合成多肽。
3 讨 论
暗色肉在金枪鱼加工过程中,因腥味重、肉质粗糙往往被剔除,但其富含蛋白质和不饱和脂肪酸等多种营养物质,如谷物蛋白中易缺乏的赖氨酸、丰富的DHA和EPA等。为减少生产废料,提高产品附加值水平,实现对暗色肉高值化开发,利用蛋白酶酶解法制备具有一定生理功效的活性肽是目前采用的有效途径。Han Jiaojiao等[19]通过优化胰蛋白酶和碱性蛋白酶酶解金枪鱼暗色肉条件,最终确定两酶质量比控制在2∶1、固液比为1∶9、加酶量为3%、温度为55 ℃,在该条件下酶解4 h,所得水解度为60.7%。张朋等[20]利用碱性蛋白酶酶解金枪鱼碎肉蛋白制备降压肽,以ACE抑制率为指标,确定最佳酶解条件为:pH 9.5、酶用量1.5%、酶解温度50 ℃、酶解时间5 h。近期研究表明,蛋白质水解多肽的生理活性取决于多肽的氨基酸序列和分子质量的大小[21],分子质量在0.5~3 kDa范围内的多肽往往具有更好的活性[22]。Samaranayaka等[23]研究发现小分子质量的多肽可更有效地抑制脂质过氧化。Chi Changfeng等[24]研究发现分子质量较小的多肽(389.41、546.63 Da和432.52 Da)具备更好的抗氧化活性。研究表明,ACE抑制活性同肽的序列和分子质量的大小关系密切,具有ACE抑制活性的肽分子质量大小多集中于1 500 Da以下[25]。这可能是由于分子质量小,人体更容易吸收,故表现出更好的活性。本实验利用胰蛋白酶和碱性蛋白酶进行双酶解,优化后的酶解条件为:酶质量比1∶1、固液比1∶4、加酶量2%、温度51 ℃和酶解时间5 h,最终获得61.01%的水解度。对酶解液采用MALDI-TOF MS/MS进行测序发现,多肽分子质量多集中于1 kDa以下,谱库对比后确定酶解液中主导多肽为EPR和VSSK,分子质量分别为401.087 5 Da和420.089 8 Da。
Discover Studio是一款分子模拟对接软件,能够通过分子对接的方法对作用机理进行分析,广泛应用于小分子配体与生物大分子间相互作用的表征、同源建模、分子动力学模拟等领域[26]。Wu Qiongying等[27]对蚕蛹蛋白水解物进行分离纯化,得到ACE抑制肽Ala-Ser-Leu,并通过Discover Studio软件对其抑制活性的机理进行了分析。郑春松等[28]以补肾壮筋汤的药物成分为研究对象,通过Discover Studio软件进行分子对接,从而寻找补肾壮筋汤有效成分的作用靶标。本实验利用Discover Studio软件对酶解液中的优势肽进行反向找靶,通过分子对接的方法对作用机理进行分析,对优势肽进行针对性的功能预测[29]。筛选出VSSK和EPR的潜在靶标蛋白Keap1和ACE。
在生理条件下,Keap1是一种能够抑制Nrf2活性,主要存在于细胞质中的多区域阻遏蛋白[30]。通常Nrf2与其抑制剂Keap1相结合,以非活性状态存在于细胞质中,一旦细胞受到活性氧刺激,Nrf2与Keap1则发生解耦联,活化的Nrf2转运进入细胞核,激活靶基因表达,调控II相代谢酶、抗氧化酶或药物转运体的转录活性,从而发挥抗氧化损伤的作用[31]。ACE属于锌结合蛋白酶家族,在被锌和氯化物活化后,可通过肾素血管紧张素系统和激肽释放酶-激肽系统对血压进行调节并发挥关键作用[32]。
已有研究表明多肽的氨基酸组成与抗氧化活性有关,如疏水性氨基酸Val、Phe、Met、Pro、Tyr等[33-35]。含疏水性氨基酸的多肽通过与氧结合或抑制脂质中氢离子释放的方式,达到氧化抑制作用[36]。推测VSSK中含有的疏水氨基酸Val和EPR中含有的疏水氨基酸Val、Pro可能是赋予多肽抗氧化活性的重要原因。此外,氢键对分子间相互作用至关重要[37],已有研究表明氢键作用是构成多肽和ACE相互作用的主要方式,通过肽分子与蛋白残基相结合形成的氢键来促进肽诱导的ACE活性抑制[38]。Fu Yu等[39]研究发现NMAINPSK与ACE形成的氨基酸残基中含有Ala356,且由氢键形成,从而预测酶解多肽与ACE结合后,可抑制ACE活性,起到降血压的功效。分子对接结果显示,VSSK与ACE形成3 个氢键,而EPR与ACE形成2 个氢键,同时根据对接能量-Ec分析结果可知多肽分子与Keap1或ACE的亲和力皆为VSSK大于EPR,故推测VSSK可能发挥更好的抗氧化活性与降压活性。
此外,本研究结果表明,无论是DPPH清除活性还是ACE抑制活性,酶解液均优于合成多肽,能以更低的底物浓度达到更佳的清除和抑制活性效果,当组合化合物的等效浓度低于单独作用的化合物时,可认为组合间发挥了协同作用[40]。杜昕等[41]研究发现由牦牛血发酵液菌酶联合制备所得的产物较抗氧化肽拥有更好的抗氧化活性,更多的有效基团通过协同作用成为电子供体用以清除自由基,从而保护脂质不被氧化。本研究所得酶解液为混合物,推测可能是因为含有多种抗氧化活性的多肽分子发挥了协同作用。
4 结 论
本实验采用胰蛋白酶和碱性蛋白酶对金枪鱼暗色肉进行双酶酶解,以提取生物活性肽,利用响应面法优化得到最佳酶解条件为:酶质量比1∶1、固液比1∶4、酶解温度51 ℃、加酶量2%、酶解时间5 h,在此条件下测得金枪鱼暗色肉水解度为61.01%,较单酶酶解更高。通过MALDI-TOF MS/MS对酶解液进行氨基酸序列测定,得到EPR、VSSK这2 个优势肽,利用Discover Studio软件中Pharma DB模块筛选出优势肽的靶标蛋白Keap1和ACE。通过分子对接,预测其具有良好的抗氧化活性和降血压能力。体外实验表明,酶解液较合成多肽具有更好的抗氧化活性和ACE抑制活性,推测与其中活性多肽的协同作用有关。本实验结果为金枪鱼暗色肉商业化利用与开发提供了研究方向。
