家兔输尿管机械损伤后狭窄模型的建立与分析
2020-12-31王子国张洪明薛少军陆克义刘院刚刘祥辰隋婧婧刘焕茹李险峰
王子国 张洪明 薛少军 陆克义 刘院刚 刘祥辰 隋婧婧 刘焕茹 李险峰△
(1 山西医科大学,第一临床医学院,2 第一医院放疗科,3 第一医院核医学科,太原 030001; 4 邯郸市第一医院普外科,邯郸 056002)
医源性输尿管损伤后狭窄是泌尿外科常见疾病之一。随着微创外科学的蓬勃发展,伴随而来的医源性输尿管损伤发病率明显增加[1]。国内外报道医源性输尿管损伤概率达60%~94%[2-3],输尿管损伤后约30%可发展成为输尿管狭窄[4],输尿管狭窄一旦出现多需手术干预,重复的器械操作加重输尿管损伤[5]。近年来输尿管狭窄的治疗取得较大的进展,而构建理想的动物模型是临床前研究的基础,因此,模拟医源性输尿管损伤后狭窄的动物模型的成功构建显得尤为重要。常用造模方法有单侧输尿管完全梗阻法、电凝损伤输尿管法等[6-12],这些造模方法无法观察输尿管损伤后的病理改变及输尿管逐渐狭窄引起肾盂积水、肾衰的全过程。另外,对操作的精准性要求高且输尿管管径小的动物不适用。因此,建立一种操作简单、成功率高且能模拟输尿管狭窄发生发展的造模方法是目前研究迫切所需的。本实验对家兔左侧输尿管机械性损伤,研究输尿管损伤后病理学改变、细胞因子表达,证明机械性损伤输尿管后狭窄模型能够为临床前研究提供实验基础。
1 材料和方法
1.1 实验动物及模型制作
所有实验均按照山西医科大学动物研究委员会的指导原则和实验动物保护原则进行。所有动物均为成年雄性家兔20只,月龄6月,体质量2.5 ~ 3 kg(由山西医科大学动物实验中心提供)。术前静养15 d 让动物充分适应环境。实验前动物禁食12 h,禁水4 h,术前半小时肌肉注射头孢西丁 13.3 mg/kg预防感染,1%戊巴比妥钠 30 mg/kg 肌注麻醉,备皮、消毒、铺洞巾,从耻骨联合沿腹中线做3 ~4 cm长切口,打开腹腔,辨认输尿管,并在髂血管分叉处找到输尿管,用玻璃分针分离输尿管,游离出一段长约1.5 cm 输尿管,用1 mL注射器针头插入输尿管管腔,钢尺测量1 cm后将 1 mL注射器针头穿出管腔,沿针头挑起输尿管长轴,纵行切开1 cm,见尿液流出,用6-0 Prolene线桥接缝合,待输尿管切口下方无菌纱布干燥无尿液漏出后回纳输尿管,并在输尿管损伤处对应腰大肌包埋铅点,关闭腹腔。所有手术均由同一位外科医生实施,目的是保证所有动物输尿管损伤的长度和深度一致。
1.2 主要试剂和设备
复方泛影葡胺注射液购自湖南汉森制药股份有限公司,核素显像剂DTPA 药盒购自中国原子能科学研究院,Masson 染色试剂盒购自Phygene 公司,Smooth Muscle Actin-Specific Antibody(α-SMA)、抗兔/鼠HRP 标记聚合物试剂、兔抗人Ⅰ型胶原(COL1A2)、Ⅲ型胶原(COL3A1)、转化生长因子-β1(TGF-β1)抗体均购于武汉三鹰生物有限公 司(Proteintech Group, Inc)。Trizol 试 剂、TB Green® Premix Ex Taq™ (Tli RNase H Plus)试剂盒、反转录试剂盒购自日本TaKaRa。BCA 蛋白质购自碧云天生物有限公司。免疫印迹成像应用奥德赛(Odyssey)红外激光成像系统,PCR 仪使用美国Applied Biosystem。静脉肾盂造影采用日本岛津株式会社的Sonialvision Safire 7 进行拍摄。核素肾动态显像选用可变角双探头单光子发射计算机断层成像设备(型号:NET632,北京永新医疗设备有限公司)。
1.3 静脉肾盂造影方法
分别在造模前和造模完成后7、21、49 d 行静脉肾盂造影检查,1%戊巴比妥钠 30 mg/kg,肌注麻醉,采用76%泛影普胺注射液1 mL/kg,静脉推注,推注时间不超过2 min,于2 min、15 min、30 min 拍摄双肾、输尿管及膀胱影像。将肾盂积水程度分级,即轻度、中度及重度。由中级职称影像医师阅片和比较。
1.4 核素肾动态显像检查
在造模前和造模完成后7、21、49 d 行核素肾动态显像检查,动物麻醉后,动物取俯卧位,拍照视野包括双肾、输尿管和膀胱,耳缘静脉“弹丸”注射99mTc-DTPA 74×107Bq(3mCi)后即启动计算机采集,矩阵64×64,每2 s 1 帧,采集30 帧为血流灌注相,随后每60 s 1 帧,采集20 帧,为肾功能相,利用计算机软件,通过勾画感兴趣区技术处理图像。
1.5 病理组织染色
取左肾石蜡包块,行2 μm 切片,行H-E 染色。取正常输尿管及损伤愈合区输尿管行2 μm 切片进行Masson 染色:常规脱蜡后蒸馏水清洗,核染液渲染2 min,1%盐酸乙醇分化1 s,浆染液染色 6 min,分色液分色1 ~3 min,复染液染色5 min脱水透明封片。
1.6 免疫组织化学显色
将石蜡切片脱蜡至水,抗原修复结束后在修复液中自然冷却。然后用TBS 冲洗滴一抗稀释液稀释一抗,室温孵育1 h。。滴加二抗,37℃孵育30 min。DAB 显色后蒸馏水洗终止。苏木精复染 3 min。1%盐酸酒精分化1 s,氨水分化1 s。各级乙醇脱水,每级5 min。取出后置于二甲苯10 min,2 次,用封片。
1.7 RT-PCR
液氮研磨法将组织研磨成粉状后,用TRIzol试剂提取总RNA,接着应用反转录试剂盒,将2 μg RNA反转成cDNA。实时定量PCR 使用TB Green Premix Ex Taq 试剂盒,所用引物如表1 所示,反应体系为25.5 μL(上游引物0.5 μL,下游引物0.5 μL,cDNA 1.0 μL,Rox 参比染料0.5 μL,双链嵌合荧光染色试剂TB Green 12.5 μL,去离子水10.5 μL)。条件:95℃预变性10 min;95℃,15 s,60℃,1 min,40 个循环。以对照组中的GAPDH为内参照,采用2-△△Ct法计算各组相对表达量。

表1 引物序列Table 1 Primer sequences

图1 模型兔在术前(A)、术后7 d(B)、21 d(C)、49 d(D)静脉肾盂造影图片。虚线箭头为损伤侧肾盂位置,实线箭头为未损伤侧肾盂位置,黑点(铅点)为手术损伤输尿管狭窄位置。B、C 分别为术后7、21 d,中度肾盂积水(肾小盏扁平成球状或囊状)。D 为术后49 d,重度肾盂积水(肾盂肾盏连成一体).Fig 1 Intravenous pyelograms of rabbit model during the 7th day, 21st day, and 49th day after surgery and before surgery(A). The dotted arrow indicated the location of the renal pelvis on the injured side, the solid arrow indicated the location of the renal pelvis on the non-injured side, and the black dot (lead point) indicated the location of the surgically injured ureteral stricture. B and C were pictures on the 7th day and 21st day after surgery, respectively, with moderate hydronephrosis (renal calyx flattened into a ball or sac). D was a picture on the 49th day after surgery, with severe hydronephrosis (the renal pelvis and calyces are integrated into one).
1.8 免疫印迹检测
将组织从液氮中取出,研钵充分研磨后,加入适量含蛋白酶抑制剂Cocktail 的RIPA 裂解液,使用超声波破碎仪进一步充分裂解。离心机14 000 r/min 离心15 min,取上清液。BCA 蛋白质测定法测定蛋白质浓度。计算上样体积加入上样缓冲液后,100℃水浴锅中煮5 min。10% SDS-PAGE 凝胶电泳分离蛋白后,转膜,接着5%脱脂奶粉室温封闭2 h,孵育一抗4℃过夜。次日TBST 洗膜后,荧光二抗避光孵育2 h。按成像要求步骤曝光。使用Image J软件,分析目的条带和内参GAPDH 条带的灰度值,计算蛋白的相对表达量。
1.9 统计学处理
所有数据采用SPSS 22.0 统计分析软件处理,所有数值均表示为±s。通过单因素方差分析或独立样本t检验比较各组间差异。应用非参数检验对非正态分布数据进行分析。P<0.05 被认为有统计学意义。
2 结果
手术后2 只模型兔在术后8 d 因腹泻死亡。剩余模型兔在术后49 d 没有明显的异常反应。
2.1 家兔肾输尿管形态学
模型兔在术前行静脉肾盂造影显示双侧输尿管通畅,肾盂正常,在术后7 d 首次行静脉肾盂造影时除1 个动物模型输尿管不显影以外,其余动物模型输尿管显影均可。术后7、21、49 d 损伤侧肾盂积水随着时间的延长逐渐加重,输尿管损伤处以下不显影,损伤处以上输尿管迂曲、扩张,直至实验49 d 结束时肾盂出现重度积水(图2)。损伤侧肾盂积水在术后7、21、49 d 不断加重,中位数分级评分分别为1、2 和3(P<0.01)(图2)。

图2 术前和术后7、21、49 d 肾盂积水程度比较Fig 2 Degree of hydronephrosis, pre-operation vs post-operation on the 7th, 21st and 49th day of hydronephrosis
2.2 家兔肾功能学
模型兔随着时间延长,左侧肾仅见皮质显影,肾小球滤过率(GFR)、肾摄取率(Ut)逐渐降低,达峰时间(Tp)、半排时间(T1/2)逐渐延长。损伤侧肾GFR、Ut 术后7、21、49 d 逐步降低(P<0.01)(图3 A,表2);损伤侧肾Tp、T1/2 时间术后7、21、49 d 逐渐延长(P<0.01)(图3B,表2)。
2.3 H-E 染色
肾积水是输尿管狭窄后的典型表现,会使肾功能恶化。在输尿管机械性损伤后49 d,将模型兔处死并收集左侧肾。标本形态显示重度肾积水(图4 A1-A2,见封二)。H-E 染色显示:大量胶原沉积,肾小球萎缩和肾小管扩张,并且发现肾小球血管和肾间质纤维化(图4 B1-B2,见封二),而未损伤肾则无改变。
2.4 Masson 染色与α-SMA 免疫组织化学显色
模型兔输尿管愈合重塑区α-SAM 呈高表达;Masson 染色示该区域为蓝色,存在胶原纤维沉积,重塑区有黏膜上皮再生(图4 C1-C8,见封二)。
2.5 RT-PCR、免疫印迹测定
通过实时PCR 测定纤维化标记基因Ⅰ型胶原、Ⅲ胶原、转化生长因子-β1 的表达水平,并用Western-bloting 进行验证。结果显示:动物模型左侧输尿管重塑区域Ⅰ型、Ⅲ胶原、TGF-β1 表达量较右侧正常输尿管表达明显升高(P<0.01,图5)。

图3 家兔核素肾动态显像数据分析Fig 3 Data analysis of radionuclide imaging in rabbits
表2 核素肾动态显像在各时间段肾参数 (n=18, ±s)Tab 2 Renal parameters of radionuclide renal dynamic imaging at various time periods(n=18, ±s)

表2 核素肾动态显像在各时间段肾参数 (n=18, ±s)Tab 2 Renal parameters of radionuclide renal dynamic imaging at various time periods(n=18, ±s)
**P<0.0001;△P>0.05. GFR:glomerular filtration rate;Ut:divided renal uptake rate;Tp:Peak time;T1/2:half-time
Item Pre-operation 7 d 21 d 49 d GFR(ml/min/1.73m2 ) 40.77±6.89 25.62±9.65**△ 20.34±7.28** 12.72±3.24**Ut(%) 4.48±0.75 2.89±1.00**△ 2.46±1.09** 1.45±0.37**Tp(min) 3.94±1.55 15.99±4.38**△ 16.88±2.68** 20.33±2.11**T1/2(min) 0.88±0.41 8.56±4.13**△ 12.56±4.99** 17.19±4.09**
3 讨论
3.1 输尿管机械性损伤后狭窄模型建立的必要性及其优势
输尿管狭窄多为医源性所致[13],随着微创外科的发展,造成输尿管损伤后狭窄发病率逐年升高,且治疗效果差。因此,对输尿管损伤后狭窄机制的研究具有重要的临床意义,而建立成功的输尿管狭窄模型是其研究的基础。
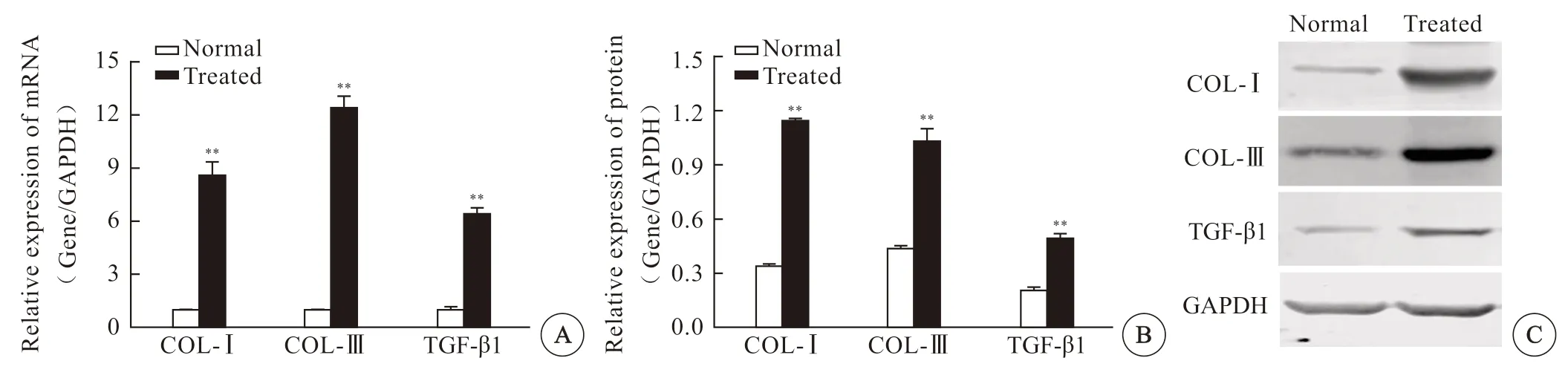
图 5 家兔输尿管损伤愈合处与正常输尿管TGF-β1, Ⅰ、Ⅲ胶原的mRNA、蛋白表达Fig 5 Expression of TGF-β1, Ⅰ and Ⅲ collagen of mRNA and protein in rabbit ureteral injury healing site and normal ureteral
输尿管狭窄动物模型的建立有多种方法[6-12],如单侧输尿管完全梗阻法、腰大肌掩埋法、套管法、不全结扎法、电凝损伤法等。这些方法虽然造模过程简单,但模型建立后输尿管再通具有不可逆性,且在临床中,无法再开展扩张术、内切开术、支架置入术等治疗进行再通。同时,这些模型不能观察到输尿管损伤后病理及分子生物学改变及输尿管逐渐狭窄致肾盂积水、肾衰的全过程,与临床中输尿管狭窄的发生发展过程差异较大。而电凝损伤输尿管模型,虽能模拟输尿管损伤后的病理改变,但对操作的精准性要求高,且造模难达到一致性,容易引起输尿管漏,对输尿管管径小的动物不适用,且操作设备昂贵,本实验根据Bartone[14]和Leppäniemi[15]前期研究的造模方法加以改进,尚能弥补以上造模的不足,且成本低。并在损伤输尿管处所对应腰大肌上缝置包埋铅点,标记损伤区域,为后期影像学检查提供参考,还可为体外照射提供定位。
3.2 家兔在输尿管机械性损伤后狭窄疾病演变过程
输尿管完全梗阻后肾功能进行性下降,56 d 时肾功能几乎完全丧失[16],本研究静脉肾盂造影发现模型兔在输尿管损伤后7 d 时显影通畅,狭窄部位以上的输尿管迂曲、管腔扩张,并随着时间延长输尿管狭窄段以下不显影,肾盂积水逐渐加重,提示输尿管狭窄处可能有瘢痕组织增生;核素肾动态显像结果显示模型兔随着时间的延长左肾仅见皮质显影, 左肾GFR、Ut 逐渐减低,而Tp 时间、T1/2时间逐渐延长,提示输尿管狭窄后继发了肾单位滤过和排空功能的下降,证明造模是成功的;在该实验术后49 d 取模型兔输尿管损伤侧肾行病理学研究发现该侧肾组织萎缩、皮质变薄、肾锥体消失,镜下观察肾叶间纤维化,大量胶原沉积,肾小球萎缩和肾小管扩张。
研究证实损伤后输尿管愈合区被过度增殖的成纤维细胞及沉积的胶原纤维所代替[17-19],后期肌成纤维细胞分化、胶原纤维的过度合成致细胞外基质成分改变,引起输尿管愈合区瘢痕挛缩,导致输尿管狭窄[20]。此外,输尿管完全愈合至少需要 42 d[21]。本研究在造模后49 d 行病理组织学检查,发现输尿管管腔已完全愈合,愈合区完全被输尿管黏膜上皮覆盖。
3.3 机械性输尿管损伤后狭窄兔模型病理及生理过程分析
TGF-β1 可促进成纤维细胞和其他类型细胞转化为肌成纤维细胞[22],并具备强收缩性,此时α-SMA 表达阳性。而肌成纤维细胞可产生Ⅰ型和Ⅲ型胶原蛋白和其他基质分子[23],是引起输尿管愈合区瘢痕挛缩及纤维化的关键物质。我们对输尿管损伤后重塑区进行TGF-β1、α-SMA、Ⅰ型和Ⅲ型胶原分析,发现损伤侧呈高表达,结合Masson、α-SMA 免疫组化染色,说明输尿管损伤后狭窄是成纤维细胞后期分化成肌成纤维细胞及其表达胶原纤维造成的。
输尿管损伤后重塑区域主要为成纤维细胞、肌成纤维细胞的增殖和胶原蛋白的产生形成的瘢痕组织,并导致细胞间电信号的传导和蠕动波的形成受阻,平滑肌肌束稀疏菲薄及细胞外基质微环境改变损害区域神经组织[24],从而影响蠕动波的传递使肾盂积水逐渐加重。后期研究可以尝试通过减少其成纤维细胞、肌成纤维细胞生成或阻断胶原蛋白的产生,从而改善输尿管狭窄以及产生的肾功能损害提供理论依据。
3.4 不足之处
该实验的不足之处是未设置假手术组,但该实验术前已行肾功能学及形态学检测,本实验主要是采取自身前后对照进行数据分析。总之,我们研究表明机械性损伤输尿管后狭窄造模更好的模拟输尿管损伤后狭窄发病的全过程,该方法操作简单、成本低、成功率高,且能模拟输尿管狭窄疾病发生发展的动态全过程等优点,能为输尿管狭窄的实验研究提供良好的研究模型。
图版说明(见封二)
图4 A2 为 A1 肾剖开图片,损伤侧整个肾呈一个囊状,而对侧正常(黄色箭头是输尿管损伤后狭窄区域); B1 为未损伤侧肾,B2 为损伤侧肾,可见肾髓质小管及肾小囊扩张,肾小球萎缩(B1-B2:20 倍镜.);C1-C2 和C3-C4 为正常侧输尿管Masson、α-SMA 免疫组织化学显色;C5-C6 为损伤侧输尿管Masson 染色, 愈合区域被胶原纤维代替染成蓝色(红色箭头); C7-C8 为C5-C6 相对应区域的α-SMA 免疫组织化学染色,α-SMA 在愈合区域呈阳性表达。C1、3、5、7:4 倍镜,标尺=250 μm,C2、4、6、8:10 倍镜,标尺=100 μm.
Explanation of figures(see inside front cover)
Fig 4 A1 was a picture of a kidney dissection, A2 was a cystic kidney on the injured side, and the contralateral side was normal (the yellow arrow was the stenotic area after ureteral injury); B1 was the uninjured side kidney, B2 was the injured side kidney, and the renal marrow expansion of tubules and renal capsules, glomerular atrophy (B1-B2: 20 times magnification); C1-C2 and C3-C4 were normal side ureter Masson and α-SMA immunohistochemical staining. C5-C6 was the injured side Masson staining of the ureter, the healing area was replaced by collagen fibers and stained blue (red arrow), C7-C8 was the α-SMA immunohistochemical staining of the corresponding area of C5-C6, and α-SMA was positively expressed in the healing area. C1, 3, 5, 7: 4×,bar=250 μm; C2, 4, 6, 8: 10×,bar=100 μm.
