食源性大肠杆菌flic基因的克隆与分析
2020-12-31张总超林元清傅义娟李秀英炊文婷应兰张燕阚威
张总超,林元清,傅义娟,李秀英,炊文婷,应兰,张燕,阚威
食源性大肠杆菌flic基因的克隆与分析
张总超,林元清*,傅义娟,李秀英,炊文婷,应兰,张燕,阚威
(青海省动物疫病预防控制中心,青海 西宁 810000)
为了分析食源性大肠杆菌flic基因的遗传变异特点,利用生物性软件设计大肠杆菌flic基因特异性引物,采用PCR技术扩增flic基因,扩增产物纯化后测定核苷酸序列,通过生物软件分析测定的序列结果表明,所测大肠杆菌分离株flic基因的核苷酸序列与参考大肠杆菌H511菌株、E49菌株的flic基因分别存在1个和22个核苷酸的差异,核苷酸序列同源性分别为99.9 %、98.4 %。
大肠杆菌;flic基因;PCR;序列分析
肠埃希氏菌(Escherichia coli)通常称大肠杆菌,是一类革兰氏阴性短杆菌。大肠杆菌广泛分布于自然界及人与动物消化道内,有致病性和非致病性之分,非致病性大肠杆菌是肠道正常菌群,对人体及畜禽不造成危害,而致病性大肠杆菌则能引起食物中毒,甚至能引起人及动物的死亡,因此,对人类的健康和生命存在着潜在的威胁。致病性大肠杆菌为临床感染中最常见的病原之一,其血清型复杂,仅国内报道就有80余种之多[1]。根据不同的生物学特性将致病性大肠杆菌分为5类:致病性大肠杆菌(EPEC)、肠产毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)、肠出血性大肠杆菌(EHEC)、肠黏附性大肠杆菌(EAEC)[2]。不同的大肠杆菌菌株生活在不同动物中,通过突变,新的大肠杆菌菌株不断出现,其中一些可能对宿主动物造成损害。尽管对于大多数健康成年人,这样的经过突变的菌株可能只引起一场腹泻症状,或者根本没有症状,但对于幼儿、大病初愈的人或者进行某些药物治疗的人,陌生的菌株可能引起严重疾病甚至死亡。食源性疾病的全球发病率很难估计,据报道,仅2000年全球有210万人死于腹泻,其中大部分病例与食用受污染的食物和水有关。发达国家,每年患食源性疾病的人数高达30 %[3],而在这样一个比例中,食物中的致病性大肠杆菌占着很大一部分比例。
大肠杆菌病是由致病性大肠杆菌引起的畜禽不同类型疾病的总称[4],是由该致病菌引起的局部或全身性疾病。由于菌株的特性,侵入途径以及畜禽的日龄、生理机能、免疫状态及环境因素等的差异,疾病的临床表现、病变类型等也有所不同。对于猪的感染,可分为仔猪黄痢、仔猪白痢,和水肿病。禽大肠杆菌病主要包括大肠杆菌性败血症,大肠杆菌性肉芽肿、气囊病、禽蜂窝织炎、关节炎。大肠杆菌病给养殖业带来了严重的危害,造成了巨大的经济损失,因此有必要对该病病原大肠杆菌的毒力因子进行研究,以搞清其治病机理[5]。
食源性致病微生物中致病性大肠杆菌是影响食品质量和安全的主要因素之一,建立和完善食品中致病微生物尤其是致病性大肠杆菌(EPEC)的快速检测技术具有很更要的现实意义。PCR技术以其自身的灵敏度高,特异性强,速度快等优点作为食源性致病微生物检测的关键技术在食品中得到广泛的应用[6]。
flic基因编码大肠杆菌的鞭毛蛋白,该基因既是大肠杆菌的毒力基因,又是大肠杆菌血清型分型的标志基因[7],因此,以大肠杆菌 flic基因作为检测对象是鉴定大肠杆菌血清型的必需指标。核酸传递遗传信息的基础在于其碱基的排列顺序,碱基种类和排列顺序发生改变可导致氨基酸种类发生改变,最后会直接导致细菌形态、耐药性等发生变化,细菌产生遗传变异多数是为了适应其生长环境的变化,从而利于菌体更好的生长与繁殖,也有少数突变不利于细菌的生长繁殖[8]。本试验对食源性大肠杆菌flic基因进行核苷酸序列测定与分析,旨在为食源性致病大肠杆菌血清型的分子鉴定以及深入研究flic基因的遗传变异以及致病特性提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株 食源性大肠杆菌分离株为从附近餐饮店餐厨剩余物中分离所得。
1.1.2 试剂 Tag DNA聚合酶(产品编号:DR001A)购自宝生物工程(大连)有限公司;琼脂糖(产品编号:D601)购自宝生物工程(大连)有限公司;细菌基因组提取试剂盒(DP302-02)购自天根生化科技(北京)有限公司;DL 2 000 DNA Marker购自天根生化科技(北京)有限公司;Tris碱、冰乙酸、EDTA等购自苏州万隆化学试剂有限公司。
1.1.3 仪器 THZ-300C型恒温培养摇床,上海一恒科技有限公司;LHR系列生化培养箱,上海一恒科技有限公司;HH-4型数码电子恒温水浴锅,常州国华电器有限公司;YCD-EL259型中科美菱系列科研、医疗保存箱,中科美菱低温科技有限公司;YXQ-SG46-280手提式轧电两用高压蒸汽灭菌器,丹东市日用五金厂;JPT-1架盘药物天平,福州天平仪器厂;WG25+型基因扩增仪,杭州朗基科学仪器有限公司;Mini spin小型离心机,购自德国Eppendorf公司;QUANTUM ST4型凝胶成像分析系统,法国vilber公司;DYCP-31DN型电泳仪,北京市六一仪器厂;MODEL Fs-312暗箱式紫外线透射分析仪,上海复生生物工程研究所。
1.1.4 细菌培养基 普通营养肉汤购自北京陆桥技术有限责任公司。
1.1.5 引物 以GenBank登陆的大肠杆菌flic基因序列作为参考,应用生物学软件设计扩增大肠杆菌flic基因的特异性引物,预期基因片段大小为1381 bp。引物序列如下:flic-上游:5’-ATG GCACAAGTCATTAATACCA-3’;flic-下游:5’-TTAA CCCTGCAGCAGAGAC-3’;设计好的引物寄送宝生物(大连)工程有限公司进行合成。
1.2 方法
1.2.1 菌种的复苏 (1)普通营养肉汤(NB)培养基的制作:按照所用NB培养基18 g/L的配比说明,称取所需要的培养基的量,加入相应比例的蒸馏水溶解后分装到试管,每管约3 ml。121 ℃ 高压灭菌15 min,即可接种细菌或放置冰箱保存备用。(2)细菌的接种与培养:将-80 ℃超低温冰箱中的菌种取出后置于室温解冻,在无菌操作条件下用移液器吸取10 μl的封存菌液无菌操作加入准备好的营养肉汤培养基中,放置于37 ℃ 生化培养箱中培养18~24 h。
1.2.2 细菌基因组DNA的提取 按照试剂盒说明书进行操作。具体操作如下:(1)取细菌培养液5 ml,10 000 r/min离心1 min,尽量吸取上清液。(2)向菌体沉淀中加入200 μl缓冲液GA,振荡至菌体彻底悬浮。(3)向管中加入20 μl蛋白酶k溶液,混匀。(4)加入220 μl缓冲液GB,振荡15 s,70 ℃放置10 min,溶液应变清亮,简短离心以去除管盖里壁的水珠。(5)加220 μl无水乙醇,充分混匀15 s,此时可能会出现絮状沉淀,简短离心以去除管盖里内壁的水珠。(6)将上一步所得溶液和絮状沉淀都加入一个吸水柱CB3中,12 000 r/min离心30 s,倒掉废液,将吸水柱CB3放入收集管。(7)向吸水柱CB3中加入500 μl缓冲液GD,12 000 r/min离心30 s,倒掉废液,将吸水柱CB3放入收集管。(8)向吸水柱CB3中加入700 μl漂洗液PW,12 000 r/min离心30 s,倒掉废液,将吸水柱CB3放入收集管。(9)向吸水柱CB3中加入500 μl漂洗液PW,12 000 r/min离心30 s,倒掉废液,将吸水柱CB3放入收集管。(10)将吸水柱CB3放入收集管,12 000 r/min离心2 min,倒掉废液。将吸水柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。(11)将吸水柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200 μl洗脱液TE,室温放置2~ 5 min,12 000 r/min离心2 min,将溶液收集到离心管中。
1.2.3 flic基因PCR扩增体系的配制 在0.2 ml的PCR管中依次加入PCR Buffer 5 μl、dNTP 4 μl、flic-上游引物1 μl、flic-下游引物1 μl、细菌基因组DNA 1 μl、Tag DNA聚合酶0.5 μl、去离子水37.5 μl,共50 μl。
1.2.4 flic基因PCR反应条件的设定 94 ℃ 变性1 min、54 ℃ 退火1 min、72 ℃ 延伸2 min,然后进行35个循环,最后72 ℃ 延伸10 min,4 ℃ 保存。
1.2.5 目的基因PCR扩增产物的琼脂糖凝胶电泳 (1)50×TAE缓冲液的配制:0.5 mol/L的EDTA (pH=8.0)溶液的配制:EDTA∙Na2·2H2O,18.6 g;蒸馏水,80 ml;将EDTA充分溶解后,用NaOH调至pH为8.0定容至100 ml,121 ℃ 高压灭菌20 min。Tris碱,242 g,冰乙酸,57.1 ml;0.5 mol/L的EDTA (pH=8.0)100 ml,将上述成分混匀后定容至1 L。(2)1×TAE的配制:电泳所需1×TAE的缓冲液由50×TAE的缓冲液稀释得到,计算可知,配制100 ml 1×TAE需要2 ml 50×TAE缓冲液和98 ml的蒸馏水。(3)制胶:称取1 g琼脂糖加入250 ml的锥形瓶中,用量筒量取100 ml 1×TAE与之混合后,置于微波炉融化至凝胶溶液沸腾透亮,取出后加入5 µl的EB,制备成1 % 琼脂糖凝胶溶液。在制胶槽中,插入楔形的梳子,将1 % 琼脂糖凝胶溶液轻轻混匀后倒入制胶槽中,水平放置制胶槽,在室温条件待凝胶完全凝固后小心移去梳子。然后将内槽放入电泳槽中,向槽内倒入1×TAE电泳缓冲液至溶液没过胶板1~2 mm为止。(4)琼脂糖凝胶电泳:取5 μl flic基因的PCR扩增产物与适量的上样缓冲液混匀后加入凝胶加样孔中,同时在相邻加样孔中加入5 μl DNA Marker。加样完毕后,设定电压为100 V进行电泳,电泳20 min后在凝胶成像系统中进行电泳结果的观察。
1.2.6 目的基因PCR扩增产物的核苷酸序列分析与比对 将含有目的基因的PCR扩增产物送到生物公司进行纯化测序,测定的核苷酸序列通过DNAStar软件与参考序列进行同源比对分析。
2 结果与分析
2.1 基因组DNA电泳结果
提取的基因组DNA经1 % 琼脂糖凝胶电泳后,结果表明(图1)提取的基因组所在泳道条带清晰,适合作为PCR扩增用模板。
2.2 flic基因PCR扩增产物电泳结果
目的基因PCR扩增产物经1 % 琼脂糖凝胶电泳后,结果表明(图2)目的基因扩增产物所在泳道出现符合预期1381bp的DNA片段。
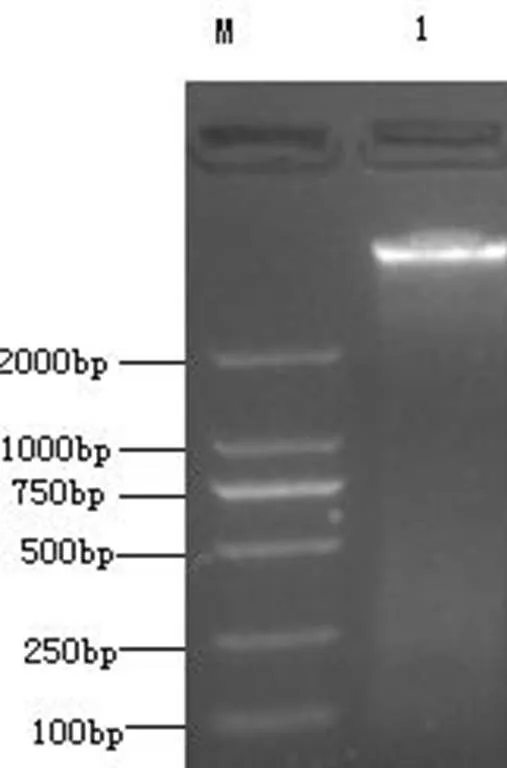
图1 大肠杆菌基因组DNA琼脂糖凝胶电泳结果
M. DL 2 000 Marker;1.基因组DNA
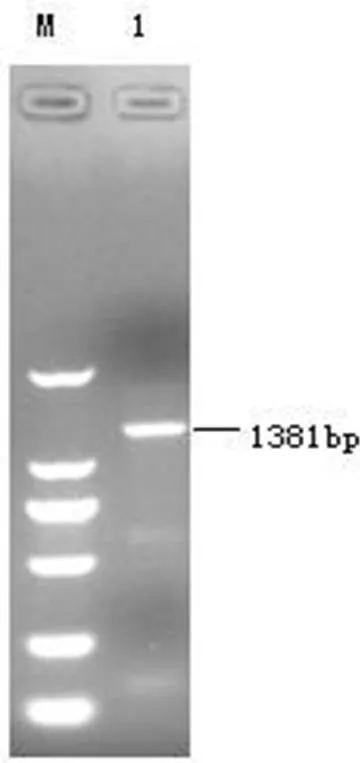
图2 大肠杆菌Flic基因琼脂糖凝胶电泳结果
M. DL 2 000 DNA Marker;1.flic 基因
2.3 flic基因的核苷酸序列比对与同源性分析
将所测大肠杆菌分离株flic基因的核苷酸序列与参考大肠杆菌H511菌株(GenBank登录号:AJ865464)、E49菌株(GenBank登录号:AJ884568)通过DNASTAR软件进行比对分析,结果表明所测分离菌株flic基因与两个参考菌株的flic基因在6bp处均发生碱基的突变。所测分离菌株flic基因相对于H511菌株除在位置6发生突变外,其他位置未发生碱基的突变。所测菌株flic基因相对于E49菌株还分别在19 bp、27 bp、42 bp、45 bp、51 bp、54 bp、153 bp、196 bp、198 bp、207 bp、208 bp、240 bp、258 bp、264 bp、339 bp、381 bp、385 bp、438 bp、468 bp、824 bp、1110 bp位置处发生碱基突变,分别为G突变为C、T突变为C、C突变为T、A突变为C、C突变为T、T突变为C、C突变为T、A突变为G、T突变为A、T突变为G、T突变为A、C突变为T、C突变为T、T突变为A、T突变为C、T突变为G、G突变为A、T突变为C、C突变为T、G突变为A、G突变为A。同源性分析结果表明,所测分离株flic基因与参考大肠杆菌H511菌株、E49菌株的lic基因序列同源性分别为99.9 %、98.4 %。
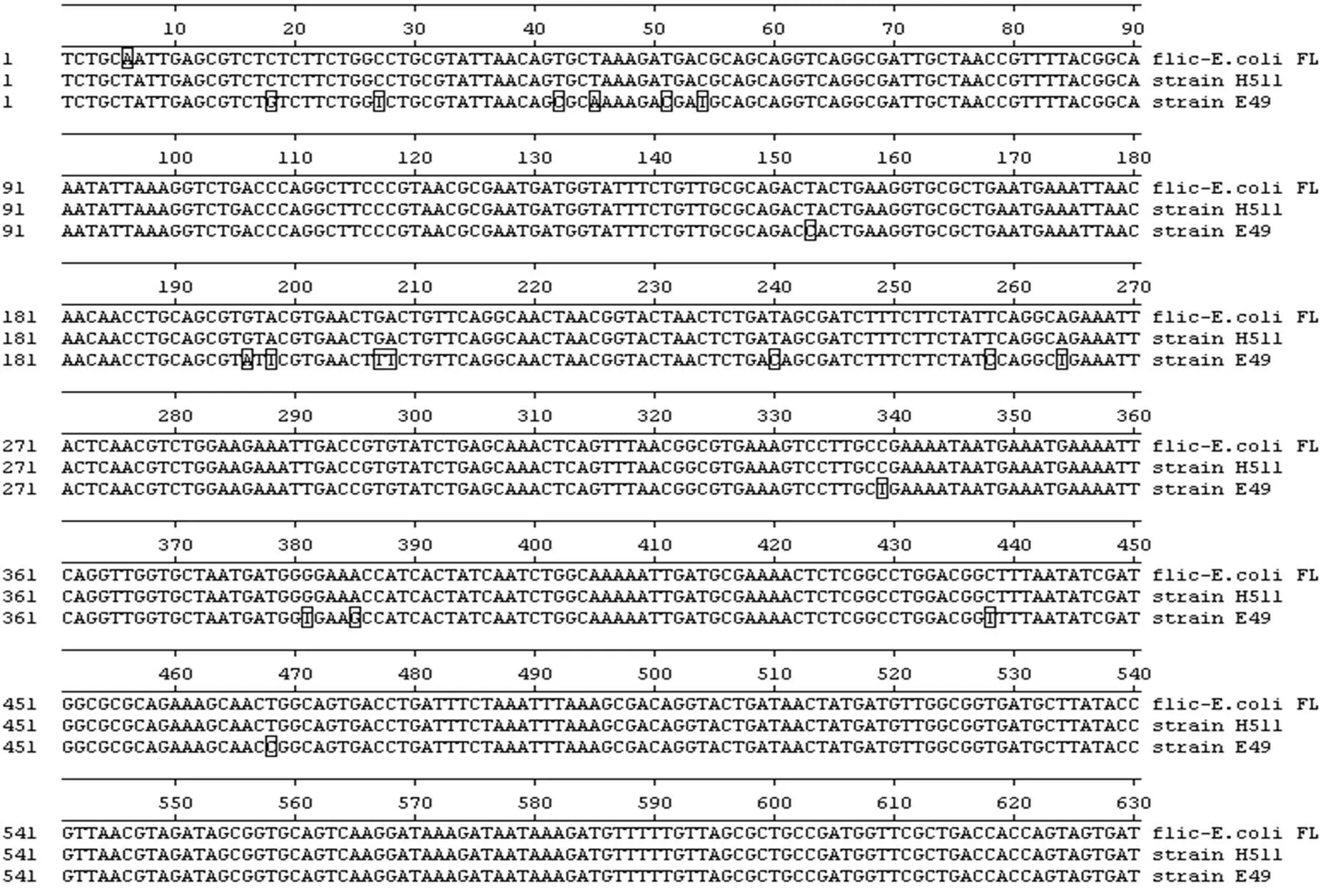

图4 flic基因同源性分析
3 讨论
(1)致病性大肠杆菌(EPEC)是引起婴幼儿急性、慢性腹泻和成人散发性腹泻以及旅行者腹泻的的一类重要病原和,而且还导致了婴幼儿营养不良等并发症[9]。致病性大肠杆菌导致的腹泻病也是断奶前后幼兔死亡的主要原因,据国内研究调查肠致病性大肠杆菌是幼兔细菌性腹泻的主要病原菌[10],因此,该菌给人畜健康和经济带来了巨大损失。(2)大肠杆菌的抗原较复杂,其完整的血清型包括菌体抗原(O抗原)、荚膜抗原(K抗原)、鞭毛抗原(H抗原)和菌毛抗原(F抗原)[11]。鞭毛是细菌的一种特殊结构,约半数的杆菌、极少数球菌和所有的螺旋菌及弧菌都有鞭毛,其不但与细菌的运动有关,而且在细菌的感染与免疫及细菌分类鉴定等方面发挥着重要作用。由于研究技术的限制,人们最早研究鞭毛是从其染色方法开始的,随着现代分子生物学技术的飞速发展,人们开始从基因水平来研究鞭毛作为运动器官的分子机制及其与毒力相关的基因。目前研究较多的是鞭毛蛋白的中央区段和flic基因[12-13],而且针对在细菌鞭毛蛋白结构的研究,国外已有相关报道[14-15]。每种型的大肠杆菌菌体都有鞭毛抗原,因此,加强对大肠杆菌flic基因的研究能为该菌的分子分型提供可靠地检测靶标。(3)本实验所测食源性大肠杆菌分离株flic基因长度为1381个核苷酸,核苷酸序列同源性分析结果表明所测分离株flic基因与参考大肠杆菌H511菌株(血清型为O102:H40)、E49菌株(血清型为O79:H40)flic基因的核苷酸的同源性分别达到99.9 % 与98.4 %,分离株与H511菌株核苷酸差异最小,只有一个突变,同源性也最高,说明此次分离的食源性大肠杆菌与H511菌株生物学特性最近。
[1] 马红霞, 丛薇, 刘玉堂, 等. 不同动物源性大肠杆菌多生耐药调控基因SDIA的同源性分析[J]. 中国预防兽医学报, 2008, 30(6): 435-439.
[2] 席美丽, 只帅, 王小璞, 等. 食源性大肠杆菌的PCR检测[J]. 西北农业学报, 2011, 20(12): 188-191.
[3] 刘秀英, 胡怡秀. 全球食源性疾病现状[J]. 国处医学, 2003, 30(4): 200-205.
[4] 邢艳苹, 王俞. 动物源性大肠杆菌耐药性分析[J]. 吉林畜牧兽医学报, 2010, 11(31): 7-10.
[5] 张越南, 张彦明, 张怀喜. 大肠杆菌毒力因子的研究概况[J]. 动物医学进展, 2003, 24(4): 26-29.
[6] 黄留玉. PCR最新技术、原理、方法及引用[M]. 北京化学工业出版社, 2005.
[7] Reid S D, Selander R K, Whittam T S. Sequence diversity of flagellin(fliC)alleles in pathogenic Escherichia coli[J]. J Bacteriol, 1999, 181(1): 153-160.
[8] 吴乃虎. 基因工程原理[M]. 北京: 科学出版社, 2001.
[9] 王斌, 但国蓉, 袁静, 等. 乳杆菌黏附抑制致病大肠杆菌对肠上皮样细胞侵袭的初步研究[J]. 解放军医学杂志, 2006(6): 550-552.
[10] V P Gannon,M Rashed,R K King,et al.Detection and characterization of the eae gene of shilike toxin producing Escherichia using polymerase chain reaction[J]. J clinMicrobial. 1993, 31(5): 1268-1274.
[11] 潘群兴, 王永山, 刘洁, 等. 肠出血性大肠杆菌O157:H7rfbE与flic基因的表达与鉴定[J]. 江苏农业学报, 2009, 25(3): 568-571.
[12] Maynarelli L A. Antigenic flagellar epitope of Borealis Burgdorferi in serologictests for diagnosis of lymeborreliosis[J]. ClinMicriol, 1992, 30(12): 3158-3162.
[13] 吕冰, 万康林. 中国莱姆病螺旋体鞭毛蛋白中央区的基因克隆与表达[J]. 中华微生物与免疫学杂志, 2004, 24(8): 611-614.
[14] Yonekura K, Mak-i Yonekura S, Namba K.Complete atomic model of the bacterial flagellar filament by electron cryo-microscopy[J]. Nature, 2003, 424(6949): 643-50.
[15] Maruyama Y, Momma M, Mikami B, et al. Crystal structure of a novel bacterial cell-surface flagellin binding to a polysaccharide[J]. Biochemistry, 2008, 47(5): 1393-1402.
(2020–09–14)
S852.61+2
A
1007-1733(2020)12-0006-05
