CD4+ CD25+调节性T细胞检查在肺癌患者诊疗中的作用
2020-12-30赵海燕陈永生
赵海燕 陈永生


【摘要】 目的:研究各型肺癌患者外周血中CD4+ CD2 5+調节性T细胞( regulatory Tcell,Tregs)的变化及意义。方法:采用流式细胞技术检测116例肺癌患者外周血中CD4十CD25+ Tregs的变化,并选择40倒健康体检者作为对照组进行结果分析。结果:肺癌患者外周血中CD4+ CD25+ Tregs占CD4+T淋巴细胞总数明显高于健康对照者;化疗前肺癌患者外周血中CD4+ CD25+ Tregs数明显高于化疗后肺癌患者。结论:肺癌患者外周循环血中CD4+ CD25+ Tregs水平表达明显身高,可能与肺癌患者免疫功能调控紊乱有关,可作为肺癌患者诊断与治疗的一项重要指标。
【关键词】 流武细胞术;调节性T细胞;肿瘤
【中图分类号】R969.4
【文献标志码】A
【文章编号】10050019《202 0)21-002-01
肿瘤的发生、发展不仅能抑制自身免疫性疾病的发生,还可能参与肿瘤免疫的调节。CD4+ CD25+ Tregs在人体内的表达水平与肿瘤的关系报道较多,但有关CD4+ CD25+ Tregs的表达与肺癌关系的研究报道较少,我们探讨了肺癌患者外周血CD4+ CD25+ Tregs水平与各型肺癌的关系及其临床意义。
1 材料和方法
1.1 一般资料选择2018年9月2019年9月我院住院的经病理诊断的肺癌患者116例(男62,女54),年龄(25-83)岁,平均年龄58.5岁,其中鳞癌42例,小细胞未分化癌30例;大细胞未分化癌23例,腺癌21例。
1.2正常对照组选择健康查体人员40例(男20,女20),年龄31-60岁,平均年龄55.5岁。其年龄、性别方面均与病例组具有可比性。排除肿瘤及免疫性等疾病。
1.3实验指标与检测方法
1.3.1患者人院后当天取静脉血;治疗一个疗程后,分别抽取空腹静脉血3 ml,用流式细胞仪测定CD3+、CD4+、CD8+、CD25+含量,流式细胞仪为美国Beckman Coulter EpicsXL型。
1.3.2 小鼠抗人荧光标记单克隆抗体anti- CD3、anti- CD4、anti- CD8、anti- CD25等均购自美国BDIS公司。
1.3.3淋巴细胞荧光抗体标记新鲜的全血3011L与抗体10μL混合,室温孵育30 min。加入anti- IgG异硫氰酸荧光素(FITC) 10μL,室温孵育30 min,PBS冼涤,PBS洗涤后用1%多聚甲醛固定10 min后,用流式细胞仪分析。
1.3.4式细胞仪数据获取和分析全部数据用流式细胞仪(美国BD公司)和软件LYSYSⅡ进行双色荧光参数获取和分析。
1.3.5 方法 以SPSS 10.0 for Windows统计软件进行统计学处理,所有数据均用x±s表示,采用t检验(独立样本t检验及配对样本t检验)及相关分析。
2 结果
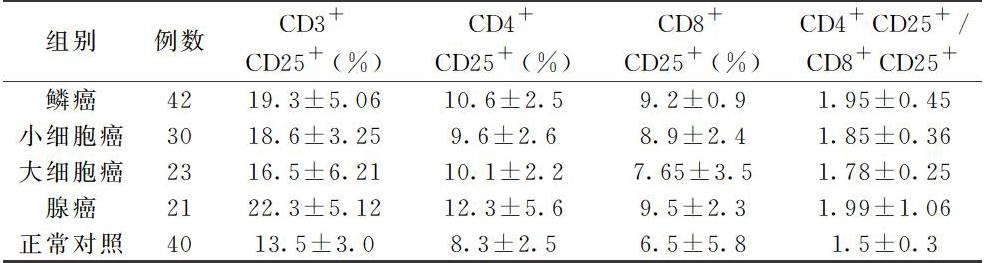
2.1肺癌患者组和正常对照组CD3十等检测结果见表1
2.2 肺癌患者组中化疗组与未化疗组结果比较见表2
2、3鳞癌、小细胞未分化癌、大细胞未分化癌、腺癌组都较正常对照组有显 胞癌。著升高(P<0.01),这四组中又以腺癌组升高最多,其次为鳞癌、大细胞癌、小细
3 讨论
CD4+CD25+Tregs是一具有免疫调节功能的T细胞亚群,大量的有研究表明,CD4+ CD25+ Tregs在许多肿瘤患者的外周血和肿瘤组织中均有增高[2]示肿瘤患者可能存在天然的免疫反应,肿瘤患者体内CD4+CD25+ Tregs数量的增高即是抑制肿瘤免疫的机制之一[3],D4+ CD25十Tregs通过抑制效应T细胞功能,在维持自身免疫耐受中发挥重要作用[4],在以后的肿瘤治疗中不容忽视。
通过对本组各型肺癌肿瘤患者外周血CCD4十CD25+ Tregs数量的检测,并与正常对照组进行了对比研究,发现正常人、肺癌患者外周血中CD4+ CD25+ Tregs分别占CD4+T淋巴细胞总数的(8.3±2.5)%和(12.7±1.65)%,引起这种变化的原因可能是肿瘤细胞通过某种机制使体内CD4+ CD25+ Tregs的数量增高来抑制肿瘤免疫。本组结果显示,肺癌患者外周血中CD4+ CD25+ Tregs的数量与病理类型无明显相关关系(P>0.05),但与肺癌分化程度和临床分期关系密切,这说明随着肿瘤的进展,肿瘤细胞产生的CD4+ CD25+ Tregs数量增多,使免疫细胞的活性被抑制,有利于肿瘤的生长与转移化疗后患者体内癌负荷减少,与化疗前相比,抑制肿瘤免疫的CD4+ CD25+ Tregs数量也相应减少,患者免疫抑制得以改善。
本研究认为肺癌患者体内CD4+ CD25+ Tregs比例上升可能是导致免疫抑制的原因之一,肺癌患者治疗前后的CD4+ CD25+ Tregs数量的变化可作为肺癌患者诊断与治疗及预后评估检查的指标之一。
参考文献
[1]Schaefer C,Gkim G. Albers A. et al. Characteristics of CD4+ CD25+ reguIatory T cell ln the peripheral circulations of patients with head and neck cancer[J]. BJC. 2005,8 (2):1。
[2]Liyange UK, Moore TT, Joo HG. et aI. Prevalence of regulatory T cells isincreased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma[J]. Immunology. 2002, 169 (5): 2756.
[3]Seo N. Hayakawa S,Takigawa M.et al. Interleukinlo express at earlytumor sites induces subsequent generation of CD4+T regulatory cells and systemic collapes of antitumour immunity [J]. Immunology, 2001. 103(4):449.
[4]Sasada T. Kimuia. Yoshida Y. et al.CD4+ CD25+ regulatory T cells in patients with gastrointestinal malignancies: Possible involvement of regulatory Tcells in disease progression[J]. Cancer, 2003, 98 (5): 1089.
