HSF1通过调节ATF6-XBP1通路影响肝脏AA淀粉样变性
2020-12-30王琨璐付志豪王宇彬刘元昊高泽晗冷建宁钱金泽
王琨璐,付志豪,王宇彬,刘元昊,高泽晗,冷建宁,尚 晶,钱金泽,刘 巍
淀粉样变性是由多种原因引起的淀粉样蛋白错误的折叠聚集,进而形成不溶性纤维沉积于各组织和重要脏器之间,造成其功能损伤或衰竭的一组慢性临床综合征,其中包括朊病毒病(prion disease, PD)、Ⅱ型糖尿病、阿尔兹海默病(Alzheimer’s disease, AD)等[1]。AA淀粉样变性是最常见的系统性淀粉样变性之一,由血清淀粉样蛋白A沉积于肝脏等重要脏器引起,临床上常继发于慢性感染或炎症,预后较差[2]。由热休克、氧化应激等因素诱发的热休克反应(heat shock response, HSR)和由内质网功能障碍引起的未折叠蛋白质反应(unfolded protein response, UPR)是维持机体稳态所必需的系统,其激活异常可能导致神经退行性疾病的发生、发展。目前对于两种应激反应系统在AA淀粉样变性中的相互作用还缺乏了解,并且相关通路在该病中的作用机制和调控途径未见详细报道。本实验采用热休克转录因子1(heat shock transcription 1, HSF1)基因敲除小鼠构建肝脏AA淀粉样变模型,着重探讨UPR通路中的2个主要因子:活化转录因子6(activating transcription factor 6, ATF6)和X-盒结合蛋白1(X-box binding protein 1, XBP1)在肝脏AA淀粉样变中的作用机制以及HSP1对其通路的调节,以证实HSR与UPR的相互作用,有助于该病在临床上的预防与治疗策略的合理选择。
1 材料与方法
1.1 实验动物分组HSF1基因敲除型小鼠受赠于日本山口大学医学系研究科医化学系中井彰教授。所用小鼠均为8周龄雄鼠,分组如下:HSF1基因敲除鼠10只,随机分为敲除型实验组和敲除型空白组,每组各5只。野生型小鼠12只,随机分为野生型实验组和野生型空白组,每组各6只。
1.2 模型制备依据Pras的经验方法,AA淀粉样纤维种子由AA淀粉样变诱导的野生型小鼠肝脏组织中提取,各实验组采用尾静脉注射AA淀粉样纤维(1 μg/100 μL),同时给予皮下注射1%AgNO30.5 mL的方法制备AA淀粉样变模型,并每隔1天皮下注射1%AgNO30.5 mL持续诱导炎症刺激。诱导实验进行1周后造模完成。
1.3 组织取材淀粉样变诱导1周后取材,采用乙醚麻醉后处死小鼠,取小鼠肝脏置入液氮,部分置于10%中性福尔马林与4%多聚甲醛配置成的固定液中室温固定进行形态学实验。其余部分直接冷藏于-80 ℃进行分子生物学实验。
1.4 形态学实验将10%中性福尔马林固定后的肝脏组织包埋封蜡,待蜡块成型后,参考李敏等[3]对肝脏组织进行石蜡切片并保存于4 ℃。将肝脏切片进行刚果红染色,并在偏光镜下观察染色情况,确定淀粉样沉积程度。同时对相同部位连续切片进行免疫组化SP法染色,小鼠淀粉样蛋白A(mouse amyloid A, mAA)抗体稀释比例1 ∶3 000,在显微镜下观察切片,特异性地判断淀粉样沉积情况。
1.5 分子生物学实验(1)肝组织GRP78、ATF6及XBP1蛋白检测:采用SDS-PAGE进行电泳分离,转膜后检测蛋白的表达,所用抗体的稀释比例分别为GRP78(1 ∶3 000)、ATF6(1 ∶200)和XBP1(1 ∶200)。(2)肝组织中ATF6及XBP1 mRNA检测:从肝脏组织中提取RNA并合成cDNA,使用Taq DNA Polymerase进行扩增。实时定量检测采用SYBR Premix Ex TaqⅡ试剂盒,操作系统选用Mx 3005 RT-PCR SYSTEM。
1.6 统计学分析应用StatView software package(Abacus Concepts, Berkeley, CA, USA)完成数据分析,采用Mann-WhitneyU完成数据的组间比较,以P<0.05为差异有统计学意义。
2 结果
2.1 HSF1敲除对肝脏AA淀粉样变的影响将小鼠肝脏切片进行刚果红染色,结果显示敲除型实验组淀粉样物质沉积显著高于野生型实验组,而敲除型与野生型空白组均未见淀粉样物质沉积(图1、2);并且淀粉样物质沉积多侵及汇管区血管壁,肝实质一般不受侵犯,符合AA淀粉样变性特点。对相同部位连续切片进行mAA免疫组化SP法染色,可见在绿色荧光位置出现等量的淀粉样沉积,证明刚果红染色所见淀粉样物质沉积即为AA淀粉样物质(图3)。上述结果提示,HSF1的缺失促进肝脏AA淀粉样变的形成。
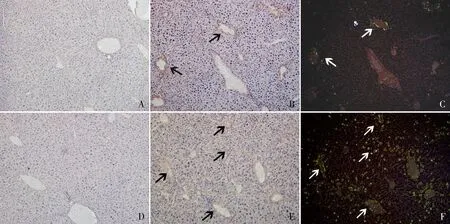
图1 各组小鼠肝脏组织中淀粉样物质的沉积,刚果红染色:A.野生型空白组;B.野生型实验组(箭头为淀粉样沉积物);C.野生型实验组(偏正光)(箭头为淀粉样沉积物);D.敲除型空白组;E.敲除型实验组(箭头为淀粉样沉积物);F.敲除型实验组(偏正光)(箭头为淀粉样沉积物)
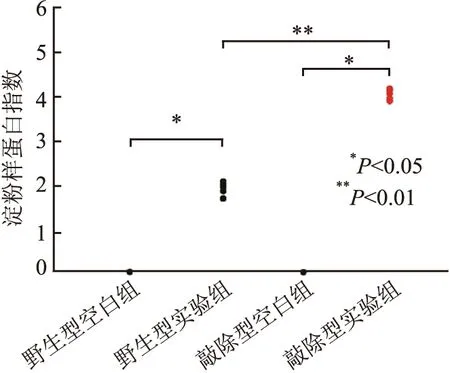
图2 各组小鼠肝脏组织中淀粉样蛋白指数的比较

图3 各组小鼠肝脏组织中mAA的表达,SP法:A.野生型空白组;B.野生型实验组(箭头所示);C.敲除型空白组;D.敲除型实验组(箭头所示)
2.2 AA淀粉样变中HSF1的缺失对UPR作用的影响内质网应激(endoplasmic reticulum stress, ERS)中的关键蛋白GRP78的表达,标志ERS的激活与UPR的启动。Western blot法检测结果显示:野生型实验组、敲除型实验组中GRP78蛋白表达量均高于相应的空白组,而敲除型实验组GRP78蛋白的表达量明显低于野生型实验组(图4);提示AA淀粉样变性激活ERS进而引发UPR,通过诱导GRP78的合成促进内质网中蛋白质的折叠,对受损细胞具有保护作用,而HSF1的缺失一定程度上削弱了这种保护反应。

图4 Western blot法检测各组小鼠肝脏组织中GRP78的表达
2.3 ATF6与XBP1 mRNA表达水平的相关性RT-PCR结果显示:野生型实验组ATF6 mRNA表达量低于野生型空白组,但前者XBP1 mRNA表达量显著高于后者;敲除型实验组ATF6 mRNA表达量显著高于敲除型空白组,但前者XBP1 mRNA表达量低于后者。以上结果提示,在AA淀粉样变过程中,ATF6与XBP1的表达呈反向相关(图5)。

图5 各组小鼠肝脏组织中ATF6和XBP1 mRNA的表达量
本组针对ATF6因子进行Western blot检测,结果可见敲除型实验组ATF6蛋白的表达量显著上升(图6),此结果与RT-PCR结果相吻合。再针对XBP1因子进行Western blot检测,可见野生型实验组XBP1蛋白表达量显著高于野生型空白组,敲除型实验组XBP1蛋白表达量明显低于敲除型空白组,而野生型空白组与敲除型空白组XBP1蛋白的表达量无明显差异,该结果亦与RT-PCR结果相吻合。此外,作为ATF6直接调控的下游因子以及经剪切后发挥作用的XBP1s原型,XBP1u在野生型实验组淀粉样变的发展中表达增强,而在敲除型实验组淀粉样变的发展中表达减弱(图7)。

图6 Western blot法检测各组小鼠肝脏组织中ATF6的表达

图7 Western blot法检测各组小鼠肝脏组织中XBP1的表达
3 讨论
淀粉样变性是一种以蛋白质构象障碍为特点的严重慢性全身性疾病,AA淀粉样变性是最常见的系统性淀粉样变性之一,其发病机制与细胞应激反应密切相关。HSF1作为调节热休克蛋白的主要转录因子,能够抑制朊病毒蛋白(prion protein, PP)、多聚谷氨酰胺(polyglutamine)蛋白等蛋白质的异常聚集和错误折叠,还可影响老化淀粉样物质(AApoAII amyloid fibrils)的形成[4-6]。本实验结果同样证实HSF1的缺失促进肝脏AA淀粉样变的形成,且淀粉样变沉积多侵及汇管区血管壁,肝实质一般不受侵犯,与先前实验结果相吻合[7]。
同时已有多种研究表明,应对ERS的保护性反应UPR与AD等淀粉样变疾病高度相关[8]。UPR系统由3个紧密相连的信号通路构成,分别为PKR样内质网激酶、ATF6和肌醇酶1α(inositol-requiring enzyme 1α, IRE1α)。其中,ATF6和IRE1α的启动子与内质网中的GRP78结合,通过诱导分子伴侣和去除错误折叠蛋白质起保护细胞的作用:ATF6全长蛋白在转运到高尔基体后被激活,并被加工为可溶性细胞质片段释放,能够进入细胞核并激活特定基因子集的转录。IRE1α则通过自磷酸化被激活,导致XBP1 mRNA的加工,产生有效的转录因子XBP1s发挥作用。有关ATF6与XBP1通路的紧密联系已得到证实:当细胞处于稳态时,ATF6以酶原形式与GRP78结合[9];而UPR启动后,内质网上的GRP78-ATF6复合体发生解聚,ATF6经高尔基体被转运至细胞核中,通过调节XBP1等相关基因的转录从而减轻ERS、恢复细胞稳态[10]。
本实验结果显示,在野生型实验组ATF6因子表达低于野生型空白组,XBP1因子表达则高于空白组;而在敲除型组中ATF6、XBP1因子表达呈相反趋势,这可能是由于HSF1基因对机体具有保护作用,从而抑制应激的过度表达:在AA淀粉样变性初期,HSF1基因被激活,增强ATF6和XBP1通路相关因子的表达以对抗应激损伤;一旦应激过度对机体自身造成破坏,ATF6的表达将被HSF1反向抑制,呈XBP1表达增强而ATF6表达减弱的趋势。在HSF1基因敲除后,ATF6的表达因不受制约而显著增强,应激持续存在,下游XBP1的表达随之急剧增加,进而激活下游的凋亡途径,导致机体损伤进一步加重。另外,结合实验结果“XBP1u在野生型实验组中表达高于敲除型实验组”,可以推测敲除型实验组XBP1s表达急剧增强会反过来抑制XBP1u的表达,从而使XBP1整体表达减弱,最终呈ATF6的表达增强而XBP1表达减弱的趋势,其结果有待后续实验进一步验证。
综上所述,HSF1的缺失削弱肝脏组织中的UPR反应,从而加剧了机体淀粉样物质的沉积程度,强有力地证实HSR和UPR之间的相关性。这与先前的实验结论相吻合:HSR能通过多种途径对UPR起调节作用,包括上调参与蛋白质折叠和分泌的基因、抑制总体转录和翻译以及协调氧化应激等其他应激反应;并且HSR和UPR能够共同控制ERS中的蛋白质折叠和分泌,增强内质网的抗逆性[11];同时也有实验表明,通过HSR激活HSF1需要完整的UPR通路[12],从而证实UPR对HSR亦存在调节作用。本实验通过探讨HSF1对ATF6-XBP1通路在肝脏AA淀粉样变性中的作用机制,揭示了HSR与UPR在其中的相互作用,为淀粉样变疾病的发病机制提供新依据,有助于该病在临床上的预防与治疗策略的合理选择。
