膀胱相对电子密度对术后宫颈癌放射治疗计划的剂量影响*
2020-12-30石先伟陈亚正梁丽华唐组阁潘荣强
石先伟 陈亚正 何 英 梁丽华 唐组阁 王 丽 袁 志 别 俊 潘荣强*
当前主流的肿瘤放射治疗计划系统(treatment planning system,TPS)是以计算机断层扫描[1](computed tomograph,CT)图像为基础进行靶区、正常组织勾画和计划设计,而组织电子密度或者相对电子密度是TPS通量优化以及剂量计算时必不可少的因子。人体组织的电子密度在计划系统中是通过器官的CT-密度曲线转换为对应的电子密度,从而成为放射治疗计划不均匀剂量校正计算的重要因素[1]。因此,准确的电子密度信息对剂量计算至关重要。本研究避开CT-密度曲线,通过国际辐射测量标准委员会(International Commission on Radiation Unites and Measurements,ICRU)46号报告[2]提供的人体电子密度来计算相对电子密度(relative electron density,rED),提供给计划系统(Monaco 5.11瑞典)里组织勾画功能模块用以计算,通过人为指定电子密度的方法研究其对放射治疗计划剂量准确性的影响。
表1 三种治疗计划与原始计划之间的靶区剂量参数偏差(,%)
注:表中D98为98%计划靶区体积剂量;D2为2%计划靶区体积剂量;Dmean为平均剂量
1 资料与方法
1.1 临床资料
选取2018年1月至2019年12月南充市中心医院实施放射治疗的4例术后宫颈癌患者CT图像,保留原始计划,并重新计算符合临床剂量处方的计划。术后宫颈癌患者的计划临床靶体积(planning clinical target volume,PCTV)包括腹部淋巴结引流区(PCTVln),阴道残端(PCTV1),宫旁组织(PCTV2),周围正常器官主要包括膀胱、直肠、小肠及左右股骨头。放射治疗计划系统为Monaco5.11版本,计划设计过程中对危及器官(organ at risk,OAR)的剂量限值为:膀胱剂量体积V40<40%,直肠V40<40%,小肠V30<30,所有靶区和OAR的D1cc≤50 Gy。所有靶区的剂量处方均为45 Gy/25次。
供试品种为大力士苏丹草(Sorghum sudanense)作为旱区高产稳收的一年生禾本科优质牧草,其适应性强,饲用价值高,适用于调制干草、青饲和青贮等。
1.2 仪器设备
采用Axess加速器(瑞典Elekta公司)多叶光栅数据,以及Monaco5.11计划系统(瑞典Elekta公司)设计宫颈癌放射治疗计划。
1.3 放射治疗计划
制定放射治疗计划的基本原则是在保证处方剂量覆盖靶区体积95%以上即D95≥处方剂量,尽可能压低正常组织的受量。除电子密度外在优化的宫颈癌治疗计划与原始计划采用一致的条件,采用双全弧360°的容积旋转调强放射治疗(intensity modulated radiation therapy,IMRT)技术进行照射[3-5]。使用子野形状优化方法和存储剂量片段方法提高计算效率。计算网格为0.3 cm×0.3 cm×0.3 cm,最小子野宽度0.6 cm。
歌词是歌曲传播的载体,现下有许多流行歌曲的歌词内容丰富,文笔优美,有的博古通今,有的贴近生活,富有较多的文学素养等着我们去挖掘。当然也存在较为恶俗的歌词,这时就需要老师严格把关,慎重选择,再推荐给学生。那么,如何将歌词运用到作文教学中去呢?怎么教会学生在流行歌词中找素材,炼字句,将歌词中的好与美化为己用呢?
1.4 数据处理方法
本文设计一种用于可流动状态下细胞电阻抗成像检测的多电极阵列微流控芯片。该芯片可以对静止状态下的细胞和流动状态下的细胞进行电阻抗成像检测。仿真软件模拟结果显示,电极对内部细胞的位置变化比较敏感,可以通过电极所测量的电压变化计算出细胞的空间分布。
以原始计划(Plan)为参考计划,计算Plan1、Plan2和Plan3的剂量参数与参考计划参数的偏差,其计算为公式1:

式中X为1、2、3。
在OAR中,对于膀胱:Plan1的D1cc、Dmean、V30及V40与原始计划的偏差为-0.3%~-0.5%,Plan2引起的偏差为1%~3%,Plan3产生的误差最为宽泛,为-5%~1%。直肠的剂量参数在Plan1中的偏差在-0.1%左右,Plan2和Plan3偏差分别是前者的2倍和10倍以上。小肠的剂量参数在Plan1和Plan2中波动范围很小,为-0.02%~-0.44%,Plan3中的小肠剂量参数波动范围<1.79%。Plan2、Plan3的个别参数偏差>2%,按照文献[7-9]以及医用电子直线加速器质量控制指南标准[10]不建议临床使用。膀胱电子密度改变后对3种计划的子野总数无影响,出束跳数的平均偏差分别为0.05%、-0.47%和1.84%。准确的电子密度导致跳数不受影响,rED增大则使跳数偏差也增加,即呈线性相关。Plan1的整体剂量偏差<0.6%,从放射治疗精确度考虑与原始计划无明显差异。3种治疗计划与原始计划OAR剂量参数的比较见表2。
通过国际辐射测量标准委员会ICRU 46号报告查询到膀胱和人体的rED,从而得到rED=1.027,将该值填入Monaco 5.11系统中勾画功能模块对应位置,将该计划命名为Plan1。此外,为了观察该值对计划的影响,取膀胱的rED=0.5、rED=1.5对应的计划为Plan2,Plan3。每个患者CT图像制定3个计划,4例患者共12个治疗计划。改变rED后只计算剂量,无需重新优化通量。计算完毕后,将所有计划的PCTVln剂量归一到D95为45 Gy,在剂量-体积直方图(dosevolume histogram,DVH)中统计的剂量参数包括所有靶区的D98、D2以及平均剂量(Dmean),OAR膀胱、直肠和小肠的剂量D1cc和Dmean为30 Gy、40 Gy覆盖的相对体积容积剂量参数为V30和V40。
2 结果
2.1 靶区剂量偏差
将rED为1.027、0.5和1.5在计划系统中赋予膀胱电子密度,分别生成Plan1,Plan2,Plan3。1.027是准确的膀胱平均电子密度,另取0.5、1.5作为实验电子密度来评估该参数对计划剂量的影响。在靶区PCTV1、PCTV2和PCTVln的剂量参数D98、D2及Dmean在3种计划中与原始计划Plan0的偏差中,Plan1中的3个靶区的剂量参数偏差为-0.01%~0.04%,且88%的数值略低于原始计划;Plan2中靶区剂量与Plan0的偏差为-0.11%~1.63%;Plan3与Plan0的靶区剂量偏差为-4.64%~1.58%。在靶区剂量方面,与原始计划比较,Plan1与Plan2的偏差<2%,均可忽略不计。rED为1.5生成的Plan3对靶区剂量准确性造成了明显影响,远高于Plan1、Plan2。3种治疗计划与原始计划之间的靶区剂量参数偏差见表1。
2.2 OAR剂量偏差
比较同一患者不同计划之间跳数和子野总数的偏差。
表2 三种治疗计划与原始计划危及器官剂量参数的比较(,%)
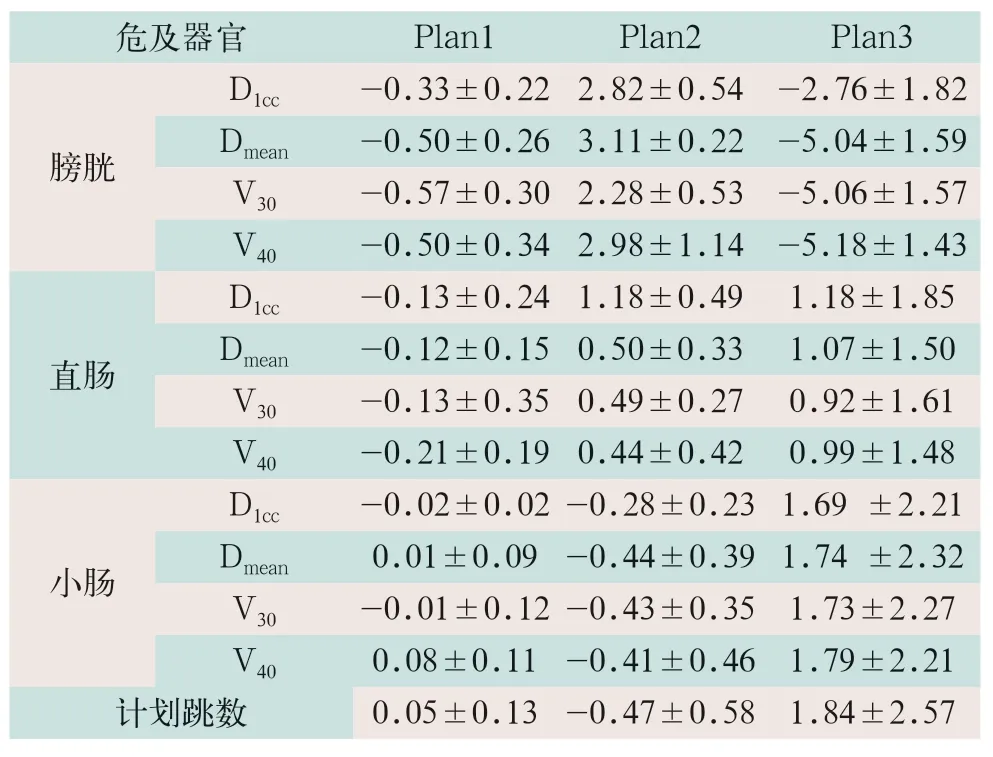
表2 三种治疗计划与原始计划危及器官剂量参数的比较(,%)
注:表中D1cc为1 cc体积所受照剂量;Dmean为平均剂量;V30和V40均为容积剂量参数
3 讨论
将膀胱的rED为1.027,人为赋予放射治疗计划系统而产生的计划(Plan1)与原始计划相比(Plan0)偏差可忽略不计。为减少与原始计划的区别,生成的计划未重新优化通量,只进行了剂量计算。此外随机选择rED=0.5、1.5产生计划(Plan2、Plan3)来比较rED的改变对计划剂量准确度产生的影响
在北京石油干部管理学院学习的两个月中,我们学习了很多哈佛管理课程。“沟通难题”,本身就是提高自身工作能力的一种表现。
国外学者[11-14]分别对组织电子密度对于肿瘤位于头部、颈部、腹部、胰腺癌以及前列腺癌的放射治疗计划的影响进行研究,其结果显示电子密度对靶区和OAR的剂量影响在2%和5%以内。Prior等[6]为了研究磁共振图像直接用于肺癌容积旋转IMRT计划计算,而将相对电子密度赋予计划系统模块,选取了6例患者,对靶区和肺组织均进行rED赋值,剂量参数与基于CT图像生成的计划相比有5%的偏差[6,15]。Jonsson等[16]研究了电子密度对喉癌三维适形放射治疗计划和静态固定野调强计划的影响,其勾画了肺组织,软组织,但未勾画骨骼,靶区的D95与原始计划的平均偏差在-0.56%左右(-2.47~0.46)。Rank等[13]和Karotki等[14]证明了对骨骼、空气以及软组织使用合理的rED可以生成临床上可接受的放射治疗计划。诸如上述研究主要基于单个靶区和少数OAR的参数统计,对于不同部位的肿瘤放射治疗计划,相对电子密度对计划剂量的影响结论并不一致。
4 结论
本研究通过ICRU找到准确的膀胱绝对电子密度,进一步计算得到其相对电子密度,在Monaco计划系统上赋予该值,统计靶区PCTV1、PCTV2及PCTVln的D98、D2和Dmean多项指标,以及重要OAR的各种剂量参数包括D1cc、Dmean、V30及V40,其结果表明,膀胱准确的相对电子密度可以生成与原始计划偏差极小,且符合临床需要的放射治疗计划。Chen等[17]在基于磁共振成像(magnetic resonance imaging,MRI)上的胰腺癌放射治疗体位研究中,将胰腺肿瘤以及肝、肾、肠胃道以及脊髓等所有正常组织均授予准确的相对电子密度,得到了符合临床治疗的放射治疗计划。本研究修改了一个OAR的rED,如果赋予更多器官的电子密度,是否能得到与原始计划一致的剂量结果有待于进一步验证。主流的放射治疗计划系统以CT图像为基础,但MRI在软组织对比度上和功能影像方面更有优势[18-20]。由于MRI缺乏电子密度信息而无法直接用来剂量计算,将导入到计划系统中的MRI手动赋予电子密度这一方法可以解决这一困难。本研究为MRI投入计划系统参与剂量计算提供了前期基础,对提高肿瘤放射治疗精度具有重要的指导意义。