PAM 细胞中猪MMP14 不同转录本检测及其生物信息学分析
2020-12-30吴俊静万绪玲黄藏宇武华玉梅书棋彭先文
吴俊静,万绪玲,黄藏宇,乔 木,武华玉,梅书棋,彭先文
(1.湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,武汉 430064;2.江夏区动物卫生监督所,武汉 430200)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是猪繁殖与呼吸综合征病毒(PRRSV)感染引起的一种危害极大的传染性免疫抑制性疾病。PRRSV 具有严格的宿主和细胞嗜性,入侵宿主细胞依赖细胞特异性受体,如CD163[1]。PRRSV 只感染猪,不感染其他物种,且主要感染单核巨噬细胞系中分化完全的细胞,尤其是猪肺泡巨噬细胞(Porcine alveolar macrophages,PAM)。近年来国内外学者研究了PRRSV 的致病机制,取得了一些成果,但是PRRSV 的致病机制,尤其是其逃逸天然免疫、病毒与宿主互作等方面的分子机制还不清楚。
基质金属蛋白酶(MMP,Matrix metallopeptidase)家族蛋白参与细胞外基质在正常生理过程中的分解,如胚胎发育、繁殖和组织重塑等。基质金属蛋白酶14(MMP14)是MMP 蛋白大家族的膜型基质金属蛋白酶(MT-MMP)亚家族成员之一,这个亚家族的每个成员都含有一个潜在的跨膜结构域,在细胞表面表达。MMP14 参与MMP2 的激活,在肿瘤侵袭和转移中发挥重要作用[2,3],同时MMP14 也与血管生成有关[4]。有关猪MMP14 基因功能的研究较少,课题组在前期的PAM 细胞全转录组测序分析中发现MMP14 基因在PRRSV 感染前后的PAM 细胞中差异表达,且存在2 种不同的MMP14 转录本(XM_021098303.1 和NM_214239.2),推测该基因参与PRRSV 感染过程。因此本研究进一步分析了MMP14 的不同转录本在PRRSV 感染PAM 中的表达特征,为揭示PRRSV 感染宿主细胞的分子机制充实基础。
1 材料与方法
1.1 材料与试剂
5 头4~5 周龄的健康大白猪来自湖北省农业科学院畜牧兽医研究所示范猪场;PRRSV-WUH3 毒株来源于华中农业大学。PBS 缓冲液、RPMI 1640培养液、胎牛血清购自Gibico 公司;Invitrogen TRIzol 试 剂、Thermo ScientificTMRevertAidTMFirst Strand cDNA Synthesis 试剂盒购自Thermo 公司;THUNDERBIRD SYBR qPCR Mix 试剂盒购自Takara 公司。
1.2 仪器
紫外微量分光光度计购自Nanodrop 公司;CO2培养箱购自Thermo 公司;普通PCR 仪购自Bio-Rad 公司;LightCycler480 荧光定量PCR 仪购自Roche 公司;电泳仪、凝胶成像分析仪均购自北京市六一仪器厂。
1.3 PAM 细胞分离培养
选择4~5 周龄的健康大白猪(PRRSV 等各病原检测阴性),在干净无菌的环境中屠宰取全肺,用PBS 缓冲液(加1% 青霉素和链霉素)分批次缓慢灌入肺中(400~500 mL),每次对灌满的肺进行肺部按摩,并用吸管轻轻吹打,使其细胞团及黏液块打散,用无菌纱布过滤收集灌洗液,1 600 r/min 离心10 min 收集细胞。收集的细胞用RPMI 1640 培养液(加1% 青霉素和链霉素)进行洗涤,1 600 r/min 离心10 min;重复洗涤1~2 次。将洗涤好的细胞用含10% 胎牛血清的RPMI 1640 培养液重悬后,培养于10 cm 培养皿中,37 ℃、5% 的CO2培养2 h。除去未贴壁的细胞,余下细胞即可消化转入需要的6 孔细胞培养板中进行后续试验。分离的细胞用不完可以冻存,用细胞冻存液重悬细胞,进行分装冻存。
1.4 PRRSV 感染
PAM 细胞贴壁培养过夜后,用0.5 MOI 剂量的PRRSV-WUH3 毒株感染PAM 细胞,吸附1 h 后,用含2% 胎牛血清的RPMI 1640 培养液继续培养。感染24 h 后收集细胞,利用Trizol 消化细胞,提取细胞总RNA。对照组PAM 细胞用RPMI 1640 培养基替代PRRSV 毒株处理。
1.5 PAM 细胞总RNA 抽提与cDNA 制备
利用Trizol、氯仿法提取PAM 细胞总RNA。使用紫外微量分光光度计检测RNA 样品浓度与OD值,利用1% 琼脂糖凝胶电泳检测RNA 的完整性。取1 μg 的总RNA 样本,利用Thermo ScientificTMRevertAidTMFirst Strand cDNA Synthesis 试剂盒,参照试剂盒说明书进行反转录,获得cDNA。
1.6 MMP14 不同转录本荧光定量检测
根据GenBank 数据库中猪MMP14 基因(登陆号为NC_010449.5)的2 种转录本(XM_021098303.1和NM_214239.2)cDNA 序列设计3 对引物,引物序列如表1 所示,其位置如图1 所示。荧光定量PCR 采 用THUNDERBIRD SYBR qPCR Mix 试 剂盒,反应体系20.0 μL:qPCR mix 10.0 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA 模板1.0 μL,灭菌双蒸水8.0 μL。利用Light-Cycler480 荧光定量PCR 仪,以β-actin 作为内参,进行荧光定量PCR 试验,用2-ΔΔCt 法计算相对表达量,每组试验做3 个平行,每个试验重复3 次。反应条件:95 ℃预变性5 min,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,循环40 次。
1.7 MMP14 不同转录编码蛋白生物信息学分析
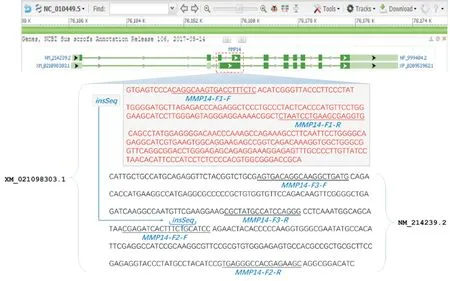
图1 MMP14 不同转录本荧光定量检测引物设计位置

表1 荧光定量PCR 引物序列
蛋白质跨膜螺旋采用在线工具TMHMM-2.0(https://services. healthtech. dtu. dk/service. php?TMH MM-2.0)预测,蛋白的功能结构域采用CDD 数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Pfam 数据库(http://pfam.sanger.ac.uk/)预测。
2 结果与分析
2.1 猪MMP14 基因不同转录本检测结果
根据GeneBank 数据库信息,猪MMP14 存在2个转录本分别是 XM_021098303.1 和 NM_214239.2,是MMP14 基因序列不同剪切导致的。XM_021098303.1 全长4 066 bp,由9 个外显子序列拼接而成,CDS 编码序列为1 785 bp,编码594 个氨基酸的蛋白(登录号为XP_020953962.1)。另一个转录本NM_214239.2 全长3 673 bp,由10 个外显子序列拼接而成,CDS 编码序列为1 743 bp,编码580个氨基酸的蛋白(登录号为NP_999404.2)。2 个转录本cDNA 序列最大的区别在于NM_214239.2 在XM_021098303.1 第3 个外显子处剪切掉一段351 bp 的序列。
根据以上特征,本研究设计了3 对荧光定量PCR 引物,第1 对引物(MMP14-F1)只能扩增出XM_021098303.1 序列,第2 对引物(MMP14-F2)只能扩增出NM_214239.2 序列,而第3 对引物(MMP14-F3)2 种转录本均能扩增出来。在PRRSV感染24 h 后的PAM 细胞中,分别采用以上3 对引物检测MMP14 不同转录本的表达情况,结果如图2所示。 由图2 可知,与未感染组(MOCK)相比,PRRSV 感染组MMP14 表达量整体下调,其中转录本NM_214239.2 表达量显著下调(P<0.05),而转录本XM_021098303.1 表达量却极显著上调(P<0.01)。
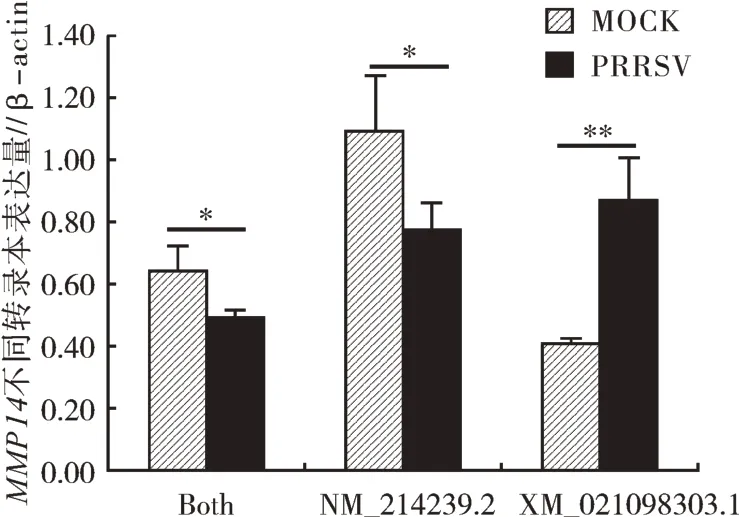
图2 猪PAM细胞中MMP14基因不同转录本定量检测结果
2.2 猪MMP14 基因不同转录本编码蛋白结构预测分析
转录本XM_021098303.1 编码的蛋白为XP_020953962.1,由594 个氨基酸组成;另一个转录本NM_214239.2 编码的蛋白为NP_999404.2,由580个氨基酸组成。2 种编码的蛋白序列主要是前端序列有差异,如图3 中下划线区域的序列所示。利用生物信息学工具TMHMM-2.0 分析蛋白质跨膜螺旋结构区域,发现这2 种蛋白均具有明显的跨膜功能区(图4),说明2 种蛋白的序列差异并不影响蛋白的跨膜功能。在此基础上,利用CDD 和Pfam 数据库分析2 种蛋白的结构域,结果如图5 所示。由图5可知,2 种蛋白都具有MMP 蛋白家族的典型结构域,如基质蛋白酶(Peptidase_M10,Matrixin)和血红蛋白样重复结构(HX,Hemopexin-like repeats)。其主要区别是XM_021098303.1 编码的XP_020953962.1 蛋白缺少1 个假定肽聚糖结合域(PG_binding_1,Putative peptidoglycan binding domain)。

图3 MMP14 不同转录本编码蛋白的氨基酸序列
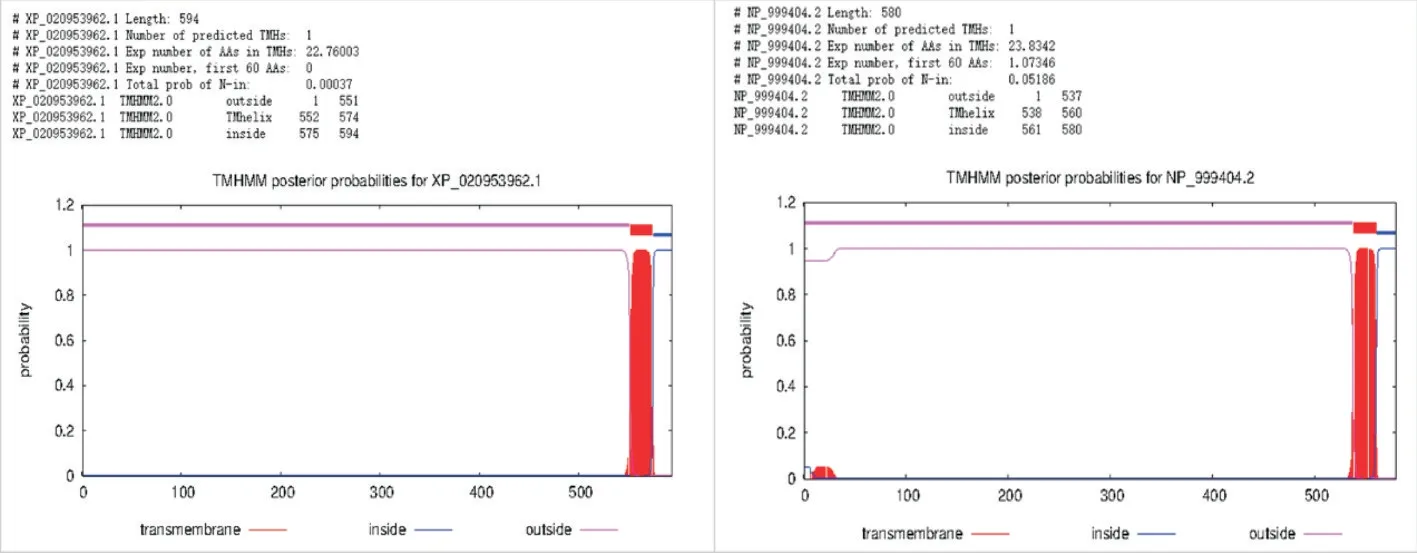
图4 MMP14 不同转录本编码蛋白膜跨越区域预测结果

图5 MMP14 不同转录本编码蛋白功能结构域分析结果
3 小结与讨论
MMP 家族是一类高度同源的锌离子和钙离子依赖肽链内切酶,以无活性的酶原形式进行表达,经过激活之后才具有酶活性。它以能够降解多种细胞外基质组分和非基质蛋白质而闻名,是各种生物活性分子如趋化因子、促炎性细胞因子、丝氨酸蛋白酶和生长因子抑制剂等的重要调节因子,在许多生理过程中起着重要作用,如组织重塑、胚胎发育、伤口愈合以及组织防御机制和免疫应答等[5,6]。MMP14是发现的第一个膜型MMP,含有跨膜结构域,在细胞表面表达。与MMP 家族蛋白相同,MMP14 本身以酶原形式合成,经氟林蛋白酶样蛋白水解酶活化,然后分泌至胞外表达于细胞膜上[7]。
本研究在PAM 细胞中鉴定了猪MMP14 基因的2 种不同转录本,并发现2 种转录本在PRRSV感染细胞后差异表达,且趋势不同。PRRSV 感染后转录本NM_214239.2 显著下调表达(P<0.05),而转录本XM_021098303.1 却极显著上调表达(P<0.01)。经过生物信息学分析后发现,猪MMP14 的2 种不同转录本编码的蛋白均保留了跨膜的活性,这也与此类蛋白主要在细胞膜表面表达相符[2-4]。同时,基质蛋白酶、血红蛋白样重复结构等MMP 蛋白家族的典型结构均相同。MMP14 的血红素域能和CD44 结合,与细胞内细胞骨架的重排、细胞迁移、侵袭以及MMP2 的激活有关[8]。
本研究发现转录本XM_021098303.1 编码的XP_020953962.1 蛋白缺少1 个肽聚糖结合域(PG_binding_1),这个结合域由3 个螺旋组成,位于多种参与细菌细胞壁降解酶的N 或C 端。该结合域可能具有肽聚糖结合功能,在大部分MMP 蛋白家族中均存在,是N-末端催化领域的基质蛋白。研究发现该结合域与肽聚糖结合[9],肽聚糖是人类免疫系统的免疫增强剂,能刺激单核吞噬细胞和内皮细胞释放免疫调控物质,如肿瘤坏死因子α(TNFα)、白介 素(IL-1、IL-6、IL-8、IL-12)、干扰 素α(IFN-α)等[10]。研究还发现MMP14 前肽结构域末端的RRKR 基序,能够被弗林蛋白酶或者相关的前蛋白转化酶水解,从而激活MMP14 蛋白前体[11,12]。XP_020953962.1 蛋白的前肽序列缺少RRKR 基序和PG_binding_1 功能区,可能导致MMP14 蛋白前体无法被活化,不具有降解细胞外基质等活性。PRRSV 感染细胞后,转录本NM_214239.2 下调表达而转录本XM_021098303.1 上调表达,可能会导致具有功能活性的MMP14 蛋白减少。MMP14 蛋白最主要的功能是促进细胞外基质降解,能水解多种细胞外基质组分和血清蛋白,如I 型胶原、纤连蛋白、玻连蛋白、层粘连蛋白、载脂蛋白等;还可以脱落细胞表面生物分子,如CD44、多配体聚糖-1、E-钙粘蛋白等;另外还可以水解细胞因子、趋化因子和生长因子等[13]。PRRSV 感染能够诱导机体产生大量的炎性因子和趋化因子,而这些细胞因子在PRRSV感染所引起的先天性免疫反应以及炎性损伤中发挥重要的作用[14],如PRRSV 感染后引起外周血单核细胞中趋化因子IL-8 的上调[15,16],IL-8 等趋化因子在病毒感染所引起的炎性反应和免疫损伤中发挥重要作用[17]。Ait-ali 等[18]研究发现,PRRSV 感染能力较低的品种猪PMA 中,IL-8 分泌大量减少,细胞因子的合成以及分泌在PRRSV 感染引起的先天性免疫反应中也具有重要功能。综上,推测PRRSV 感染后抑制MMP14 蛋白活性,与PRRSV 刺激细胞因子与趋化因子的大量表达相关。然而,MMP14 在PRRSV 感染中的具体作用还有待进一步研究。
