3 株发酵香肠源乳酸菌体外功能特性的比较
2020-12-29冯美琴栾晓旭
冯美琴,栾晓旭,孙 健,
(1.金陵科技学院动物科学与技术学院,江苏 南京 210038;2.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
脂肪的过度氧化是发酵香肠加工、贮存过程中面临的主要质量问题之一,常常造成产品风味、色泽和质地劣变而使发酵香肠的品质降低、贮期缩短[1-2],因此控制脂肪氧化程度对于发酵香肠的生产至关重要。添加抗氧化剂是降低产品氧化变质的有效手段。量大价低、抗氧化效果好的合成抗氧化剂如丁基羟基茴香醚、二丁基羟基甲苯和特丁基对苯二酚等常被添加在产品中用来抑制脂肪的氧化[3]。然而,研究发现合成抗氧化剂存在一定的安全性和毒性问题,所以安全、无毒的天然抗氧化剂的开发应用引起了研究者们的广泛关注[4-6]。VE、VC、多酚类化合物、竹叶提取物及迷迭香提取物等被发现能够有效地抑制脂肪的氧化。但这些天然抗氧化剂因成本过高或影响食品的感官,在实际使用上存在着局限性。
研究发现,在发酵肉制品中添加具有抗氧化潜能的发酵剂是减缓脂肪氧化的有效方法[7]。乳酸菌是香肠发酵成熟过程中重要的发酵剂之一。乳酸菌通过发酵不仅可以快速产酸、抑制腐败菌和致病菌的生长繁殖,还能够赋予产品独特的风味、提高产品的营养价值,保证产品的品质与安全性[8]。大量研究表明,许多乳酸菌都具有抗氧化活性,但是不同菌株之间的抗氧化能力存在差异性,因此筛选具有高抗氧化活性的乳酸菌作为天然抗氧化剂提高发酵肉制品的抗氧化功能具有重要的实践意义[9]。乳酸菌在自然界广泛存在,而来源于传统发酵肉制品的乳酸菌更利于用作肉制品发酵剂。李默等[10]从金华火腿等5 种发酵肉制品中成功筛选到了1 株具有较高抗氧化活性的肉制品发酵剂希腊魏斯氏菌L23。郭慧芬等[11]通过体外体内抗氧化实验从6 种传统发酵肉类产品中分离筛选出1 株抗氧化活性较强的菌株X31,最终鉴定为戊糖片球菌。Chen Qian等[7]报道了分离自哈尔滨红肠的戊糖片球菌R1具有较高的抗氧化活性、超氧化物歧化酶(superoxide dismutase,SOD)活性和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,用该菌株接种生产香肠可以显著降低脂肪氧化程度。Chen Qian等[12]进一步研究发现,用该戊糖片球菌和弯曲乳杆菌、清酒乳杆菌、木糖葡萄球菌混菌发酵生产香肠可以延缓肌肉蛋白质氧化。相较于泡菜、酸奶等其他发酵食品,有关中国传统发酵肉制品中抗氧化乳酸菌的筛选与应用的报道较少。
本课题组前期从12 种传统发酵香肠中筛选到3 株符合肉品发酵剂要求的乳酸菌,即发酵乳杆菌GZ114、植物乳杆菌NJ107和KM119[13]。本研究拟以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、羟自由基清除能力、超氧阴离子自由基清除能力、Fe2+螯合能力、还原能力等体外抗氧化指标和SOD、GSH-Px和过氧化氢酶(catalase,CAT)等酶活力指标系统评价3 株乳酸菌发酵上清液、菌体细胞和破碎提取物的体外抗氧化活性,并通过对3 株菌的疏水能力、耐模拟胃肠液消化能力和耐胆盐能力检测初步评价其益生特性,以期为具有较高抗氧化活性的功能性肉制品发酵剂的开发与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum KM119,NCBI编号为MG798686)、发酵乳杆菌(L. fermentum GZ114,NCBI编号为MG798687)、植物乳杆菌 (L. plantarum NJ107,NCBI编号为MG798688)均为本实验室由传统发酵香肠中分离所得。
1.1.2 试剂
胃蛋白酶、胰蛋白酶、牛胆盐、8-苯胺-1-萘磺酸(分析纯)、DPPH(分析纯) 美国Sigma公司;菲啰嗪 上海阿拉丁生化科技股份有限公司;MSA固体培养基、MRS肉汤 青岛海博生物科技有限公司;SOD试剂盒、CAT试剂盒、GSH-Px试剂盒 南京建成生物工程研究所;其他常规试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
OptiMairTM垂直流超净工作台 新加坡艺思高科技有限公司;HVE-50自动高压灭菌 日本Hirayama公司; ICP260生化培养箱 德国Memmert公司;自动影像分析菌落计数仪 法国Interscience公司;Spectral Max M2e多功能酶标仪 美国伯腾仪器有限公司;HH-42快速恒温水浴箱 常州国华电器有限公司;SIM-F-124制冰机 日本Sanyo公司;WH-2微型涡旋混合仪 上海沪西分析仪厂有限公司;YP1201N电子天平 上海 精密科学仪器公司;PTF-A300型万分之一电子天平 瑞士Precisa公司。
1.3 方法
1.3.1 菌种培养及样品制备
菌种在MRS液体培养基中37 ℃静置培养18 h,传代3 次,取最后一次活化的菌液4 ℃、6 000×g离心10 min,分别收集上清液和菌体。上清液经0.22 μm的水系滤膜过滤,即为发酵上清液。菌体用超纯水洗涤3 次后重悬,并将菌体数调整为109CFU/mL,分为2 份。1 份菌液作为菌体细胞,另一份经冰浴超声破碎细胞(300 W,工作2 s,暂停2 s,共10 min),破碎液于4 ℃、10 000×g离心15 min,收集上清液,镜检无完整细胞,即为破碎提取物。
1.3.2 抗氧化活性测定
1.3.2.1 DPPH自由基清除能力测定
参考Maryam等[14]的方法,测定DPPH自由基清除活性。
1.3.2.2 羟自由基清除率测定
根据Chen Qian等[7]的方法,测定羟自由基清除率。
1.3.2.3 超氧阴离子自由基清除率测定
参考Das等[15]的方法,测定超氧阴离子自由基清除率。
1.3.2.4 还原力测定
根据李默等[10]的方法,测定还原力。
1.3.2.5 螯合Fe2+能力的测定
根据王刚等[16]的方法,测定Fe2+螯合率。
1.3.2.6 SOD、CAT、GSH-Px活力测定
采用试剂盒,按照说明书使用。
1.3.3 乳酸菌疏水能力测定
参考陈明等[17]的方法,活化好的菌种于MRS液体培养基中在37 ℃培养18 h,4 ℃、10 000×g离心1 min,用pH 6.2 0.1 mol/L的硝酸钾溶液洗涤2 次,重悬菌液,在600 nm波长处测定溶液吸光度,记为Ac。将菌悬液与二甲苯混匀(3∶1,V/V),室温孵育10 min,剧烈混匀2 min,室温静置分层,测定下层水相的吸光度,记为As,按式(1)计算乳酸菌的疏水能力:1.3.4 乳酸菌耐胃肠液能力测定
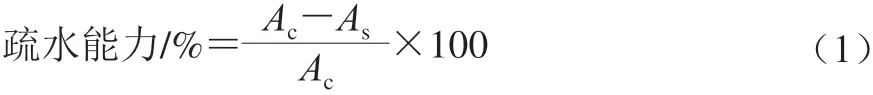
模拟胃肠液的配制参考陈明等[17]的方法,将活化好的菌液按10%接种到模拟胃液中,混匀后于37 ℃静置培养3 h,分别测定第0小时和第3小时培养液的活菌数。培养结束后,将培养液与模拟肠液按1∶9混合均匀,于37 ℃静置培养3 h,测定培养液的活菌数,存活率按式(2) 计算:

式中:Nc和Ns分别为培养前后的乳酸菌数/(CFU/mL)。
1.3.5 乳酸菌耐胆盐能力测定
参考刘宏宇等[18]的方法,将活化好的菌种按2%接种到MRS液体培养基中,37 ℃培养18 h,4 ℃、6 000×g离心10 min后收集菌体,洗涤,重悬于含5 mg/mL牛胆盐的MRS培养基中,于37 ℃培养4 h。分别在第0小时和第4小时进行活菌计数,存活率计算同1.3.4节。
1.4 数据分析
2 结果与分析
2.1 乳酸菌的抗氧化活性比较
2.1.1 DPPH自由基清除能力比较
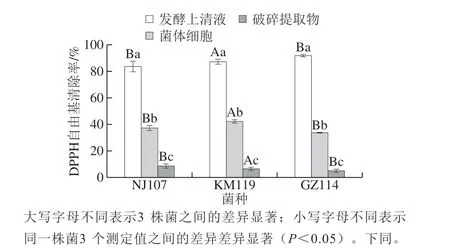
图1 乳酸菌对DPPH自由基的清除能力Fig. 1 DPPH radical scavenging ability of lactic acid bacteria
如图1所示,3 株菌各组分均表现出一定的DPPH自由基清除效果,但清除能力差异较大。发酵上清液的清除率显著高于其他2 个组分(P<0.05),其中GZ114的清除率最高,可达91.93%。菌体细胞组KM119的清除活性最强,相当于其发酵上清液活性的48%左右;GZ114的清除活性最弱,清除率仅为33.73%。而破碎提取物的清除活性较弱,活性最强的为NJ107,清除率分别比KM119和GZ114高2%和3%左右,但仅为其发酵上清液清除率的10%左右。李默等[10]研究发现,分离自发酵肉制品的30 株乳酸菌的菌体细胞和胞内提取物的DPPH自由基清除活性较弱,而发酵上清液的DPPH自由基清除活性可高达91.24%,与本实验结果一致。发酵上清液的DPPH自由基清除能力可能与菌株分泌的胞外多糖等胞外代谢产物有关,菌体细胞的清除能力则与菌体表面的化学物质如表面蛋白或多糖有关[19]。结果表明,3 株乳酸菌清除DPPH自由基的活性物质主要存在于胞外代谢产物中和菌体表面,细胞内则较少。
2.1.2 羟自由基清除能力的比较
羟自由基是具有强氧化性的自由基,会引起生物分子的氧化损伤。羟自由基清除剂的加入可猝灭体系中的羟自由基,生成Fe2+,引起体系吸光度的升高[20]。由图2可知,菌体细胞的羟自由基清除率均高于其他2 个组分,KM119清除活性最强,可达37.61%,与其他菌株间差异显著(P<0.05)。发酵上清液组活性次之,NJ107清除率最高,约为其菌体细胞活性的73%。破碎提取物组活性最弱,清除率均低于10%,该结果与郭慧芬等[11]的报道类似。王曦等[20]也报道35 株乳酸菌仅菌体细胞表现出一定羟自由基清除能力,无细胞提取物和胞外分泌物的清除活性较弱甚至为零。羟自由基造成的氧化损伤主要源自Fe2+和Cu2+等过渡金属离子存在时的芬顿反应,抗氧化剂可以通过螯合这些离子抑制羟自由基的产生。
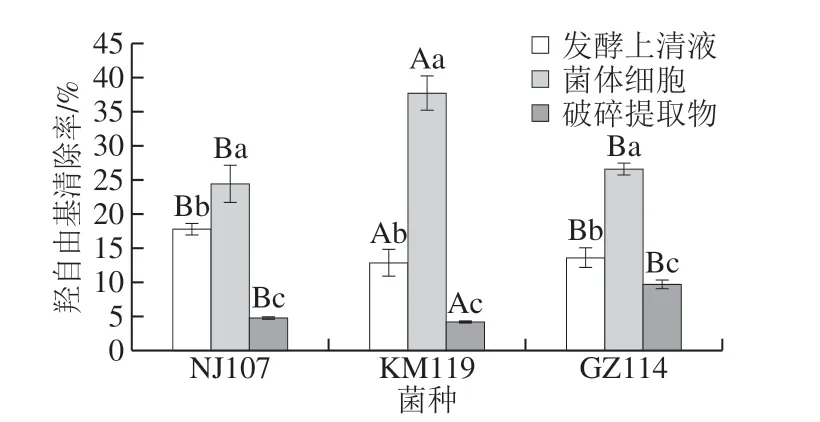
图2 乳酸菌对羟自由基的清除能力Fig. 2 Hydroxyl radical scavenging ability of lactic acid bacteria
2.1.3 超氧阴离子自由基清除能力的比较
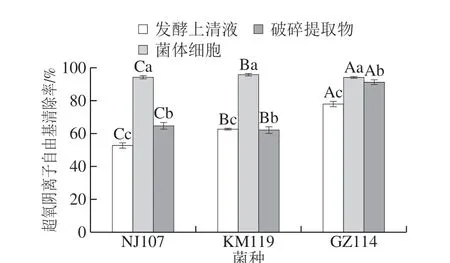
图3 乳酸菌对超氧阴离子自由基的清除能力Fig. 3 Supernatant cation radical scavenging ability of lactic acid bacteria
由图3可知,菌体细胞的超氧阴离子自由基清除活性最强,且各菌株活性较为接近,清除率在94%左右。破碎提取物组中GZ114的清除活性最强(91.2%),显著高于其他两菌株(P<0.05),与其发酵上清液能力相当。发酵上清液组NJ107的清除活性最弱,清除率仅为52.73%,但仍高于文献报道的清除率(36.38%)[21]。乳酸菌存在的抗氧化酶如SOD、GSH-Px和CAT及其他氧化酶类是清除超氧阴离子自由基的重要酶促防御系统[21]。3 株乳酸菌的各组分均具有良好的超氧阴离子自由基清除活性,说明乳酸菌的各个组分中均可能检测到抗氧化酶活性。
2.1.4 Fe2+螯合能力的比较
过渡金属离子会促进氧化损伤,而Fe2+是最典型的促氧化剂,若能被螯合则可以阻止脂质过氧化反应的启动。由图4可知,菌体细胞组Fe2+螯合活性最高,与其他2 个组分间差异显著(P<0.05),其中NJ107的Fe2+螯合率最高(77.13%)。发酵上清液组中GZ114活性最强,但仅相当于其菌体细胞活性的37.45%,KM119活性最弱(16%)。破碎提取物组中最高的为NJ107,其螯合率分别比KM119和GZ114高3%和11%左右。以上结果表明,3 株乳酸菌均具有良好的Fe2+螯合活性,菌株及组分间的差异可能是由于不同菌株螯合Fe2+的活性物质的种类、含量和分布不同引起的。Kai等[22]研究发现发酵乳杆菌ME-3和干酪乳杆菌KCTC 3260的抗氧化效果是通过螯合金属离子实现。由此可推断3 株乳酸菌可通过螯合金属离子提高抗氧化水平。
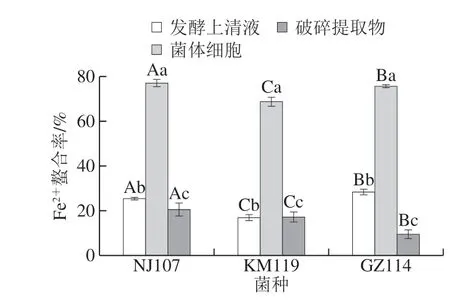
图4 乳酸菌对Fe2+螯合能力Fig. 4 Fe2+ chelating ability of lactic acid bacteria
2.1.5 还原力的比较
还原力主要是指通过酶(CAT、NADH氧化酶和NADH过氧化物酶等)和非酶复合物(VC、VE和GSH等)减少氧自由基和金属离子的能力[23-24],常作为评价抗氧化活性的重要指标。由图5可知,发酵上清液组的还原能力最强,菌株间差异不大,GZ114最高;菌体细胞组其次,约为上清液的60%~65%;破碎提取物组的还原能力最低,其中最高的GZ114也仅相当于其发酵上清液的25.56%。Chen Qian等[7]认为细胞表面蛋白质或多糖可作为还原化合物以减少氧化应激,由此可以推测具有还原活性的胞外分泌物和菌体表面物质可能是3 株乳酸菌表现还原力的主要原因,而破碎提取物的还原能力则可能来自于细胞内的抗氧化成分如NADH、NADPH、谷胱甘肽、尿酸及各类抗氧化酶等。
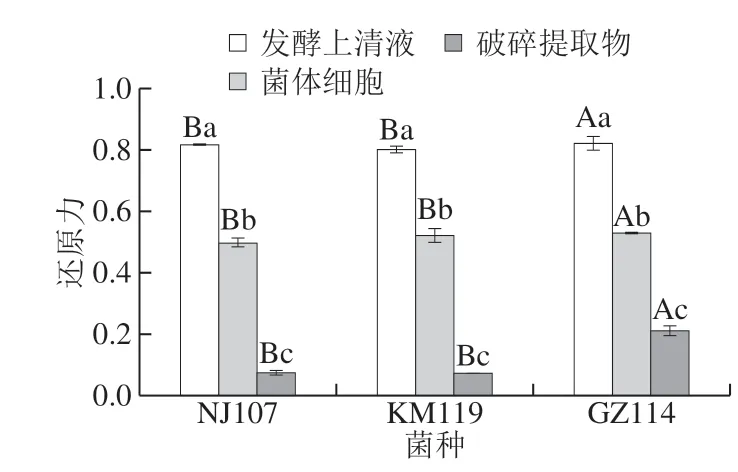
图5 乳酸菌的还原能力Fig. 5 Reducing power of lactic acid bacteria
2.1.6 酶活力比较
乳酸菌的酶促抗氧化防御系统被认为是抵御氧化损伤的一道重要屏障,其中抗氧化酶系统主要包括SOD、GSH-Px和CAT等[25]。本研究通过试剂盒测定法对3 株乳酸菌的SOD、GSH-Px和CAT抗氧化物酶水平进行了比较。
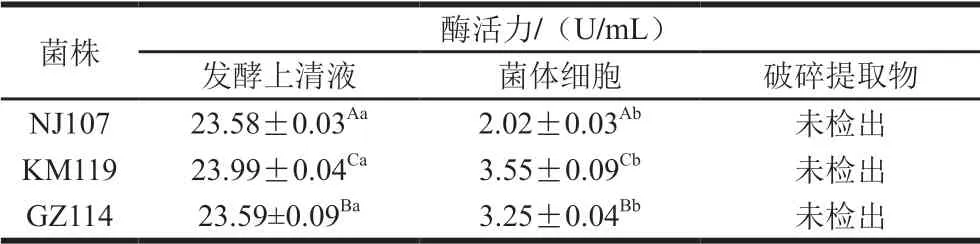
表1 乳酸菌的SOD活力Table 1 SOD activity of lactic acid bacteria
如表1所示,3 株菌发酵上清液中SOD活力为23 U/mL 左右,显著高于菌体细胞(P<0.05),破碎提取物未检出SOD活性。结果表明,3 株乳酸菌的SOD主要存在于胞外分泌物中,少部分附着于细胞表面。
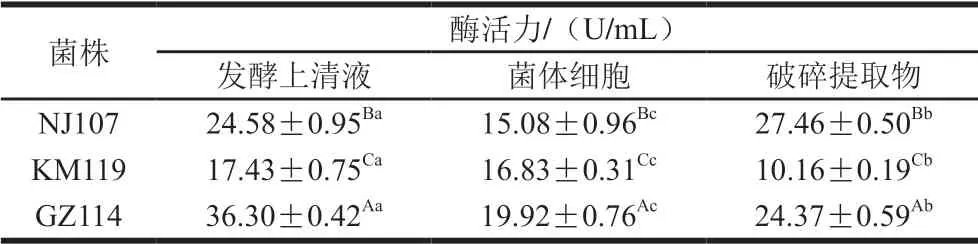
表2 乳酸菌的GSH-Px活力Table 2 GSH-Px activity of lactic acid bacteria
由表2可知,3 株菌各组分均有一定的GSH-Px活力,发酵上清液组的GSH-Px活力显著高于菌体细胞和破碎提取物。GZ114发酵上清液酶活力最高(36.30 U/mL), KM119破碎提取物酶活力最低(10.16 U/mL)。NJ107破碎提取物的酶活力达27.46 U/mL,高于其发酵上清液(P<0.05);KM119菌体细胞的酶活力为16.83 U/mL, 显著高于其破碎提取物(P<0.05)。以上结果表明,GSH-Px在不同乳酸菌菌株中的含量和分布不同。
由表3可知,菌株GZ114三组分的CAT活力较高,发酵上清液中活力最高(4.84 U/mL),与其余2 株菌差异显著(P<0.05);NJ107次之,其中菌体细胞的活力最高;KM119活力最弱,且菌体细胞中未检测出CAT。此外,CAT活力总体较弱,显著低于同组分的SOD和 GSH-Px活力(P<0.05)。
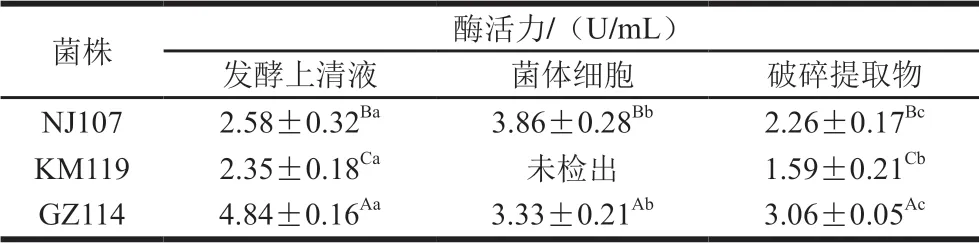
表3 乳酸菌的CAT活力Table 3 CAT activities of lactic acid bacteria
SOD具有清除超氧阴离子自由基的能力,GSH-Px和CAT则能够清除过氧化物和羟自由基。结合图2、3可知,3 株乳酸菌的羟自由基清除率与GSH-Px和CAT含量不呈正比,超氧阴离子自由基清除活性与SOD活力也不呈正相关,说明除了抗氧化酶类,3 株乳酸菌还含有其他可以清除羟自由基和超氧阴离子自由基的活性物质[26-28]。以上结果表明,3 株乳酸菌的抗氧化活性是抗氧化酶和其他非酶抗氧化物质共同作用的结果。
2.2 乳酸菌的疏水能力
能够黏附于宿主细胞的表面是乳酸菌定植于肠道中发挥益生作用的前提,而菌体表面的疏水性与黏附能力有一定的相关性,因此菌体表面疏水性常常被用来评价乳酸菌的黏附性能[29]。如图6所示,NJ107的疏水能力最强(13.45%),显著高于其余2 株乳酸菌(P<0.05)。KM119的疏水能力次之,为8.85%,GZ114的疏水能力最差,仅为6.34%。结果表明,菌种不同疏水性有差异,即使菌种相同,在菌株水平上,疏水性也具有差异性,这一结论与占萌等[29]和Murphy[30]的研究一致。研究表明,细菌的表面疏水性与细菌的非特异性黏附密切相关[31-32],疏水性高的乳酸菌可与消化道上皮细胞间形成较强的相互作用力,有益于细菌附着。李清等[33]分析了10 株植物乳杆菌的表面疏水性,证实疏水性与细胞黏附能力呈正相关。由此推测NJ107可能具有较好的黏附能力,有助于其益生功能的发挥。
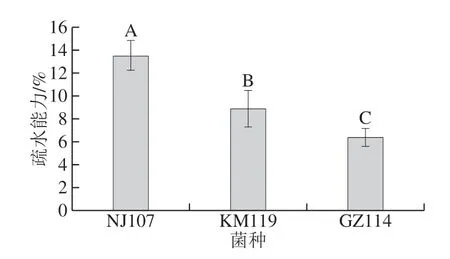
图6 乳酸菌的疏水能力Fig. 6 Hydrophobic ability of lactic acid bacteria
2.3 乳酸菌耐胃肠道消化能力
乳酸菌只有具备良好的耐胃肠道消化能力,保持较高的存活率才能发挥其益生功能。如表4所示,3 株菌均具有良好的耐消化能力。其中,在模拟胃液(pH 3.0)中消化3 h后,3 株乳酸菌的存活率均在87%以上,NJ107存活率最高,为89.17%,与其他2 株菌差异不显著 (P>0.05)。继续在模拟肠液中消化3 h,NJ107仍可保持75.79%的存活率,GZ114次之,均显著高于KM119的存活率(P<0.05)。Han Qi等[34]发现植物乳杆菌对人体消化液有良好的耐受能力,与本实验结果类似。总体而言,经模拟胃肠液消化后菌株存活率高低依次为NJ107、GZ114、KM119,且3 株菌的存活率均在70%以上,说明3 株菌对模拟胃肠液都有较好的耐受性。
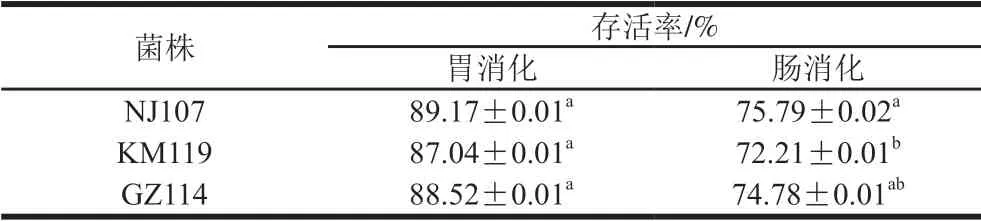
表4 乳酸菌在模拟胃肠液中消化后的存活率Table 4 Survival rates of lactic acid bacteria after digestion in simulated gastrointestinal
2.4 乳酸菌耐胆盐能力
肠液的主要成分为胰液和胆汁,因此益生菌要在人体肠道内发挥作用,除要具有良好的耐胃肠道酶系消化能力外,还应具有一定的胆盐耐受能力。胆盐在肠道中质量浓度一般为0.3~3 mg/mL,本实验设计了5 mg/mL的高胆盐质量浓度比较3 株菌对胆盐的耐受能力。由表5可知,在5 mg/mL的高胆盐环境中培养4 h后,KM119的存活率高达91.45%,显著高于其他2 株菌(P<0.05),NJ107和GZ114的耐胆盐能力相对稍低,4 h后的存活率在76%左右。刘宏宇等[18]研究发现乳酸菌对5 mg/mL胆盐的耐受能力较差,与本研究结果不同,这可能与菌种差异或菌株来源有关。结果表明,3 株菌均具有良好的耐胆盐能力,具备作为功能性发酵剂开发利用的潜力。
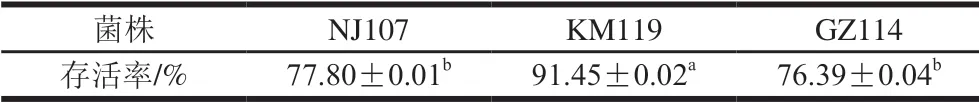
表5 乳酸菌的胆盐耐受能力Table 5 Bile salt tolerance capacities of lactic acid bacteria
3 结 论
本实验比较了分离自传统发酵香肠、具有良好发酵特性的3 株乳酸菌的抗氧化活性、表面疏水性、耐胃肠道消化能力和耐胆盐能力。结果表明,3 株菌均具有良好的体外抗氧化活性,但不同的抗氧化指标测得的菌株间和各组分间的抗氧化活性差异较大,这可能与抗氧化反应机制及菌株中抗氧化活性物质的分布、种类、浓度不同有关。综合而言,3 株菌的发酵上清液和菌体细胞的抗氧化活性明显高于破碎提取物,为今后3 株乳酸菌作为天然抗氧化剂的应用提供了参考依据。菌株表面疏水性高低依次为NJ107>GZ114>KM119,3 株菌在模拟胃肠道酶系消化、0.5%高浓度胆盐环境下均能保持较高的存活率。因此,3 株乳酸菌均可作为高抗氧化活性的功能性肉品发酵剂用于实际生产或益生性产品的进一步研究。
