鳗鱼骨胶原肽钙螯合物的制备及其稳定性和Caco-2吸收特性
2020-12-29钱跃威徐瀚麟吕奇晏陈智超
钱跃威,徐瀚麟,吕奇晏,陈智超,滕 慧,陈 雷
(福建农林大学食品科学学院,福建 福州 350002)
钙是与骨骼健康、血液凝结、神经传导和肌肉收缩相关的重要微量营养元素,占体质量的1.5%~2.2%[1-2]。钙缺乏会引起骨质疏松症,甚至导致高血压、肾结石和结肠癌等疾病[3]。这些缺陷可以通过摄入一些营养补充品缓解,例如牛奶、大豆分离蛋白、骨头等[4]。于是市场上出现第1代钙补充剂无机钙,包括氯化钙和碳酸钙,长期以来一直是人体的钙补充剂。然而该类补充剂钙含量较高,容易被胃酸吸收和消耗较多,未消化的部分容易留在肾脏中,导致造成肾结石或直接排泄,从而吸收率低[5]。第2代是有机酸钙,例如乳酸钙、乙酸钙和葡萄糖酸钙等,它们以离子钙形式存在,吸收过程中的影响因素很多,并且有一定的毒性和副作用,例如乙酸钙的急性毒性(半数致死量LD50<5 g/kg),同时可能导致肾结石、心脏痉挛和死亡、血管钙化和软组织钙化[6]。氨基酸螯合钙中的钙元素嵌合在各氨基酸分子之间,不会与食物中的植酸、草酸、胃酸和碱性物质发生反应,从而影响人体吸收。氨基酸螯合的钙直接通过肠黏膜吸收,可增加其生物利用度[7]。然而,过量摄入氨基酸会导致体内负氮平衡,从而影响人体的生理功能并导致各种不良后果[8]。与氨基酸相比,Plastein反应提供了一种可能的方法,以合成具有所需生物利用度,安全性和功能特性的多功能肽基成分[9]。肽螯合钙具有较高的溶解度,在弱碱性环境中胃肠道pH值为7.2时具有良好的稳定性,可以有效地转运钙离子并通过肠上皮细胞进行吸收和利用,且吸收不易受食品成分的影响进而增加了钙的生物利用效率[10]。因此,肽钙螯合物可能更适合于膳食钙补充剂,以增强钙的元素在人体中的消化吸收。
近年来,大多数研究人员致力于生产食物蛋白衍生的钙结合肽,这些肽可以形成可溶性肽钙复合物并促进钙的利用。目前,许多研究已从高蛋白植物、水生生物和植物中发现并鉴定了几种具有钙结合能力的肽,包括金耳木耳蛋白水解物[11]、脱盐鸭蛋清肽[12]、磷酸肽[13]和章鱼[14]等研究。肽的钙结合活性取决于蛋白酶的类型、蛋白水解程度、肽分子质量、氨基酸组成和特定氨基酸的含量[15]。此外,某些合成工艺的条件也会影响肽螯合钙的活性,例如肽与钙质量比、pH值和温度。
欧洲鳗鱼骨约占活鳗鱼质量的10%,是鳗鱼生产中的主要副产品[16]。有报道表明源自鱼骨的肽对钙螯合能力较高[17],并可以改善钙的吸收和生物活性[18]。鳗鱼骨因其低成本、高蛋白含量、高无机盐和高可用性而有望成为钙结合肽的良好来源。目前,鳗鱼骨肽的生物活性鲜见报道。鱼骨是鳗鱼加工的副产品,具有很高的营养价值和利用价值,但现仅用于制造低附加值的产品,例如骨胶、动物饲料或手工艺品。因此,本研究的主要目的是从鳗鱼骨蛋白中优化钙结合肽,并评估针对水溶性钙的体外结合特性。该发现对于利用鳗鱼骨中的肽作为功能性补品中的生物活性肽成分将有很大帮助。
1 材料与方法
1.1 材料与试剂
福建农林大学(福州)当地市场的欧洲鳗鱼(安圭拉鳗鱼)骨,在-20 ℃保存直至使用。
胃蛋白酶(≥250 U/mg)、胰蛋白酶(≥250 U/mg)、 碱性蛋白酶(alkaline phosphatase,AKP)活性检测试剂盒 北京索拉宝生物科技有限公司;胰凝乳蛋白酶(≥800 U/mg) 上海麦克林生物化学技术有限公司。其他化学药品和试剂均为分析纯。蛋白酶活性(U)的一个单位定义为在40 ℃可从指定浓度释放1 μg酪氨酸的酶量。
1.2 仪器与设备
200SXV红外分光光度计 美国Thermo-Nicolet 公司;RF-5301荧光光谱仪、AA6300C原子吸收分光光 度计 日本Shimadzu公司;Nova NanoSEM 230扫描电子显微镜 捷克Fei Czech Republic S.R.O.公司。
1.3 方法
1.3.1 鳗鱼骨酶解
将准备好的骨头浸入5 g/100 mL NaOH溶液中1 h以去除附着的鱼肉,其鱼骨与5 g/100 mL NaOH溶液之比为1∶2(g/mL),残留物用冷蒸馏水反复洗涤。将处理过的骨头在60 ℃干燥6 h,然后粉碎成粉末。将底物鳗鱼骨粉与蒸馏水按1∶8(g/mL)的比例混合,将混合物先用胃蛋白酶(37 ℃、pH 2.0)水解2 h,然后同时用胰蛋白酶(37 ℃、pH 7.0)和胰凝乳蛋白酶(37 ℃、pH 7.0)水解2 h,剂量为8 000 U/g(粉末质量计)。水解后,将混合物在100 ℃加热10 min以灭活酶。随后,将混合物在4 ℃以7 830 r/min离心15 min,并收集上清液用于分析水解度、肽产率和钙结合能力。冻干后,获得欧洲鳗鱼骨胶原肽(european eel bone collagen peptide,EBCP)。
1.3.2 从欧洲鳗鱼骨中制备钙结合肽
将EBCP溶解于去离子水中(5 mg/mL),然后以不同的质量比(1∶2~5∶1)添加CaCl2。将混合物在水浴中于不同温度(30~110 ℃)和pH 4.5~9.5孵化20~180 min。螯合反应后,将无水乙醇(溶液体积的9 倍)添加到混合溶液中,以分离出螯合物。将混合物在4 ℃、7 830 r/min离心30 min,收集沉淀物,冻干即为钙结合鳗鱼骨胶原蛋白肽(european eel bone collagen peptide-calcium,EBCP-Ca)。
1.3.3 EBCP-Ca结构表征
1.3.3.1 荧光光谱分析
将0.05 mg/mL的EBCP溶解在适量的蒸馏水中,然后添加0、0.6、1.2、1.8、2.4 mg/mL和3.0 mg/mL的CaCl2,使EBCP通过与钙离子反应成为螯合物EBCP-Ca。 在室温下,使用10 mm石英比色杯确定样品的荧光光谱。荧光光谱条件如下:激发波长为280 nm,发射波长为320~450 nm,激发和发射缝隙宽度分别为10 nm和15 nm,采样间隔为1 nm。
1.3.3.2 傅里叶变换红外光谱(Fourier transform infrared,FTIR)分析
EBCP-Ca的二级结构在室温下进一步用红外分光光度计表征,其波数范围为4 000~400 cm-1。样品制备步骤如下:将1 mg EBCP或EBCP-Ca复合物与100 mg干燥KBr混合,研成细粉,用于制备透明KBr片剂。
1.3.3.3 扫描电子显微镜(scanning electron microscope,SEM)分析
将EBCP和EBCP-Ca粉末的微结构喷涂并镀金,SEM在15 kV的加速电压下观察样品。
1.3.4 EBCP-Ca的稳定性
EBCP-Ca对温度、pH值和体外模拟消化的稳定性基于Wu Wenmin等[19]的方法并略作修改。将冻干的EBCP-Ca 溶解在去离子水中至终质量浓度为5 mg/mL,并将该溶液在不同温度(30~110 ℃)加热1 h。此外,溶液还应在环境温度和pH 2~12条件下孵育1 h。孵育后,用原子吸收分光光度计测定溶液中的钙离子含量。
模拟胃消化阶段:将去离子水中的模拟胃液调节为pH 2.0,其中包括2 mg/mL NaCl、12 mmol/L HCl和3.2 mg/mL猪胃蛋白酶。将5.0 mg/mL EBCP-Ca与模拟胃液以1∶1的质量比混合,然后调节至pH 2.0,并在37 ℃的恒温下以100 r/min的转速连续搅拌2 h,以模拟胃的消化,取上清液并用原子吸收分光光度计测定。
模拟小肠消化阶段:事先准备模拟肠液,包含盐溶液(110.1 mg CaCl2和328.05 mg/mL NaCl在3.0 mL去离子水中,pH 7.0)、胆汁盐溶液(375.0 mg溶解于7.0 mL去离子水,pH 7.0)和酶溶液(120.0 mg脂肪酶在5.0 mL去离子水中,pH 7.0)。在胃消化结束时,将先前溶液的pH值(60.0 mL)升高至7.0,并将制备的模拟肠液添加至先前溶液,以使脂肪酶和5.0 mg/mL胆汁盐的最终质量浓度为1.6 mg/mL。将混合物的pH值调节至7.0,然后在37 ℃、100 r/min连续摇动培养2 h,收集并在冰水浴中冷却,并在4 ℃、15 000 r/min离心30 min,取上清液并用原子吸收分光光度计测定。其中稳定性实验中以EBCP-Ca未经过处理的钙保留率为对照。钙保留率计算如式(1)所示:
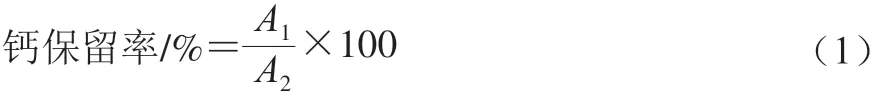
式中:A1为添加消化液的钙含量/mg;A2为不添加消化液的钙含量/mg。
1.3.5 EBCP-Ca对Caco-2细胞的细胞毒性
根据Zou Yaqun等[20]的方法,将Caco-2细胞以1×104个细胞/孔的密度接种在胶原蛋白包被的96 孔板中,将其在37 ℃的恒温CO2培养箱中孵育24 h。除去培养基后,将200 μL不同浓度的样品添加到每个孔中,并为每个样品准备8~10 个平行孔。在37 ℃ CO2培养箱中孵育20 h后,向每个孔中添加20 μL MTT(5 mg/mL),温育4 h后,通过离心除去沉淀物。然后,向每个孔中加入150 μL DMSO,并以低速摇动细胞培养板10 min。用酶标仪在490 nm波长处测吸光度。细胞存活率计算 如式(2)所示:
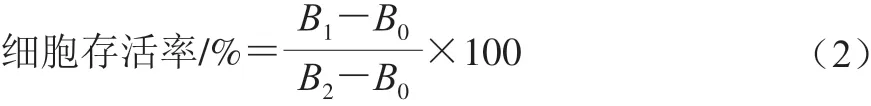
式中:B0为没有细胞的吸光度;B1为添加样品的吸光度;B2为不加样品的吸光度。
1.3.6 Caco-2细胞中的钙吸收测定
钙吸收实验基于Wu Haohao[21]和Makhov[22]等的方法修改。在体外构建了肠道细胞模型,并进行修改。将细胞以1×105个细胞/孔的密度接种在12 孔板中。在前1 周每隔1 d更换一次培养基,并在第2周每天更换一次培养基。培养21 d后,获得体外肠细胞模型。去除Caco-2细胞培养基,用无钙HBSS(Hank’s balanced salt solution)洗净2 次,并在37 ℃预热10 min,去除HBSS,加入不同浓度样品,在培养箱中培养不同时间。反应后,在4 ℃用HBSS洗涤2 次以除去残留的提取液,加入500 μL的体积分数0.1% Triton X-100细胞裂解液,反复冷冻和融化以裂解细胞,然后超声处理10 min,得到细胞悬液。一部分用BCA(bicinchoninic acid)蛋白浓度试剂盒测量总蛋白质量浓度(g/L),从细胞悬液中取出另一部分,15 000 r/min离心10 min,通过原子吸收分光光度计确定溶液中的钙离子含量和AKP活性检测试剂盒确定AKP活性。实验中对照组为只加入培养基的细胞培养,CaCl2组为加入4 mg/mL CaCl2溶液的细胞培养,模型组为加入无钙HBSS的细胞培养。细胞摄取率计算如下:
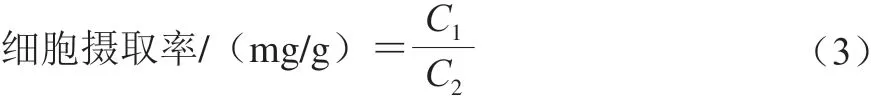
式中:C1为细胞内的钙离子质量浓度/(mg/L);C2为细胞总蛋白质量浓度/(g/L)。
1.4 统计分析
2 结果与分析
2.1 不同蛋白酶工艺对欧洲鳗鱼骨水解的影响
人体摄入食物中的蛋白质在胃液消化酶的作用下,初步水解,在小肠中完成整个消化吸收过程,而人体消化蛋白系统主要是由胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶作用在蛋白质的肽键上,分解为肽或氨基酸。 表1为单酶处理和包含2 种或3 种酶的组合处理的比较。在三酶处理中,鱼骨粉与蒸馏水料液比1∶8(g/mL)、酶剂量8 000 U/g。双酶同时水解(同时添加胰蛋白酶和胰凝乳蛋白酶)中两种酶的添加比例为1∶1(酶活性比),双酶同时水解中2 种酶的水解时间比例为1∶1(首先用胃蛋白酶水解底物,然后用胰蛋白酶或胰凝乳蛋白酶水解,或者3 种酶同时进行水解),发现3 种酶的协同作用显著改善了由单酶或双酶产生肽的钙结合能力,肽的最佳钙螯合率为35.78%。此外,3 种酶协同作用后蛋白质的肽键逐渐断裂,分解成肽和氨基酸,导致水解物的水解度和肽产量显著提高(P<0.05)。研究最佳水解条件如下:鱼骨粉与蒸馏水料液比为1∶8(g/mL),酶剂量为24 000 U/g (胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶均为8 000 U/g),分别在37 ℃和不同pH值环境下放置4 h。
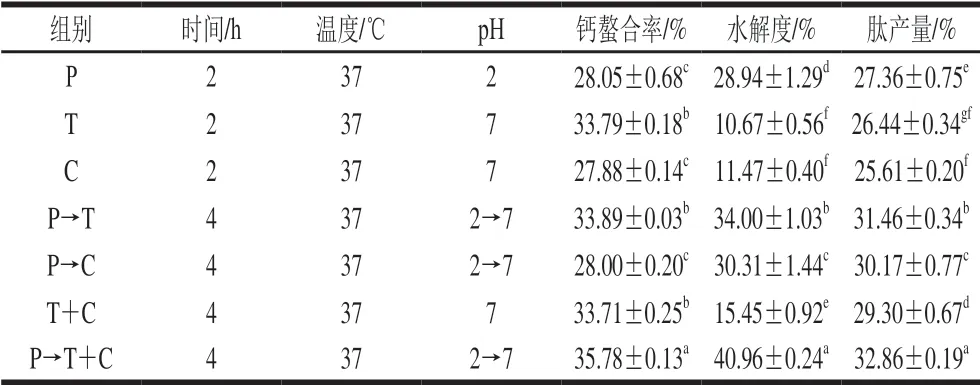
表1 3 种蛋白酶相互作用的比较Table 1 Comparison of three single proteases and their combinations used for eel bone hydrolysis
2.2 工艺条件对EBCP-Ca螯合率的影响
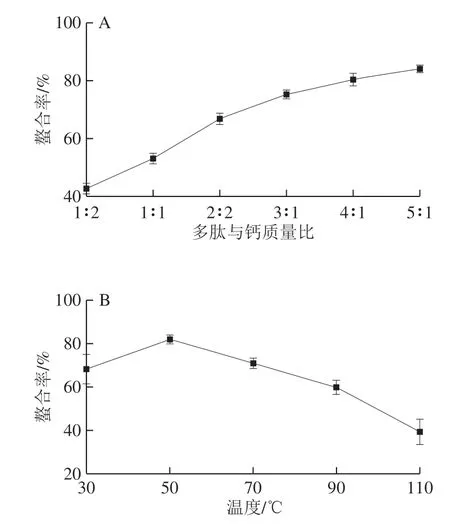
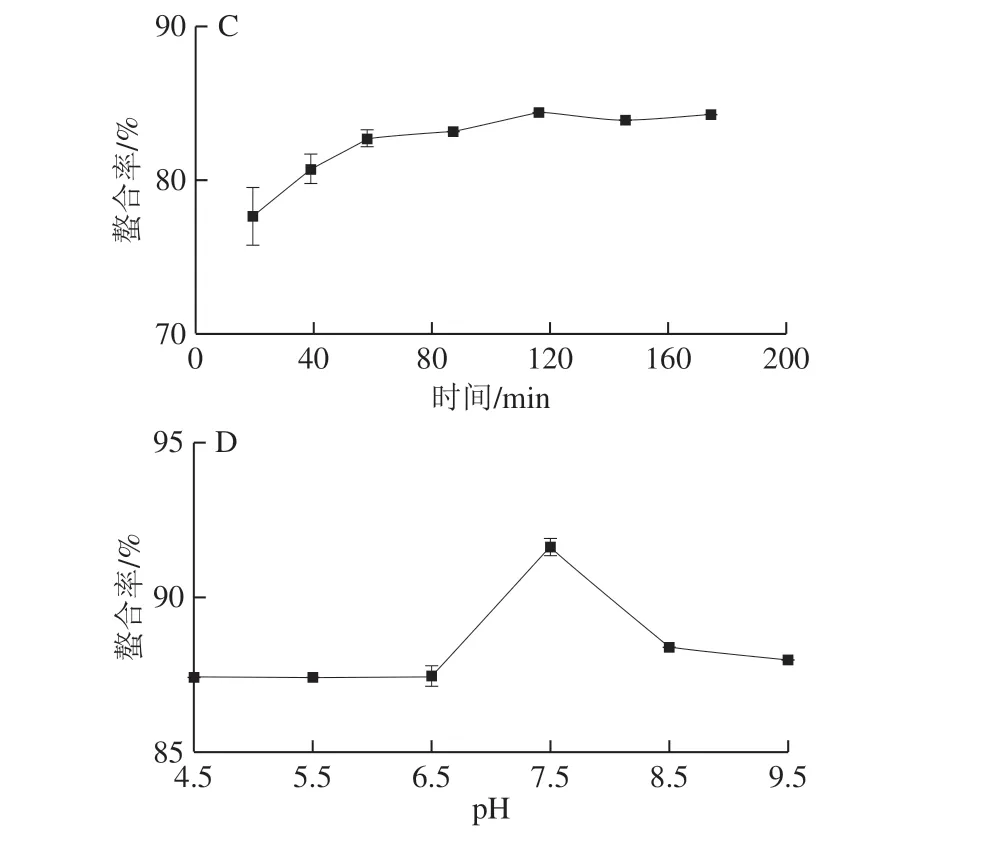
图1 多肽与钙质量比(A)、温度(B)、时间(C)和pH值(D)对钙结合能力的影响Fig. 1 Effects of mass ratio of peptide to calcium (A), temperature (B), times (C) and pH (D) on calcium-binding capacity
钙结合能力随质量比的不同而变化(图1A)。当多肽与钙质量比从1∶2增加到5∶1时,钙结合能力从42.65%显著增加到84.01%(P<0.05)。图1B表明,随着温度的升高,钙的螯合速率逐渐增加,当反应温度为50 ℃时,结合能力最高,再随着温度的升高,螯合物的结构稳定性变差,与钙离子的结合能力逐渐变低。当螯合时间从20 min延长到60 min时,螯合率从77.63%增加到82.71%(图1C),并且随着时间延长到180 min无显著差异(P>0.05),这表明肽与钙的螯合反应快,类似于乳清太平洋鳕鱼与钙的结合[23]。当pH值从4.5增加到7.5时,钙结合能力逐渐增加,并且在pH 7.5时达到最大值 (图1D)。这可能是由于pH值和OH-的增加,而H+和OH-达到了一定的平衡,从而增强了钙离子和NH4+, —OH和—COOH之间的配位作用[24]。
2.3 荧光光谱测定结果
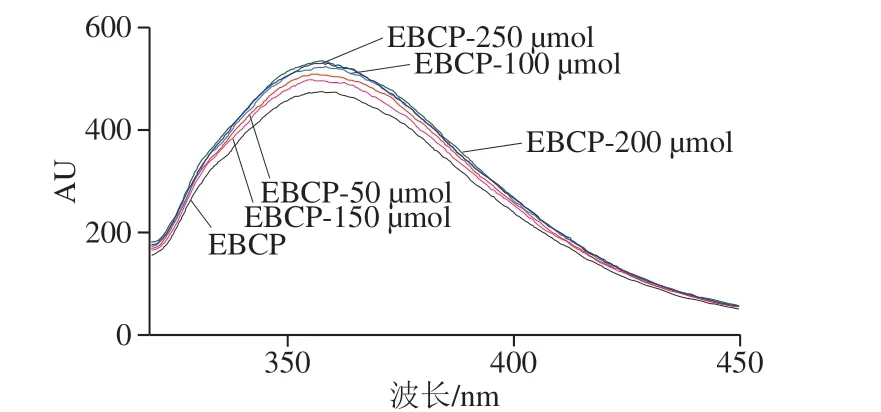
图2 EBCP和EBCP-Ca的荧光光谱Fig. 2 Fluorescence spectra of EBCP and EBCP-Ca
芳香氨基酸,例如苯丙氨酸和色氨酸可以在特定的激发波长下产生内源性荧光。因此,波长和荧光强度的变化可有效反映有机配体基团与金属离子之间的相互作用(图2)。随着CaCl2质量浓度的增加,在约310 nm波长处的荧光强度先增加然后减少。荧光强度在约360 nm波长处显著增加,吸收峰从356 nm移至360 nm,结果表明钙离子可能与芳香族氨基酸螯合,导致荧光变化。但添加150 μmol钙离子以上出现荧光降低,而Cai Xixi等[25]报道了相同的结果,即特定二肽(Phe-Tyr)的内源荧光强度随着钙离子浓度的增加而降低(荧光猝灭),结果表明钙离子的添加 引起鳗鱼多肽的折叠和结构变化,反应产生了EBCP-Ca。另一个可能的解释是鳗鱼骨多肽中的发色团与钙离子反应,从而改变了激发态的能量并导致荧光强度降低[26]。
2.4 FTIR测定结果
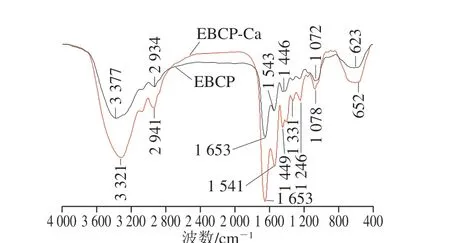
图3 EBCP和EBCP-Ca的FTIR Fig. 3 FTIR spectra of EBCP and EBCP-Ca
FTIR可以有效地区分两种物质之间的结构差异,光谱中酰胺和羧酸盐吸收峰的变化可以反映光谱的坐标[27]。EBCP和EBCP-Ca复合物的FTIR如图3所示。波数3 377.29 cm-1吸收归因于N—H胶原肽的拉伸振动。螯合反应后,能带移至3 332.36 cm-1,表示肽中的电子云密度由于诱导效应或偶极场效应而变得更强,表明 —NH参与了螯合物的形成[28]。1 652.96 cm-1处的吸收带对应于与钙螯合后不移动的肽中的酰胺I带,表明C=O不参与钙的共价键合反应。1 446.58 cm-1和1 419.58 cm-1处的COO—谱带转移至1 448.51 cm-1和1 406.08 cm-1处,表明—COOH可能与钙结合,并且这种类型的螯合剂可能是由于未结合的自由电子所致[29]。将1 249.85 cm-1和1 151.48 cm-1的条带转移到1 245.99 cm-1和1 159.20 cm-1, 它们属于酰胺III,代表C—N的拉伸振动和N—H的弯曲振动。它主要来自甘氨酸和脯氨酸中的—CH2与钙离子的结合[25]。另外,肽钙螯合物在623.00 cm-1具有一个新的吸收峰,这在肽谱中不存在。很多研究表明,氨基酸残基的羧基是金属离子的主要结合位点。据Bao Xiaolan等[30]报道,大豆蛋白水解物中钙的结合水平随羧基含量的增加而线性增加。这些结果证实钙离子主要结合从鳗鱼骨中提取的水解产物肽中的羧基氧原子和氨基氮原子部位。
2.5 SEM结果
SEM是透射电子显微镜和光学显微镜之间的微观形态观察方法,可以直接利用样品表面材料的材料特性进行显微成像。图4A、B分别显示了EBCP和EBCP-Ca复合物的表面形态。EBCP显示出整体的外观和粗糙的表面(图4A)。相比之下,EBCP-Ca表现出致密的颗粒状结构,并且大小分布密集,这与EBCP的外观明显不同 (图4B)。金属离子可以与肽相互作用,并且对肽螯合物有明显的作用[31]。因此,钙离子可以通过加速肽的二聚化和稳定所得的二聚体促进聚集。分子间力、表面张力和各向同性力的影响可能有助于聚集过程,而肽链中的巯基、羧基和氨基则通过水溶液中的分子间氢键形成“盐桥”,从而改变了EBCP的性能[32]。此外,就脱水而言,肽链的氨基酸可与锌离子结合形成环状结构;此后,添加到EBCP的钙离子屏蔽了多肽链上的负电荷,形成了“盐桥”并诱导蛋白质聚集[33]。形态分析结果表明,EBCP与钙离子之间的强相互作用导致形成更紧密的连接颗粒。

图4 EBCP和EBCP-Ca的SEMFig. 4 SEM images of EBCP and EBCP-Ca
2.6 EBCP-Ca的稳定性
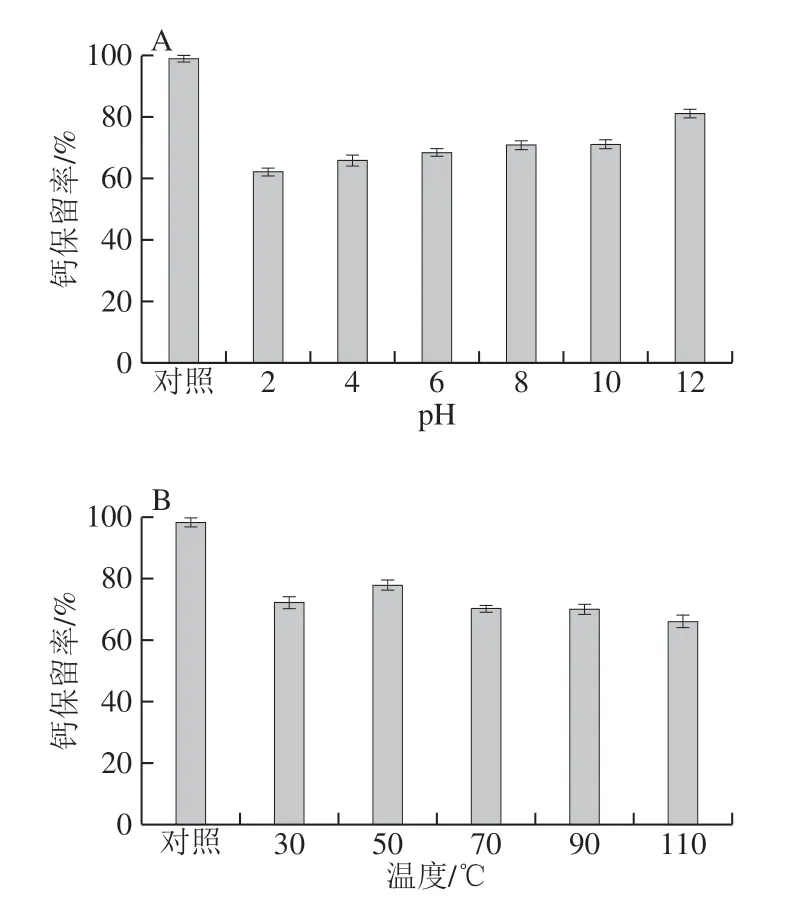
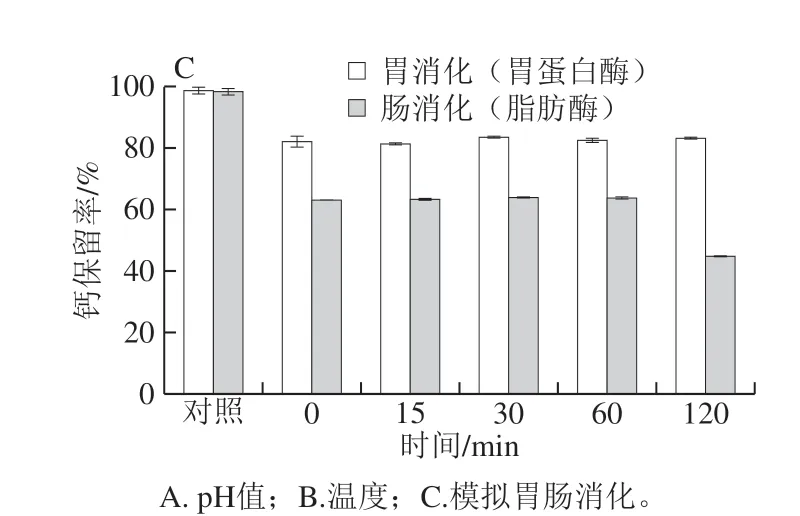
图5 EBCP-Ca的稳定性 Fig. 5 Stability of EBCP-Ca
EBCP-Ca 在特殊pH 值和温度下的稳定性如图5A、B所示。在图5A中,5 mg/mL EBCP-Ca处于不同pH值(2~12)溶液后,EBCP-Ca钙保留率从对照组(99.08±0.92)%降低至(61.86±0.22)%。在强酸性条件下,钙保留率明显降低(P<0.05)。据推测,高H+浓度可在酸性条件下与钙离子竞争活性结合基团,从而促进肽钙螯合物的解离,该发现与在酸性条件下较低的螯合速率一致;当pH值偏向碱性时,大量的H+减少而大量的OH-增加,不会与金属离子竞争活性结合基团。在图5B中,随着温度的升高,EBCP-Ca的钙保留率略有下降,并且都保持在78%以上,不同组之间存在不显著差异(P>0.05),这表明螯合剂对热处理具有一定的 抵抗力。
人类饮食中的营养通常通过胃肠消化吸收到肠道,但是蛋白质可能会被胃蛋白酶和脂肪酶等水解酶水解,形成较小的肽或氨基酸,并且该肽的生物学活性可能会完全改变。因此,生物活性物质在体外模拟胃和小肠环境的耐受性可用于评估其消化稳定性。EBCP-Ca在胃肠环境中的钙保留率如图5C所示。与模拟胃液水解0 h(pH 2,不添加胃蛋白酶)相比,添加胃蛋白酶时钙保留率保持在82%左右,延长的消化时间对钙保留率没有显著影响(P>0.05)。结果表明,模拟的胃液对螯合物的稳定性影响很小,但对pH值敏感,并且在酸性条件下可使部分不稳定的结合钙解离成离子态。据报道,小分子质量的肽对胃蛋白酶水解的敏感性降低[34]。胃消化后,将先前的胃液与模拟肠液相结合进行二次消化。与0 h(pH 7.0、不添加脂肪酶)的模拟肠液相比,由于添加脂肪酶和随着消化时间的延长,钙保留率逐渐降低至(44.78±0.29)%,与对照组相比呈显著差异 (P<0.05)。可能胃消化环境导致EBCP-Ca某些结构变化,从而影响其结合钙离子的能力,此外,胰腺的存在可能导致肽结合能力下降。研究肽螯合钙在人胃肠道中的环境稳定性,因为钙离子可能与植酸形成沉淀反应,并将结合的钙转变为胃液中的游离钙,从而导致钙生物利用度下降[35]。
2.7 EBCP-Ca对Caco-2细胞的细胞毒性
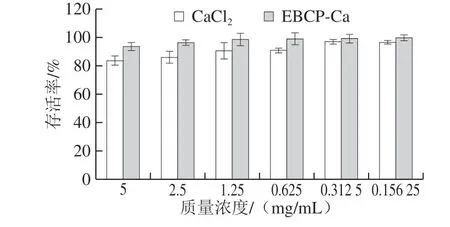
图6 EBCP-Ca细胞毒性Fig. 6 Cytotoxicity of EBCP-Ca
如图6所示,0.156 25、0.312 5、0.625、1.25、2.5、5 mg/mL的EBCP-Ca作用于Caco-2细胞中没有显示出明显的细胞毒性,且细胞存活率都在93%以上。当CaCl2质量浓度为0.312 5 mg/mL或更低质量浓度时,在Caco-2细胞中未表现出明显的细胞毒性,但当质量浓度为0.625 mg/mL以上时,则逐渐降低了Caco-2细胞的活力(P<0.05),随着加入量越大,对Caco-2细胞的存活率也就越低。
2.8 Caco-2细胞中AKP活性和钙摄取率分析
检测每组Caco-2细胞的AKP活性(图7A、B)。经过培养箱中孵育后,细胞AKP活性会急剧下降,这表明空白组削弱了Caco-2细胞的活性,而Caco-2细胞的活性通常是物质吸收和运输的主要原因。与对照组相比,在培养箱中培养4 h后,模型组中Caco-2细胞的AKP活性显著降低(P<0.05)。然而,暴露于不同培育时间和EBCP-Ca质量浓度的Caco-2细胞的AKP活性仍不低于正常组。钙对照组的细胞与模型组有显著差异(P<0.05)。不同培养时间EBCP-Ca组对Caco-2细胞的AKP活性为(17.67±0.21)、(35.24±0.90)、(3 9.5 0±1.1 7)U/g 和(4 3.4 3±0.6 6)U/g, 而CaCl2组的AKP活性仅为(16.53±0.19)U/g,与对照组((18.06±1.07)U/g)相比没有显著差异 (P>0.05),这表明钙对照组对Caco-2细胞的AKP活性没有积极作用。相反,添加EBCP-Ca可以有效提高小肠细胞中AKP的活性水平,进而维持小肠形成的活性,这有助于人类小肠消化吸收食物并增加AKP活性[36]。
研究Caco-2细胞培养中加入不同质量浓度EBCP-Ca组对细胞吸收钙质量浓度影响(图7C)和加入3 mg/mL EBCP-Ca在培养不同时间后细胞吸收钙质量浓度的变化(图7D),在培养箱中培养后,模型组中Caco-2细胞的钙质量浓度显著降低(P<0.05)。在图7C中,第2小时和第4小时实验组的钙质量浓度超过正常水平((0.42±0.00)mg/mL),分别达到(0.76±0.05)mg/mL 和(0.91±0.01)mg/mL,补充EBCP-Ca可以减少钙的时间依赖性。在图7D中,随着EBCP-Ca质量浓度逐渐增加,细胞钙含量也增加,在Caco-2培养4 h后,样品实验组的钙质量浓度均超过正常水平((0.42±0.00)mg/mL), 在细胞培养中补充EBCP-Ca剂量可以减少细胞对钙的剂量依赖性[25]。相反,CaCl2组没有显示出优异的保护功效。尽管CaCl2组远高于模型组中的钙质量浓度 (P<0.05),但在2 h和4 h的所有不同质量浓度的实验组中,与EBCP-Ca相比,钙的保护作用仍存在较大差距失利。
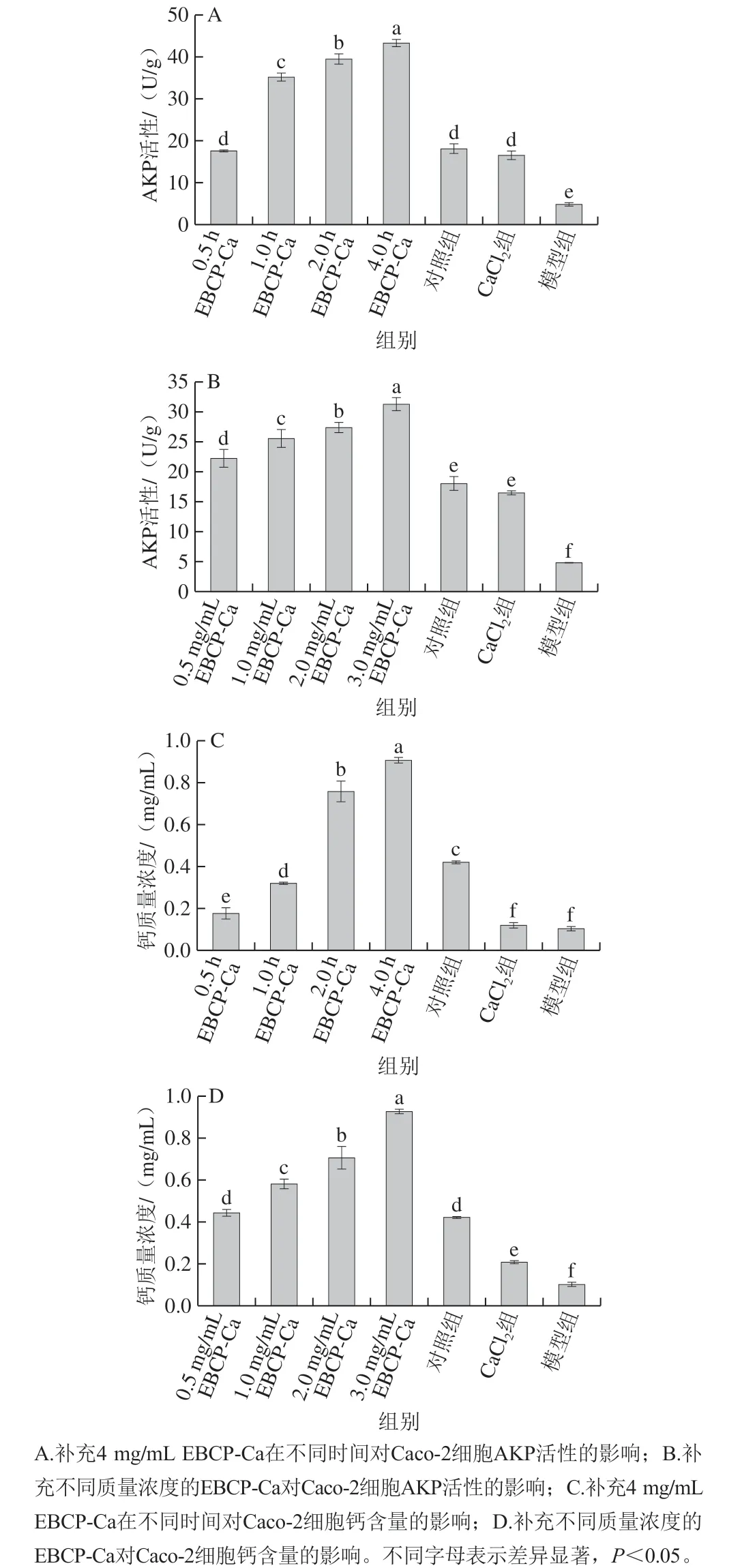
图7 EBCP-Ca补充剂对Caco-2细胞钙含量和AKP活性的影响Fig. 7 Effects of EBCP-Ca concentration and culture time on the calcium content and AKP activity in Caco-2 cells
3 结 论
鳗鱼骨通过单酶、双酶和三酶结合水解,得到不同钙结合能力、水解度和肽产量的水解液,选择3 种酶协同作用后的水解液,其值分别为(35.78±0.13)%、(40.96±0.24)%和(32.86±0.19)%,把水解液与CaCl2结合得到EBCP-Ca,并优化了钙螯合物的制备条件,通过优化确定EBCP-Ca的制备条件为40 ℃、pH 7.5、40 min、多肽与钙质量比5∶1,此时钙螯合率为80%以上。荧光光谱、FTIR光谱和SEM结果表明,钙离子可能与EBCP中的色氨酸、酪氨酸和苯丙氨酸的氨基氮和羧酸基的氧原子相互作用形成EBCP-Ca,其结构不同于EBCP,但是CaCl2过量会出现荧光猝灭。 EBCP-Ca可以在不同温度、pH值和模拟胃肠消化条件下保持稳定性,这可能有利于钙的吸收。细胞毒性实验表明,EBCP-Ca不会影响细胞的存活,而对照组CaCl2会影响细胞活性,加入量增加导致对细胞生长的影响增大,Caco-2细胞的存活率会显著降低(P<0.05)。另外,使用Caco-2细胞单层模型在体外证实了EBCP-Ca的钙摄取率显著高于模型组和对照组(P<0.05),钙离子与EBCP结合有助于细胞的吸收,效果优于CaCl2组。研究钙离子质量浓度与Caco-2细胞在不同质量浓度和时间下摄取的EBCP-Ca的AKP活性之间的关系,可以进一步维持小肠形成的活性,从而有助于人类小肠消化吸收食物中蛋白质,增加体内的AKP活性。结果表明,制备EBCP-Ca作为钙补充剂是提高鳗鱼骨利用率,增加附加值的途径之一。EBCP-Ca有利于促进钙吸收,作为营养补品具有潜在开发价值。应对鳗鱼骨水解物进行纯化、鉴定活性钙结合肽,以及促进肽钙螯合物吸收钙的确切机理和肽钙螯合物的体内钙吸收效率进行进一步研究。
