甘草甜素对糖尿病视网膜病变的神经保护作用
2020-12-29蒋晓梅
蒋晓梅,刘 翀
(丽水市中心医院药学部,丽水323000)
糖尿病视网膜病变(diabetic retinopathy,DR)是一种与糖尿病相关的神经退行性并发症,是成年人早期视力下降甚至致盲的主要原因[1]。DR 具有复杂的多因素病理生理学,由高血糖诱导的神经变性视网膜病变具有致盲的威胁[1-2]。DR 的治疗方式主要包括玻璃体内注射抗血管生成药物以及手术干预。
甘草甜素(glycyrrhizin,GL)是一种天然的抗炎和抗真菌因子。它通过抑制高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)对中枢神经系统疾病起到保护作用[3]。使用大鼠癫痫持续状态模型的研究表明,GL 具有神经保护作用[4]。以往研究证明GL 对HMGB1 的抑制可以保护视网膜免受I/R 损伤[5]。然而,GL 在糖尿病中对视网膜神经结构的作用尚不清楚。本研究探讨GL 作为神经胶质活性和突触可塑性调节剂对视网膜神经结构的保护作用。
1 材 料
1.1 试 剂
甘草甜素(glycyrrhizin,GL)及链脲佐菌素(streptozotocin,STZ)(美国Sigma Aldrich 公司);One Touch Horizon 血糖仪[强生(中国)医疗器材有限公司];磷酸盐缓冲液(PBS)、一抗GFAP、第一链cDNA 合成试剂盒(美国赛默飞世尔公司);GAP43和GLUT-1(英国Abcam),生物素标记的二抗、DAB辣根过氧化物酶显色试剂盒(P0202)、TRIzol 试剂(上海碧云天生物技术有限公司)。
1.2 仪 器
OneTouch Ultra 自动血糖仪(强生医疗器械有限公司);Olympus CX21光学显微镜(日本Olympus公司);ABI 7500 实时PCR 系统(美国Applied Biosystems公司)。
1.3 动 物
C57BL/6 小鼠21 只,雄性,体重(26 ± 3)g,由北京维通利华实验动物技术有限公司提供,实验动物质量合格证许可证号:SCXK(京)2016-0006,于温度(24 ± 4)℃,光照周期正常,食物和水连续供应的环境中自适应饲养1 周。所有动物实验均经动物伦理委员会批准。
2 方 法
2.1 动物分组及糖尿病小鼠实验模型建立
小鼠随机分为对照组(Control)、模型组(Model)及甘草甜素(GL)组,每组7 只。对照组小鼠注射生理盐水,模型组及GL组用STZ(60 mg/kg)单剂量腹腔注射,72 h 后取小鼠尾静脉血,用自动血糖仪检测血糖不低于16.7 mmol/L,证实建模成功。建模成功后GL 组灌胃给予GL(150 mg/kg/d),持续5 周。对照组及模型组用等剂量的生理盐水灌胃。实验结束时,断头法处死小鼠,取眼球并解剖得到视网膜组织进行组织病理学研究、免疫组化和RT-PCR检测。
2.2 组织病理学检查
视网膜组织用福尔马林固定,石蜡包埋,用于组织病理学检查。5 μm 厚度切片进行脱蜡,逐级酒精脱水,伊红染色。观察切片形态学变化。采用光学显微镜400×透镜进行视网膜总厚度、外核层(outer nuclear layer,ONL)厚度、内核层(inner nuclear layer,INL)厚度测量和神经节细胞层细胞计数(ganglion cell layer,GCL)等形态学分析[6]。每只小鼠每个视网膜至少有3个切片。
2.3 免疫组化染色及评价
将福尔马林固定石蜡包埋的组织切片(4 μm)安装在带正电荷的载玻片上,进行免疫组化染色。视网膜切片用3% H2O2孵育10 min,PBS冲洗5 min,用一抗GFAP(1∶100)、GAP43(1∶500)和GLUT1(1∶250)孵育,4 ℃过夜。PBS 冲洗,生物素标记的二抗室温孵育30 min,DAB 辣根过氧化物酶显色试剂盒染色,再用苏木精进行复染。光学显微镜观察星形细胞突起和视网膜层上GFAP 和GAP43的表达。GLUT-1染色强度根据不同视网膜层的相对染色强度,对视网膜切片进行半定量评分(0 ~3+)[7]。图像处理用Image pro plus 6.0 软件进行。
2.4 实时RT-PCR检测
根据制造商的说明,使用TRIzol 试剂从冷冻组织中提取总RNA。使用第一链cDNA 合成试剂盒将RNA 转化为cDNA。使用实时PCR 系统进行实时PCR。引物序列详见表1。使用2-ΔΔCT数据进行分析,并与内参GAPDH进行比较。
2.5 统计分析
采用SPSS 软件进行统计检验,数据呈正态分布用均数±标准差表示,采用单因素方差分析(One-Way ANOVA)进行评估,然后采用Bonferroni的事后分析进行比较。非正态分布数据或PCR 结果的定量数据以中位数表示,通过非参数方差分析和事后检验进行分析。P<0.05表明差异显著。

Table 1 Primer sequences for real-time RT-PCR detection
3 结 果
3.1 GL对糖尿病视网膜的组织病理学影响
如图1-A 所示,对照组视网膜结构正常,与对照组相比,模型组视网膜出现明显的形态学改变,如视网膜层组织明显紊乱、血管生成及神经节细胞数目减少等(图1-B),而GL 组视网膜形态学相对于模型组轻微改善(图1-C)。与对照组相比,模型组视网膜总厚度、INL 厚度、ONL 厚度存在差异,GL 组与模型组相比视网膜总厚度有显著性差异,但INL、ONL 厚度差异不显著(图1-D)。与对照组相比,模型组视网膜神经节细胞有所下降,但GL治疗后视网膜神经节细胞增多(图1-E,P<0.05)。

Figure 1 Histopathological effects of glycyrrhizin (GL) on diabetic retina (400×)A:Control;B:Model;C:GL group;D:Total retinal thickness,INL thickness,ONL thickness,E:Number of retinal ganglion cells (xˉ± s, n = 7)ONL:Outer nuclear layer;INL:Inner nuclear layer;GCL:Ganglion cell layer;GL:Glycyrrhizin*P<0.05 vs control group;#P<0.05 vs model group
3.2 GL对糖尿病视网膜中GLUT1的影响
GLUT1染色切片的免疫组化图像如图2所示。对照组小鼠的视网膜表现出GLUT1表达的多细胞定位,尤其是在NFL、GCL 和ONL 中。而模型组上述视网膜层GLUT1表达较强,GL治疗后GLUT1的表达在定位和强度上均与正常组相当(图2-D,P<0.05)。
3.3 GL对糖尿病视网膜中GAP43的影响
图3 为GAP43 染色的视网膜切片,它明显存在于GCL、INL和IPL中。与对照组的视网膜相比,模型组视网膜GCL 和IPL 的GAP43 免疫染色明显减少。然而,与糖尿病小鼠相比,GL治疗的糖尿病小鼠GCL 和IPL 的GAP43 染色均显著增加(图3-D,P <0.05)。

Figure 2 Immunohistochemical staining of GLUT1 in mouse retinasA:Control;B:Model;C:GL group;D:GLUT-1 staining intensity score (xˉ± s, n = 7)* P<0.05 vs control group;# P<0.05 vs model group
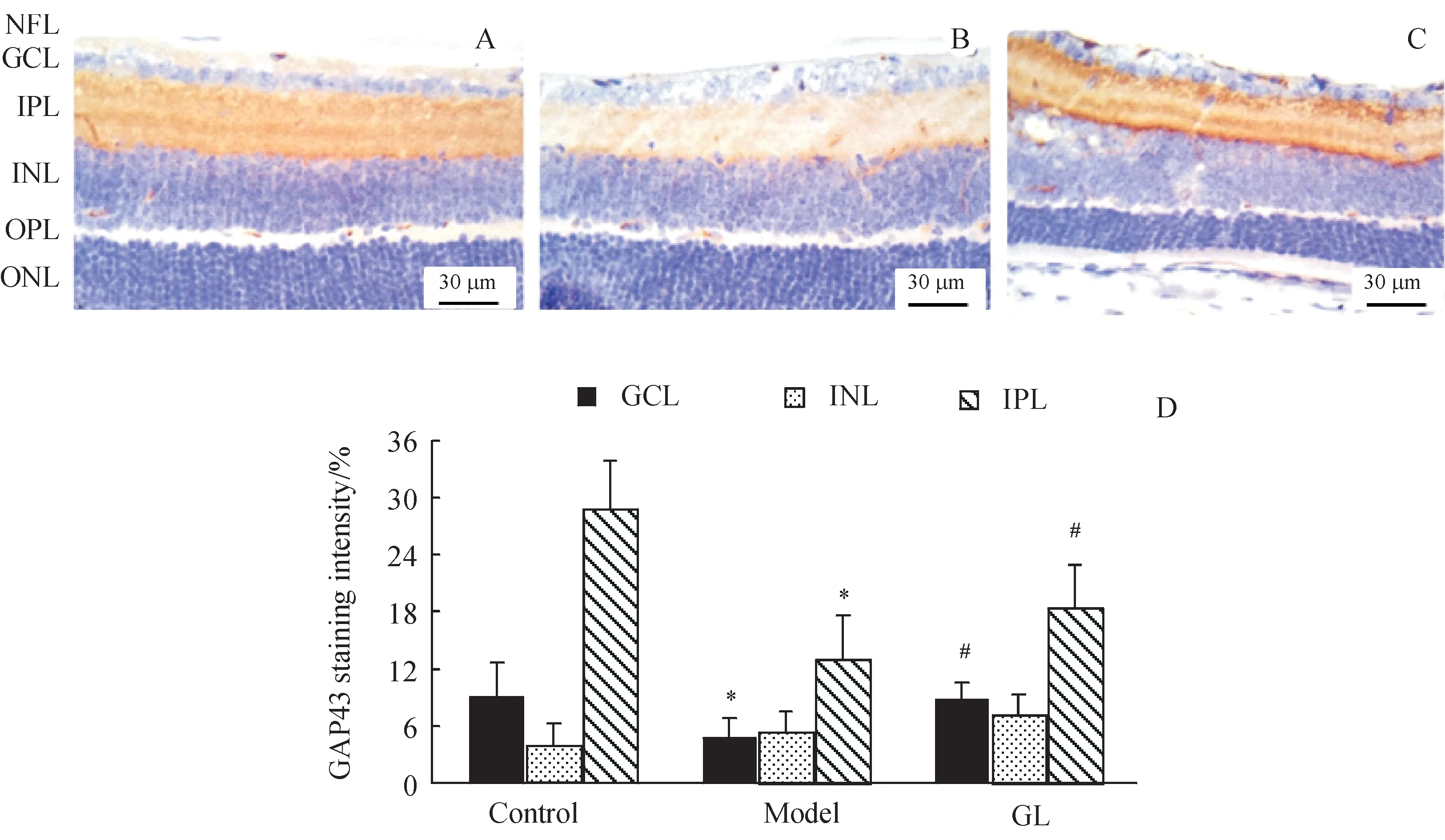
Figure 3 Immunohistochemical staining of GAP43 in mouse retinasA:Control;B:Model ;C:GL group;D:GAP43 staining intensity (xˉ± s, n = 7)*P<0.05 vs control group;#P<0.05 vs model group
3.4 GL对糖尿病视网膜中GFAP的影响
GFAP免疫染色见图4。在对照组视网膜NFL/GCL 中,GFAP 的表达可以忽略不计。模型组视网膜GFAP 表达明显增加,主要表现在NFL/GCL、IPL和横跨整个神经视网膜的缪勒氏细胞中。相比之下,使用GL 治疗6 周的小鼠免疫染色面积明显下降(图4-D,P <0.05)。
3.5 GL 对糖尿病视网膜炎症和凋亡介质的表达的影响
在糖尿病动物模型中,视网膜组织中出现炎症、氧化和增殖标志物的异常表达,见图5,与对照组相比,模型组小鼠TNF-α、IL6、NF-κB、iNOS 和Tp53 的mRNA 表达增加。而在用GL 治疗的糖尿病小鼠中,上述基因的相对表达水平明显降低。模型组的数据具有高度的变异性和分布性,故需要非参数统计分析,并使用箱形图表示。
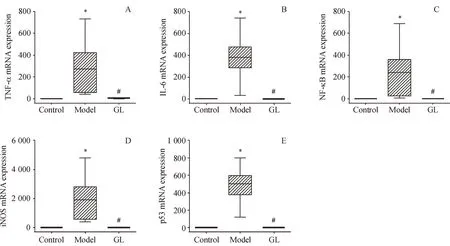
Figure 5 mRNA expression of inflammatory and apoptotic mediators in mouse retinas (xˉ± s, n = 7)A:TNF-α;B:IL-6;C:NF-κB;D:iNOS;E:Tp53*P<0.05 vs control group;# P<0.05 vs model group
4 讨 论
DR 是一种进展缓慢的疾病,出现临床症状需要数年时间[1]。维持良好的血糖水平、血脂和血压有助于降低发病率和阻碍DR 发展[1,8]。然而,现有的治疗方法有限,据报道,用胰岛素或口服降糖药改善血糖控制可抑制DR 的早期阶段,但对许多糖尿病患者来说,血糖控制仍然难以实现[8]。
高血糖诱导的氧化应激和炎症反应是DR 发病的主要原因[9-10]。视网膜的神经和血管维持着视网膜的健康和完整功能。在糖尿病中,葡萄糖通过代谢途径(终末糖基化产物堆积)进入视网膜组织导致氧化应激[9]。在病理特征中,胶质细胞活化导致促炎性细胞因子和炎性细胞因子的表达[10-11]。本研究显示糖尿病模型小鼠视网膜层受损和衰弱、NFL 增厚、GCL 退行性改变、ILM 内血管生成和微动脉瘤形成,与之前关于糖尿病大鼠的研究相一致[6]。此外,本研究中促进DR 发病的GLUT1 在糖尿病小鼠的视网膜中上调,据报道,抑制GLUT1 是一种潜在治疗DR 的策略[12]。GLUT是一种转运蛋白家族,用于转运葡萄糖,抑制GLUT1 的表达限制葡萄糖的运输,从而降低了视网膜的葡萄糖浓度并改善了糖尿病性视网膜病变[12-13]。本研究数据提示GL 治疗后改善了与糖尿病相关的视网膜和血管损伤,且降低了GLUT 表达,这一发现可能表现了甘草甜素在视网膜血糖水平中的作用,使得视网膜几乎处于正常血糖水平,但仍需要进一步研究GL 对视网膜组织的葡糖糖含量的影响或GL 对体外的视网膜组织在高糖刺激下的葡糖糖吸收的影响。
此外,GL 还下调了糖尿病小鼠中神经元应激指标和胶质细胞活化标志物GFAP,而上调了神经元再生标记物GAP43。GAP43 定位于轴突生长锥,参与神经系统突触的可塑性,在糖尿病大鼠中GAP43下调[14],而GFAP 下调被认为是一种保护机制[15]。本研究还提示使用GL 治疗DR 可以改善炎症状态,改善细胞因子水平。GL 主要通过减少炎性细胞因子TNF-α 和IL-1β 的表达,从而体现抗炎活性[16]。陈继红[17]报道称,GL 的抗炎活性是通过抑制HMGB1/TLR-4/NF-kB途径。同时,在GL治疗的小鼠中凋亡标志物Tp53 和iNOS 的表达也下调。这一变化在不同视网膜层的增强和再生组织病理学检查中,尤其是GCL 和INL 中,得到了明显的反映。Tp53是一种在视网膜细胞中诱导的抗凋亡转录因子,它能在组织碎片的免疫介导清除下保护胶质细胞不被清除[15,18]。在以前的研究中,GL 具有神经保护作用,这在糖尿病神经病变中得到了证实和报道[16-17]。
综上所述,本试验研究结果显示,在DR 的实验模型中,甘草甜素主要发挥其抗炎和神经保护作用,提示GL 在DR 的病例中可能具有良好的应用前景。
