CHMFL-KIT-110固体分散体制备、理化性质及大鼠体内药代动力学
2020-12-29陈登俊孙宏张霍美蓉
吴 勇,陈登俊,汪 潇,孙宏张*,霍美蓉**
(1中国药科大学药学院药剂系,南京210009;2合肥合源药业有限公司,创新药物成药性评价安徽省重点实验室,合肥230031)
N-(4-甲基-3-(1-异烟酰基哌啶-4-基)氧基)苯基)-3-(三氟甲基)苯甲酰胺(英文名称:N-(3-((1-isonicotinoylpiperidin-4-yl)oxy)-4-methylphenyl)-3-(trifluoromethyl)benzamide,实验室代号:CHMFLKIT-110)是针对胃肠间质瘤(gastrointestinal stromal tumors,GISTs)的新型c-KIT 激酶抑制剂,能够强烈抑制激酶c-KIT 的磷酸化,在人类468 种激酶的选择性测试中显示出较小脱靶作用[1],化合物结构式如图1。CHMFL-KIT-110 极难溶于水,为制剂开发带来了挑战。

Figure 1 Molecular structure of CHMFL-KIT-110
目前,制药生产实践中增加药物溶解度的方法有很多,如选择合适晶型、微粉化、表面活性剂增溶、制成前体药物、制成包合物或固体分散体等。其中,固体分散体是指将药物以分子、胶态、无定形或微晶状态分散于另一种载体材料中以形成高度分散的体系,最早由Sekiguchi 和Obi 在1964 年提出。制成固体分散体后,高度分散的药物溶解时不需克服晶格能,因此溶出速率比结晶型快[2],而且载体通常具有良好的润湿性,可促进药物的溶出。
本研究采用聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)、泊洛沙姆407(Poloxamer 407)、聚乙二醇6000(PEG 6000)和共聚维酮(Kollidon VA64)为载体材料,制备CHMFLKIT-110 固体分散体,并考察物相状态、初步稳定性和大鼠体内药代动力学。其中,Soluplus 为德国BASF 公司于2009年开发的新型两亲性载体材料,制备的固体分散体具有良好的制剂稳定性、增溶作用和可加工性能[3]。目前常用于制备固体分散体的方法有热熔挤出法、熔融溶剂法、研磨法和溶剂蒸发法等。其中,热熔挤出法和熔融溶剂法需要使用较低熔点(或低玻璃化转变温度)的载体材料,熔融后的高黏度载体可能与药物混合不充分,而且高温条件会影响热敏感性药物的稳定性[4]。研磨法效率较低,大规模生产时会面临严峻挑战;而溶剂法制备固体分散体操作简便,有利于快速筛选处方,同时适合实验室转产业化生产的需求。因此,本论文选用溶剂法作为CHMFL-KIT-110 固体分散体的制备工艺。
1 材 料
1.1 药品与试剂
CHMFL-KIT-110 原料药(纯度99.3%,合肥合源药业有限公司);厄贝沙坦标准品(纯度99.8%,中国食品药品检定研究院);Soluplus、Poloxamer 407、Kollidon VA64(德国BASF 公司);PEG 6000(西陇科学股份有限公司);十二烷基硫酸钠(SLS,湖南尔康制药股份有限公司);吐温80(Tween 80,四川金山制药有限公司);聚氧乙烯氢化蓖麻油(Cremophor RH40,德国BASF 公司);乙腈、甲醇为色谱纯,其余试剂均为市售分析纯。
1.2 仪 器
CP213电子天平(美国奥豪斯仪器有限公司);XS105 电子天平(瑞士梅特勒-托利多仪器有限公司);RC12AD 智能溶出仪(天津市天大天发科技有限公司);LC-20A 高效液相色谱仪、LabSolutions 数据采集处理软件、傅里叶变换红外光谱仪、DTG-60A 差热热重同步分析仪(日本岛津公司);DX-27mini X 射线粉末衍射仪(丹东浩元仪器有限公司)。
Finnigan TSQ Quantum Discovery MAX 型LCMS/MS 联用仪(美国Thermo Electron 公司);Milli-Q Academic 纯水机(密理博上海贸易有限公司);16K高速离心机(珠海黑马医学仪器有限公司);H2050R 台式高速大容量冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.3 动 物
雄性SD大鼠,购入时体重180 ~220 g,购自安徽医科大学实验动物中心,许可证号:SCXK(皖)2017-001。本实验通过合肥诺明药物安全研究有限公司实验动物伦理委员会批准,伦理号:IACUC-2019-PK-024。
2 方法与结果
2.1 CHMFL-KIT-110平衡溶解度研究
2.1.1 色谱条件 WondaSil C18-WR 色谱柱(250 mm × 4.6 mm,5 μm);柱温:35 ℃;流动相:20 mmol/L KH2PO4溶液(H3PO4调pH 至2.90)-乙腈(40∶60);流速:1.2 mL/min;检测波长:220 nm;进样体积:20 μL。
2.1.2 标准曲线绘制 精密称取CHMFL-KIT-110 原 料药26.22 mg,置25 mL 量瓶中,加 适量50% 乙腈并超声使原料药溶解,再加50% 乙腈稀释至刻度,摇匀得CHMFL-KIT-110 储备液。精密量取储备液适量,用50% 乙腈稀释,质量浓度梯度为5.21、26.04、52.07、104.15、156.22、208.29 μg/mL,分别精密量取20 μL 注入液相色谱仪。以峰面积(A)对溶液质量浓度(c,μg/mL)进行回归运算,得回归方程A = 39 778.32 c + 4 016.54(r =1.000 0,n = 3)。结果表明CHMFL-KIT-110 质量浓度在5.21 ~208.29 μg/mL 范围内与峰面积线性关系良好。
2.1.3 平衡溶解度测定 考察CHMFL-KIT-110在不同pH 溶液和有机溶剂中的溶解度。参考USP40-NF35-Buffer Solutions,分 别 配 制HCl 溶 液(pH 1.0)、HCl 溶液(pH 2.0)、邻苯二甲酸氢钾缓冲液(pH 3.0)、醋酸盐缓冲液(pH 4.5)、磷酸盐缓冲液(pH 6.8)和磷酸盐缓冲液(pH 8.0)。另外准备纯化水以及常用有机试剂,包括丙酮、甲醇、95%乙醇、无水乙醇、乙腈和乙酸乙酯。取上述水性溶液和有机溶剂适量,分别加入过量CHMFL-KIT-110 原料药,涡旋分散,每种溶剂同法配制3 份样品,密封后置于37 ℃恒温摇床,振摇频率为每分钟130 次。24 h 后,取溶液1.5 mL 于离心管中,以15 000 r/min 转速离心8 min,取上清液经适当稀释后,分别精密量取20 μL注入液相色谱仪。按外标法以峰面积计算CHMFL-KIT-110 在各水性溶液和有机溶剂中的平衡溶解度,结果见表1。
Table 1 Equilibrium solubility of CHMFL-KIT-110 in different solvents (± s, n = 3)

Table 1 Equilibrium solubility of CHMFL-KIT-110 in different solvents (± s, n = 3)
Dissolution media HCl (pH 1.0)HCl (pH 2.0)Biphthalate (pH 3.0)Acetate (pH 4.5)Phosphate (pH 6.8)Distilled water Solubility/(μg/mL)175.47±13.23 21.98±0.41 3.47±0.00 0.71±0.01 0.68±0.02 0.73±0.11 Organic solvent Acetone Methanol 95% ethanol Absolute ethanol Acetonitrile Ethyl acetate Solubility/(mg/mL)90.55±0.36 78.58±0.23 47.37±0.36 33.30±2.28 30.35±1.00 24.56±1.09
如图1,CHMFL-KIT-110 的吡啶环呈弱碱性,其平衡溶解度呈pH 依赖性,即平衡溶解度随pH的升高而下降。当pH 为6.8 时,溶解度仅为0.68 μg/mL,因此药物在肠道环境中溶解度极低,推测会成为制约口服吸收的主要因素。基于上述考虑,本研究选择pH 6.8 磷酸盐缓冲液用于后续的增溶研究。此外,鉴于安全性、低毒性考虑以及CHMFL-KIT-110 在95% 乙醇中的良好溶解性[5],本研究固体分散体的制备选用95% 乙醇作为溶剂。
2.2 CHMFL-KIT-110固体分散体的制备及评价
2.2.1 固体分散体制备 称取CHMFL-KIT-1101 g溶解于95% 乙醇100 mL 中得澄清溶液,边搅拌边 分 别 缓 慢 加 入Soluplus、Poloxamer 407、PEG 6000 和Kollidon VA64 等载体材料4 g。60 ℃水浴旋转蒸发溶剂,置于40 ℃真空干燥箱过夜除去残留溶剂,研磨粉碎后再置干燥器内保存,制得4 份固体分散体样品。
2.2.2 动力学溶解度测定 37 ℃条件下,分别称取适量固体分散体(折合含CHMFL-KIT-110 10 mg)置于pH 6.8 磷酸盐缓冲液500 mL 中,以桨法100 r/min 搅拌1 440 min。 分别 于 第10、20、30、60、120、240、1 440 min 取溶液10 mL,同时补充等量同温缓冲液。样品溶液经12 000 r/min 离心5 min后,取上清液20 μL 注入液相色谱仪测定浓度,绘制动力学溶解度与时间的变化曲线,结果见图2。
难溶性药物与亲水性载体达到分子层面的混合后,药物释放行为由聚合物载体的性质驱动[4]。分别用4 种载体制备固体分散体后,CHMFL-KIT-110 的释放行为不尽相同,但均有一定的增溶作用。Kollidon VA64 固体分散体具有明显的速释行为,呈现“弹簧效应”[6]。检测后期溶液略显浑浊,可能是发生重结晶,溶液浓度恢复到药物的平衡溶解度水平。Poloxamer 407 固体分散体增溶效果良好,但动力学溶解度呈持续下降的趋势,有较高的析晶风险。PEG 6000固体分散体增溶效果持续稳定,但制备的样品难以粉碎处理,不利于后续工艺开展。Soluplus 固体分散体在检测前期药物释放缓慢,但与其他3种载体相比,Soluplus增溶效果最好,溶液过饱和状态维持能力良好,而且样品松脆易研磨,因此选用Soluplus 作为后续研究的载体。

Figure 2 Solubility profiles in pH 6.8 PBS of CHMFL-KIT-110 solid dispersions with different carriers (xˉ± s, n = 3)
2.2.3 载体用量选择 按原料药和载体质量比1∶2、1∶3、1∶4、1∶5 分别称取CHMFL-KIT-110 和Soluplus,按“2.2.1”项下方法制备固体分散体。分别称取适量固体分散体(含CHMFL-KIT-110 50 mg)进行动力学溶解度检测,结果见图3。

Figure 3 Solubility profiles in pH 6.8 PBS of CHMFL-KIT-110 solid dispersions with different Soluplus ratios (xˉ± s, n = 3)
质量比为1∶2的处方在240 min后动力学溶解度下降,存在原料药重结晶析出的风险。质量比在1∶3 ~1∶5范围内的处方动力学溶解度一直呈上升趋势,各溶液过饱和维持能力良好。但随着载体用量加大,载体本身的增溶效果略有下降。结合稳定性、操作空间以及载体用量最少原则,优选比例适中的1∶4处方用于后续研究。
2.2.4 增溶剂种类筛选 在载体材料中加入表面活性剂有助于增加难溶性药物的亲水性,表面活性剂可以配合载体材料抑制药物结晶,提高固体分散体的贮藏稳定性[4]。向原料药的乙醇溶液分别添加SLS、Tween 80、Cremophor RH40,加入量为CHMFL-KIT-110 用量的50%,搅拌条件下再缓慢加入Soluplus,按“2.2.1”项制备固体分散体。分别称取适量固体分散体(折合含CHMFL-KIT-110 10 mg)进行动力学溶解度检测,结果见图4。

Figure 4 Solubility profiles of CHMFL-KIT-110 solid dispersions in pH 6.8 PBS with different solubilizers (xˉ± s, n = 3)
与图2 相比较,添加Tween 80 和Cremophor RH40 后,CHMFL-KIT-110 动力学溶解度无明显改善,但SLS的增溶效果较好并可显著提高药物溶解速率,可能是SLS 吸附于Soluplus 的疏水片段形成复合物,产生更多的疏水结构域[7],有利于CHMFL-KIT-110的“储存”。基于增溶效果,选择SLS用于后续研究。
2.2.5 增溶剂用量选择 按质量比1∶4∶0.25、1∶4∶0.5、1∶4∶0.75 分 别 称 取CHMFL-KIT-110、Soluplus、SLS,按“2.2.4”项制备固体分散体。分别称取适量固体分散体(折合含CHMFL-KIT-110 50 mg)进行动力学溶解度检测,结果见图5。

Figure 5 Solubility profiles of CHMFL-KIT-110 solid dispersions in pH6.8 PBS with different SLS ratios (xˉ± s, n = 3)
经计算,3个处方的SLS在pH 6.8磷酸盐缓冲液中均未达到临界胶束浓度(0.23%)[8]。质量比为1∶4∶0.25 的处方动力学溶解度波动较大,240 min后动力学溶解度明显下降。但是此处方的增溶效果优于其他两组,在120 ~240 min 动力学溶解度几乎是其他组的2 倍。质量比为1∶4∶0.75的处方在前30 min 动力学溶解度较高,随后开始持续下降,推测是SLS 用量过大对载体Soluplus 产生致孔作用,并在一定程度占据“疏水内核”,影响CHMFL-KIT-110 被载体分散与包裹。质量比为1∶4∶0.5 的处方动力学溶解度波动较小。该用量的SLS 在提高原料药溶解度的同时又能较好地维持溶液过饱和状态,因此选择此处方用于后续研究。
2.2.6 动力学溶解度分析方法专属性 根据上述确定的固体分散体处方,配制空白辅料溶液。分别精密量取pH 6.8 磷酸盐缓冲液、空白辅料溶液、供试品溶液和对照品溶液20 μL注入液相色谱仪,结果见图6。
如图6所示,CHMFL-KIT-110在6.8 min出峰,峰形良好,理论塔板数大于3000,符合测定要求。pH 6.8 磷酸盐缓冲液、Soluplus 和SLS 对CHMFLKIT-110的测定均无干扰。
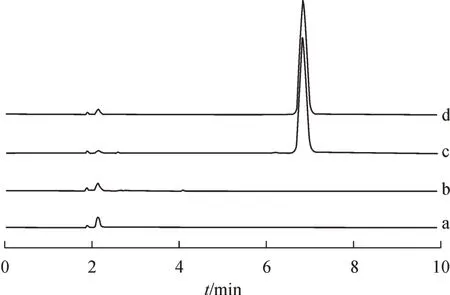
Figure 6 Specificity chromatograms of dynamic solubility methodology:pH 6.8 PBS buffer (a);blank excipients (b);sample (c);STD (d)
2.3 固体分散体理化性质研究
2.3.1 供试品制备 按质量比1∶4∶0.5 称取CHMFL-KIT-110、Soluplus 和SLS,于研钵中研磨混匀,置干燥器内保存备用,作为物理混合物。同法称取适量的Soluplus 和SLS,制得空白辅料。另外单独称取适量的Soluplus、CHMFL-KIT-110备用。
2.3.2 傅里叶变换红外光谱 分别称取2 mg 空白辅料、CHMFL-KIT-110、物理混合物、固体分散体,与干燥溴化钾200 mg混匀,压片。扫描范围为400 ~4 000 cm-1,结果见图7。

Figure 7 FT-IR spectra of blank excipients (a);CHMFL-KIT-110 (b);physical mixture (c);solid dispersions (d)
图7 显示,CHMFL-KIT-110 在高波段3 200 ~3 000 cm-1有N-H 伸缩振动的特征峰,与空白辅料物理混合后特征峰减弱,制备成固体分散体后特征峰消失,低波段1 600 ~400 cm-1锯齿状吸收峰也大幅消失,推测CHMFL-KIT-110与Soluplus发生氢键结合,高度分散于载体中。
2.3.3 差热分析 分别称取空白辅料、CHMFLKIT-110、物理混合物、固体分散体适量,置于铝坩埚中进行DTA 分析,升温速度为10 ℃/min,升温范围为0 ~350 ℃,结果见图8。
图8 显示,CHMFL-KIT-110 在172.20 ℃处有明显吸热峰,单纯的物理混合物在170.61 ℃仍有吸热峰,吸热峰轻微左移。空白辅料和固体分散体均无吸热峰,侧面佐证CHMFL-KIT-110 以无定形态分散于载体中。
2.3.4 X 射线粉末衍射 分别称取适量SLS、CHMFL-KIT-110、Soluplus、物理混合物和固体分散体,研磨成细粉后进行XRPD 扫描分析。工作条件:铜靶,管电压35 kV,管电流15 mA,扫描速度为2(°)/min,扫描范围为4 ~40 °,结果见图9。

Figure 8 DTA curves of CHMFL-KIT-110 (a);blank excipients (b);physical mixture (c);solid dispersions (d)

Figure 9 XRPD images of SLS (a);CHMFL-KIT-110 (b);Soluplus(c);physical mixture (d);solid dispersions (e)
图9 显示,SLS 在6.140 °有特征衍射峰,CHMFL-KIT-110在8.360 ~38.938 °显现出一系列特征衍射峰,而Soluplus 为无定形材料,无衍射峰。在物理混合物中仍可见CHMFL-KIT-110 的部分衍射峰,但在固体分散体中CHMFL-KIT-110 的衍射峰完全消失,说明CHMFL-KIT-110 以无定形态分散于载体中。
2.3.5 稳定性考察 取适量CHMFL-KIT-110 固体分散体,敞口条件下放置在加速条件(40 ℃,75% 相对湿度),于第0、30 天取样。通过XRPD 判断样品是否发生转晶,并检测其动力学溶解度。结果见图10和图11。
如图10 所示,固体分散体在加速条件下放置30 d 后,在5 ~8 °可见SLS 的特征衍射峰,但未出现CHMFL-KIT-110 的特征衍射峰,表明CHMFLKIT-110 仍以无定形态存在于载体中。图11 显示动力学溶解度曲线也无明显变化,表明此处方制备的固体分散体稳定性良好。
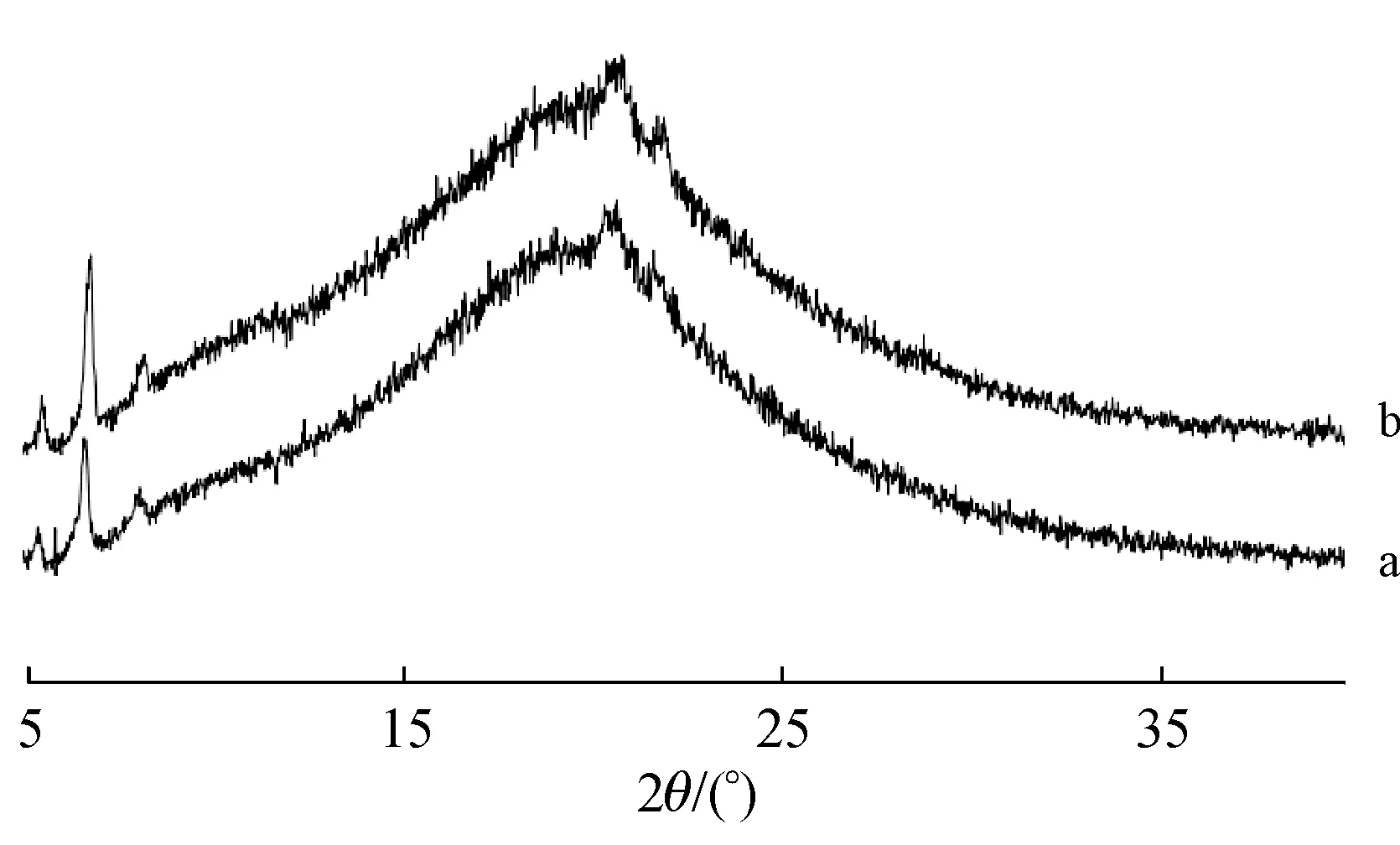
Figure 10 XRPD images of fresh solid dispersions (a);aged solid dispersions after 30 days stability testing in 40 °C,75% RH (b)
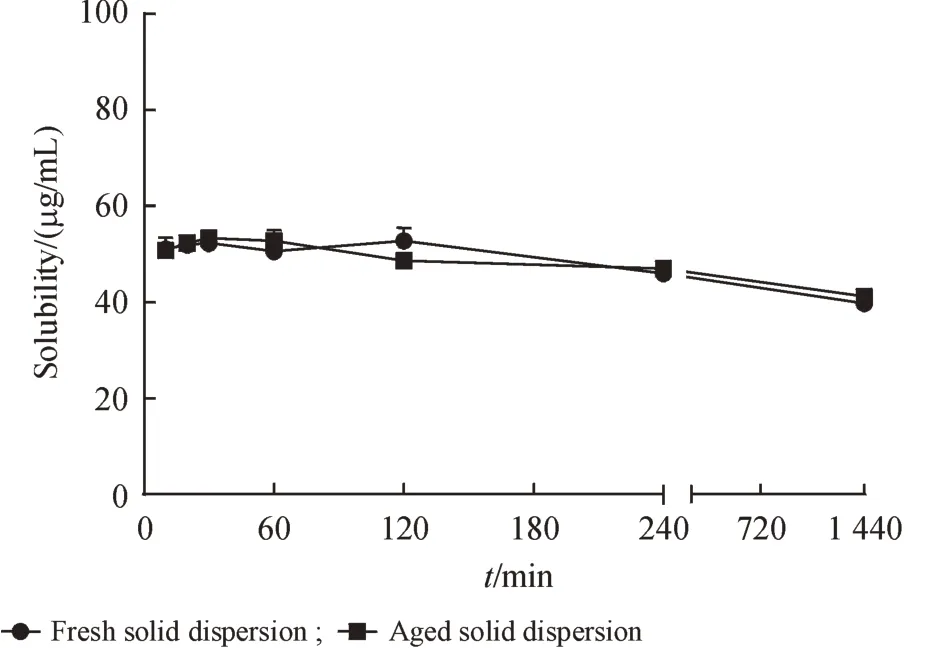
Figure 11 Solubility profiles of fresh solid dispersions and aged solid dispersions after 30 days stability testing in 40 °C,75% RH (xˉ± s, n = 3)
2.4 大鼠体内动物学研究
2.4.1 色谱条件 Phenomenex Fusion-RP-80A 色谱柱(150 mm×2.0 mm,4 μm);柱温:35 ℃;流动相A 相:0.1% 甲酸水溶液,流动相B 相:甲醇;流速:0.5 mL/min;检测波长:220 nm;进样体积:10 μL。洗脱程序见表2。

Table 2 Gradient elute program of CHMFL-KIT-110 plasma
2.4.2 质谱条件 ESI 源,离子化电压3.5 kV;毛细管温度350 ℃;鞘气、辅助气、吹扫气压力分别为40、15、15 psi(1 psi ≈6.9 kPa)。
CHMFL-KIT-110 m/z:母离子484.0,子离子189.0,碰撞能28 eV,管透镜电压120 V。
厄贝沙坦m/z:母离子429.2,子离子207.1,碰撞能31 eV,管透镜电压120 V。
2.4.3 溶液配制 精密称取厄贝沙坦标准品10.02 mg 于10 mL 量瓶中,乙腈溶解并定容至刻度,得质量浓度为1 000 μg/mL的内标储备液。取适量内标储备液,用乙腈稀释成质量浓度为20 ng/mL的内标工作溶液。
精密称取CHMFL-KIT-110原料药10.08 mg置10 mL 量瓶中,甲醇溶解并定容至刻度,得质量浓度为1 000 μg/mL 的储备液。取适量储备液用甲醇稀释,配制成质量浓度为40、100、200、1 000、2 000、10 000、20 000、40 000 ng/mL 的一系列线性标准溶液。
2.4.4 血浆样品处理方法 取血浆样品100 μL于96 孔深孔板中,加入厄贝沙坦内标工作溶液300 μL,涡旋5 min,4 000 r/min 离心10 min,取上层澄清液100 μL 于另一个96 孔深孔板中,加入水100 μL,混匀后4 000 r/min 离心10 min,取上清液20 μL进样分析。
2.4.5 标准曲线和定量范围 精密量取CHMFLKIT-110 系列标准溶液各10 μL,加入空白大鼠血浆90 μL。按“2.4.4”项处理样本,建立标准曲线,血样质量浓度分别为2、5、10、50、100、500、1 000、2 000 ng/mL,每个浓度为双样本。随机指定10、100、1 000 ng/mL 为质控低、中、高标准溶液。质控样品测定结果要求相对偏差(RE)小于15%,每一浓度水平至少50%样品应符合标准。
通过对标准曲线定量范围内一系列浓度生物样品测定,得到浓度对应的响应值。以样品质量浓度(X,ng/mL)为横坐标,不同样品浓度的峰面积(As)与内标峰面积(Ai)的比值(Y,As/ Ai)为纵坐标进行回归运算,得回归方程Y = 0.003 125 8 X +0.017 089 3(r = 0.996 7,n = 2)。质控低、中、高标准溶液的相对偏差分别为2.715%、13.261% 和-8.015%,均小于15%,同时各质量浓度水平满足至少50%样品符合标准的要求。
2.4.6 药代动力学试验 选择健康的雄性SD 大鼠9 只,随机分成3 组,每组3 只。试验前禁食整夜,自由饮水。组1 按5 mg/kg 静脉注射CHMFLKIT-110 原料药溶液(含20% DMSO 的泊洛沙姆葡萄糖注射液,0.22 μm 滤膜除菌过滤),组2 按50 mg/kg 灌胃CHMFL-KIT-110 原料药溶液(含5%HPMC 的饱和碳酸氢钠溶液,充分混匀),组3 按50 mg/kg 灌胃CHMFL-KIT-110 固体分散体水溶液。30 s内完成给药操作。
灌胃组分别于给药前0 min 及给药后15、30、60、120、240、360、480、600、1 440 min 眼眶后静脉丛采血0.3 mL,静脉注射组除上述时间点外还需在给药后1和5 min采血。血样置EDTA-K2抗凝管中,3 000 r/min 离心15 min,分离血浆,-20 ℃保存待用。
2.4.7 试验结果 应用DAS 3.0软件按非房室模型分析血浆总药物浓度数据,通过SPSS 22.0 软件对数据进行处理,药代动力学参数见表3。CHMFL-KIT-110 原料药静脉注射,CHMFL-KIT-110 原料药和固体分散体灌胃给药后在大鼠体内的血药浓度-时间曲线见图12。
图12 显示,采样时间内口服固体分散体组的血药浓度都高于口服原料药组。由表3 可知,CHMFL-KIT-110制成固体分散体后,tmax稍有提前,绝对生物利用度从0.18% 增加到64.17%。t 检验结果显示,与原料药相比,cmax和AUC0→t的P分别为0.017 和0.004,具有显著性差异。综上,CHMFLKIT-110的吸收效果得到极大改善。

Table 3 Pharmacokinetic parameters of CHMFL-KIT-110 in plasma after intravenous administration at a dose of 5 mg/kg and oral administration at a dose of 50 mg/kg (xˉ± s, n = 3)

Figure 12 Plasma concentration-time profiles of CHMFL-KIT-110 after intravenous administration of free APIs in rats at a dose of 5 mg/kg,oral administration of free APIs and solid dispersions to rats at a dose of 50 mg/kg (xˉ± s, n = 3)
3 讨 论
CHMFL-KIT-110 作为新型c-KIT 激酶抑制剂具有较高的临床价值,但平衡溶解度研究结果显示在pH 4.5 以上环境中溶解度很低(<1 μg/mL),因此药物进入十二指肠后易受溶解度限制而影响其生物利用度。
固体分散体技术是目前增加难溶性药物水溶性和口服吸收的有效方法之一。动力学溶解度结果表明,以Soluplus 为载体制备的固体分散体对CHMFL-KIT-110 同时具有增溶和抑制结晶的能力,效果优于Poloxamer 407、PEG 6000 和Kollidon VA64 等载体。SLS 相比于Tween 80 和Cremophor RH40,对Soluplus 制备的固体分散体有更好的增溶效果。优化处方后,CHMFL-KIT-110、Soluplus、SLS的质量比为1∶4∶0.5。
按上述处方制备的固体分散体,经FT-IR、DTA、XRPD 等手段联合确证表明,CHMFL-KIT-110 以无定形态高度分散于载体材料中。其在40 ℃,75% 相对湿度条件下敞口放置30 d 后,CHMFL-KIT-110 仍能维持无定形状态,表明此固体分散体的稳定性良好。
大鼠体内药代动力学研究结果显示,口服CHMFL-KIT-110 原料药的生物利用度仅为0.18%。口服固体分散体后,吸收加快,生物利用度显著提高至64.17%,cmax和AUC0→t较原料药分别提高373.1 倍和358.7 倍。与原料药相比,固体分散体的相对生物利用度为35 868.47%。
总之,本项固体分散体工艺大大提高了CHMFL-KIT-110 的成药性,为后续临床研究、上市申请和产业化生产提供了基础。但由于动力学溶解度研究方法未能满足漏槽条件,忽略了浓度梯度等因素,不易评估制剂的关键质量属性,仍需设计合理的溶出方法探索制剂的体内外相关性。
