Pd-Ag/Al2O3催化剂上CO吸附的原位漫反射红外光谱研究
2020-12-29吕曼丽秦玉才张晓彤宋丽娟
吕曼丽,龚 珣,秦玉才,张晓彤,宋丽娟
(辽宁石油化工大学辽宁省石油化工催化科学与技术重点实验室,辽宁抚顺113001)
乙烯是最重要的基本有机化工原料之一,主要来自石油烃热裂解工艺过程。热裂解生产的乙烯(C2H4)中含有少量的乙炔(C2H2)(占总体积的2%~5%),乙炔对于下游乙烯聚合的Zigler-Natta催化剂是有毒的,所以必须使乙炔的质量分数降到1~5 μg/g[1]。在乙烯的精制过程中,一般利用选择性加氢反应将原料中少量的乙炔进行脱除[2]。负载型钯银双金属催化剂因其良好的加氢活性和优异的选择性,已经广泛应用于乙炔选择性加氢制乙烯的工业中[3-7]。
由于金属负载量低,且高度分散,Pd-Ag/Al2O3催化剂上活性中心的精细结构表征是一项具有挑战性的课题。原位漫反射红外技术是一种研究固体表面吸附物种最常用的方法,是证明催化反应中心和反应机理的重要手段[3,8-9],其原理是利用探针分子在催化剂上的吸附态,再根据红外光谱特征对催化剂的微观形态和表面特征信息进行分析。张齐等[9]运用原位红外光谱法研究Pd-Ag/Al2O3和Pd/Al2O3催化剂上乙炔选择性加氢和表面反应特征;李振花等[10]利用原位红外光谱技术分别对CO在钯金属催化剂及其载体上的吸附进行了研究。本文以原位红外漫反射(In-situ DRFTIR)为表征手段,选取CO为探针分子,分别对不同结构的Pd-Ag/Al2O3催化剂进行表面形态表征,对Pd-Ag/Al2O3催化剂的作用机理做进一步的研究。
1 实验部分
1.1 原料与试剂
高纯H2,纯度99.99%,抚顺氧气厂;高纯Ar,纯度99.99%,抚顺氧气厂;CO,纯度99.90%,大连光明化工研究设计院。
1.2 催化剂制备
θ-Al2O3载体经焙烧后,分别浸渍一定浓度的硝酸银、硝酸钯溶液,经干燥、焙烧后制得Pd和Ag质量分数分别为0.05%和0.10%的Pd-Ag/Al2O3催化剂。根据浸渍方法的差异制备出3种结构的催化剂,分别标记为LM-1、LM-2、LM-3。催化剂在1.5 MPa、150℃高纯H2还原4 h后备用。
1.3 催化剂结构表征
采用D/Max-RB 12 kW转靶X射线衍射仪(日本理学株式会社),测定分析催化剂的晶体结构,Cu靶、Kα(0.154 18 nm),工作电压为40 kV,工作电流为 30 mA,步长为 0.02°,扫描范围 2θ在 5°~60°,扫描速度为6(°)/min。
1.4 In-situ DRFTIR测试方法
运用原位漫反射红外系统(包括Nicolet iS50傅立叶红外光谱仪,MCT检测器(美国尼高力公司),Harrick原位漫反射附件(ZnSe窗片)),自制气路控制系统,进行不同结构的催化剂对CO吸附和转化行为的测定分析。将70 mg左右的催化剂样品粉末装入高温真空反应池的样品杯中,适当压平后通入高纯H2,流量调至10 mL/min,以10℃/min的速度升温至110℃,吹扫2 h;分别降温至25、40℃,以高纯Ar吹扫;再用高纯Ar为载气将CO气体引入载体或催化剂样品表面进行动态吸附,吸附饱和后再切入高纯Ar进行吹扫,实时采集吸脱附过程的谱图,光谱以Kubelka-Munk方程给出,采集数据间隔为2 min,红外光谱的分辨率设为4 cm-1,扫描8次。
2 结果与讨论
2.1 催化剂的XRD分析
Pd-Ag/Al2O3、Pd/Al2O3催化剂以及载体的XRD谱图如图1所示。由图1可见,在3种催化剂谱图中,2θ为 31.25°、32.89°、36.95°、40.05°、45.02°、67.28°时均可观察到明显的特征衍射峰,这归属于θ-Al2O3的特征衍射峰,说明Pd-Ag/Al2O3催化剂采用的载体为θ-Al2O3。θ-Al2O3的性能介于α-Al2O3和γ-Al2O3之间,由于其表面酸性比较低,常作为C2加氢催化剂的载体来使用[12]。在Pd-Ag/Al2O3催化剂以及Pd/Al2O3催化剂上未观察到Pd和Ag的特征衍射峰,说明实现了钯元素在催化剂上的高效分散。

图 1 Pd-Ag/Al2O3催化剂(a、b、c)、Pd/Al2O3催化剂(d)以及载体(e)的XRD谱图Fig.1 XRD spectrum of Pd-Ag/Al2O3catalyst(a,b,c),Pd/Al2O3catalyst(d)and carrier(e)
2.2 CO在Pd-Ag/Al2O3上的吸附与转化
2.2.1 CO在Pd-Ag/Al2O3-LM-1上的原位漫反射红外光谱 图2为25℃时CO在Pd-Ag/Al2O3-LM-1上吸附和脱附原位漫反射红外光谱。

图2 25℃时CO在Pd-Ag/Al2O3-LM-1上原位吸附和脱附过程的漫反射红外光谱Fig.2 Infrared diffuse reflectance spectrum of CO in-situ asorption and desorption on Pd-Ag/Al2O3-LM-1 at 25℃
从图2(a)中可以看到,随着吸附的进行,在Pd-Ag/Al2O3-LM-1催化剂上逐渐形成了2 170、2 117 cm-1的吸附特征峰,随着CO通入时间的增加,其强度增大,30 min时达到最大。在图2(b)中可以看到,在相同温度下随着Ar的吹扫,2 170、2 117 cm-1的特征峰逐渐消失,故2 170、2 117 cm-1归属于CO的一种弱吸附。图2(a)中还出现了2 080 cm-1吸附特征峰,归属于CO的线式吸收峰,它的强度在CO的吸附过程中基本不变,吸附饱和后随着Ar吹扫时间的增加逐渐消失并向低波数方向发生了红移(见图 2(b))。2 070、2 030 cm-1处出现的线式吸收峰在吹扫过程中强度不变,从吸附能角度来讲是由于在吸附初期,吸附能一般保持较高的常数,但是在脱附过程中CO在催化剂表面的覆盖度降低,而催化剂表面的活性中心分散度较小,故吸附能增强,因此向低波数方向移动[9]。图 2(a)中 1 650、1 535 cm-1处的吸收峰归属于催化剂表面HCO-3的吸收峰,是由于CO、H2和表面OH-共同作用的结果。图2(b)中 1 367 cm-1归属于HCOO-的吸收峰,由于在载体Al2O3表面上存在不同的表面OH-,可与吸附在载体上的CO生成羧基等表面吸附态,即:CO+OH-→HCOO-,另外在Al2O3表面上不可避免地会吸附少量的水,也可促进HCOO-的生成[10]。
2.2.2 CO在Pd-Ag/Al2O3-LM-2上的原位漫反射红外光谱 CO在Pd-Ag/Al2O3-LM-2催化剂上吸附和脱附的原位漫反射红外光谱如图3所示。

图3 25℃时CO在Pd-Ag/Al2O3-LM-2上原位吸附和脱附过程的漫反射红外光谱Fig.3 Infrared diffuse reflectance spectrum of CO in-situ asorption and desorption on Pd-Ag/Al2O3-LM-2 at 25℃
由图3可见,Pd-Ag/Al2O3-LM-2催化剂的线式吸附特征峰出现在2 052 cm-1处,经相同条件下Ar吹扫后向长波数方向发生了蓝移,最终形成2 070 cm-1的线式吸附特征峰[11-15]。与Pd-Ag/Al2O3-LM-1相比,Pd-Ag/Al2O3-LM-2催化剂的线式吸附特征峰出现在较低波数的位置,且经Ar吹扫后向高波数位置发生了蓝移,这种现象可以从催化剂的结构和吸附能的角度进行解释:首先,由于催化剂的制备过程不同,导致Pd-Ag/Al2O3-LM-2催化剂的活性组分的分散度更大一些,可能会引起Pd-Ag/Al2O3-LM-2催化剂的线式吸附特征峰出现在较低波数的位置;然后,在吸附CO初期,Pd-Ag/Al2O3-LM-2催化剂的活性中心分散度较大,所以吸附能保持在一个较高的常数,但是在吹扫过程中,CO在催化剂表面的覆盖度和活性中心结合的数量会降低,所以吸附能也会降低,因此向高波数方向移动[9]。
2.2.3 CO在Pd-Ag/Al2O3-LM-3上的原位漫反射红外光谱 CO在Pd-Ag/Al2O3-LM-3催化剂上吸附和脱附的原位漫反射红外光谱如图4所示。

图4 25℃时CO在Pd-Ag/Al2O3-LM-3上原位吸附和脱附过程的漫反射红外光谱Fig.4 Infrared diffuse reflectance spectrum of CO in-situ asorption and desorption on Pd-Ag/Al2O3-LM-3 at 25℃
对比3种样品漫反射红外光谱,可以发现Pd-Ag/Al2O3-LM-3相比于Pd-Ag/Al2O3-LM-1的线式吸附在较低波数的位置(2 060 cm-1),这是由于相比于另外两种催化剂,Pd-Ag/Al2O3-LM-3催化剂表面的活性中心更加分散,且经Ar吹扫后2 080、2 060 cm-1处出现两个线式吸附特征峰,同样由于吸附能的作用吸附特征峰发生了蓝移。
选取同一时间段的CO在Pd-Ag/Al2O3-LM-1、2、3上原位吸附和脱附过程的漫反射红外光谱,结果如图5所示。由图5可以发现,不管是在吸附CO还是Ar吹扫之后都出现了HCO-3和HCOO-的吸附特征峰,且在吸附和吹扫前后其吸附强度和吸附峰的位置基本没有变化,所以吸附较稳定。的吸附特征峰是由于CO、H2和表面OH-共同作用的结果;HCOO-的吸附特征峰是由于在载体Al2O3表面上存在不同的表面OH-,可与吸附在载体上的CO生成羧基等表面吸附态,即:CO+OH-→HCOO-,另外在Al2O3表面上不可避免地会吸附少量的水,也可促进HCOO-的生成[10]。
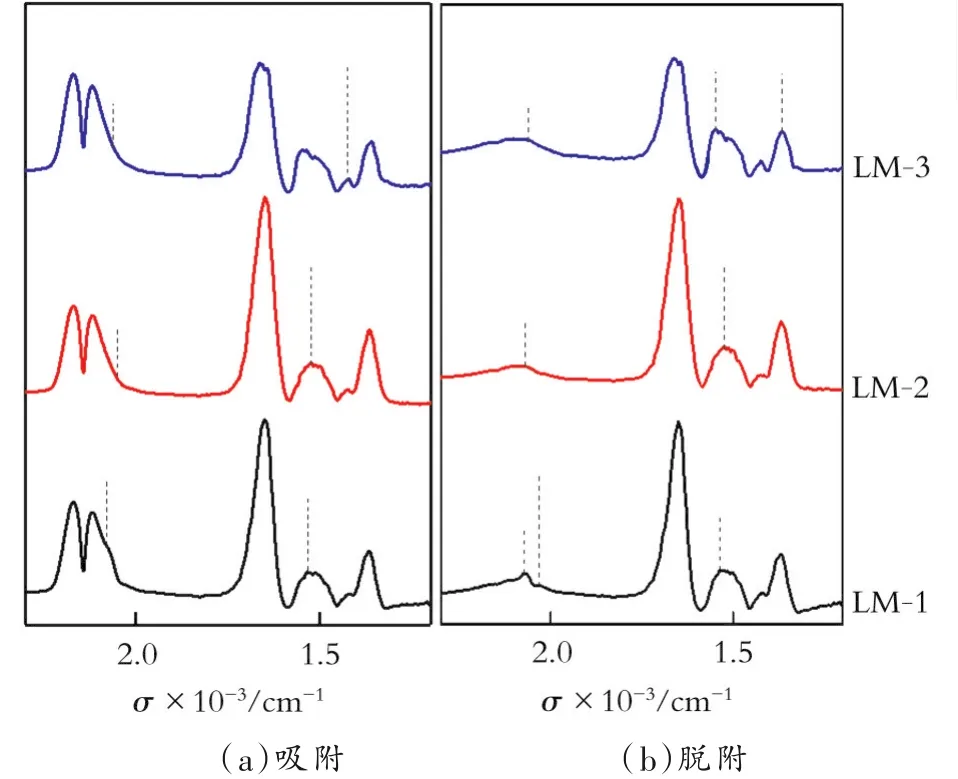
图5 25℃时CO在Pd-Ag/Al2O3-LM-1、2、3上原位吸附和脱附过程的原位漫反射红外光谱Fig.5 Infrared diffuse reflectance spectrum of CO in-situ asorption and desorption on Pd-Ag/Al2O3-LM-1,2,3 at 25℃
只要有 H2、OH-及 H2O的存在,和HCOO-的吸附特征峰就会出现,还是和催化剂的活性组分相关呢?就此在相同实验条件下做了载体Al2O3单独吸附CO的实验。Al2O3载体的作用不仅能稀释、支撑、分散催化剂活性组分,而且具有较明显的吸附剂特征。同时考察了相同条件下25℃时CO在Al2O3载体上吸附的红外漫反射光谱图和25℃时Al2O3载体吸附CO后Ar吹扫的红外光谱。发现随着吸附过程的进行,CO在载体Al2O3上逐渐形成了2 170、2 117 cm-1处气相吸收双峰,及1 642 cm-1处水的吸收峰;吸附CO 30 min后在相同温度下进行Ar吹扫,随着Ar的吹扫CO在2 170、2 117 cm-1处气相吸收双峰逐渐消失,说明CO在载体Al2O3上为弱吸附。但是并没有出现和HCOO-的吸附特征峰,为了进一步验证和HCOO-的吸附特征峰和催化剂的活性组分的相关性,在相同的实验条件下考察了CO和H2同时在载体Al2O3上吸附的红外漫反射实验,结果发现与CO单独在Al2O3载体上吸附的红外光谱一样,并没有出现和HCOO-的吸附特征峰。故和HCOO-的吸附特征峰的出现是和催化剂的活性组分相关的。
2.3 高温下CO在Pd-Ag/Al2O3-LM-1、2、3上的漫反射红外光谱
在25℃时,CO在Pd-Ag/Al2O3-LM-1、2、3催化剂上的吸附及吹扫过程只出现了良好的线式吸附,且和HCOO-的吸附特征峰在吸附和吹扫前后并没有明显的变化。将吸附温度调至40℃,脱附温度调至80℃观察吸附和脱附CO时催化剂表面物种的变化,结果如图6所示。

图6 40℃时CO在Pd-Ag/Al2O3-LM-1、2、3上原位吸附和脱附过程的漫反射红外光谱Fig.6 Infrared diffuse reflectance spectrum of CO in-situ asorption and desorption on Pd-Ag/Al2O3-LM-1,2,3 at 40℃
图6 表明,相比20℃时CO在Pd-Ag/Al2O3-LM-1、2、3上吸附的漫反射红外光谱,40℃的谱图Pd-Ag/Al2O3-LM-1、3都出现了桥式吸附特征峰1 970、1 830 cm-1;在脱附的过程中,LM-3的桥式吸附特征峰向低波数方向发生了红移至1 964、1 827 cm-1,且吸附峰强度增强,而3种催化剂的线式吸附特征峰2 080 cm-1也都发生了红移,且吸附峰强度变弱,表明CO在催化剂上的桥式吸附比线式吸附稳定,而且A.Palazov等[16]研究发现,桥式吸附的C-O伸缩振动的特征峰的位置由d轨道形成的键决定,向较低波数位移可归因于较强的金属-碳π键,它降低了C-O的强度,与李振花等[10]的研究结果一致。通过采用覆盖度的测量研究发现,这种位移是由于偶极-偶极相互作用的结果[16]。和Pd-Ag/Al2O3-LM-1、3催化剂不同的是,Pd-Ag/Al2O3-LM-2催化剂在2 000 cm-1以下并没有形成线式吸附特征峰,说明LM-2催化剂的制备顺序使催化剂的活性金属Pd形成了孤立的活性中心(Pd-Ag-Pd)结构模式,这种结构的催化剂正是目前工业需要的良好的Pd-Ag合金型单活性位点型的催化剂。对比图4和图6还可以发现,随着CO的吸附和脱附温度的升高,的特征峰强度随温度的升高相对减弱,与此同时HCOO-的吸附特征峰随温度的升高逐渐增强,两者一致的消长关系说明HCO-3在升温过程中转变为HCOO-[17]。
3 结 论
运用原位红外漫反射技术对CO在Pd-Ag/Al2O3-LM-1、2、3催化剂及载体Al2O3上吸附与转化行为进行研究,发现CO在Pd-Ag/Al2O3-LM-1、2、3催化剂上的桥式吸附比线式吸附特征峰稳定,且在升温前后CO在Pd-Ag/Al2O3-LM-2催化剂上的吸附或者脱附仅有线式特征峰生成。升高CO在Pd-Ag/Al2O3-LM-1、2、3催化剂上吸附和脱附温度发现,随着CO的吸附和脱附温度的升高,的特征峰强度随温度的升高相对减弱,与此同时HCOO-的吸附特征峰随温度的升高逐渐增强,两者一致的消长关系说明在升温过程中转变为HCOO-。
