化学沉淀法分离回收碱性溶液中V、Mo、Al的研究
2020-12-29谭佳文王嘉华宋盈盈刘志壮凌江华安会勇
谭佳文,王嘉华,宋盈盈,刘志壮,刘 美,凌江华,安会勇
(1.辽宁石油化工大学石油化工学院,辽宁抚顺113001;2.抚顺市技师学院,辽宁抚顺113001)
随着石油资源的逐渐枯竭,原油的劣质化导致二次加工量日益提高,进而引起加氢过程中催化剂的使用量急剧增加[1-2]。加氢催化剂的组分和结构在使用过程中会逐渐发生变化并最终导致催化活性下降或失效而无法继续使用,从而不得不更换新的催化剂[3-5]。因此原油质量的下降,必然会导致催化剂的更换周期大幅缩短,由此产生数量巨大的废弃加氢催化剂。对这些有毒有害废弃物处置不当,会造成严重的环境污染,并且其中所含有的贵重金属资源也会流失[6]。到目前为止,国内外研究者对废加氢催化剂的科学处置已经做了大量的工作,一些国际大公司也建立了催化剂回收装置以回收其中的有价金属[7-8]。废加氢催化剂的回收方法主要分为碱法[9]、碱焙烧-浸出法[10-11]、酸法[12-13]、熔炼法[14]、生物浸出法[15]等,其中碱焙烧-浸出法具有选择性好、回收率高、工艺简单、技术成熟等特点,是目前最佳的回收工艺之一。而采用碱焙烧-浸出法综合回收废加氢催化剂中有价金属的难点在于碱性溶液中两性金属V、Mo、Al的高效分离。
目前针对废加氢催化剂浸出液中V、Mo、Al的分离回收方法有化学沉淀法[16-18]、活性炭吸附法[19]、离子交换法[20]、溶剂萃取法[21-22]等。在这些方法中,活性炭吸附法虽然能够得到纯度较高的产物,但由于活性炭对V、Mo的负载容量较低,因此难以工业化应用;虽然溶剂萃取法对V、Mo具有很高的选择性 ,例 如 Cyanex 272[23]、Alamine 336[24]、Aliquat 336[25]、LIX 84[26]等萃取剂都能从酸性或近中性含有高Al浓度的溶液中选择性地提取分离V、Mo,但是目前尚未有有效分离强碱性溶液中V、Mo、Al的萃取剂;离子交换法虽然能够从碱性溶液中深度分离V、Mo离子,但其过程较为复杂且效率低,目前仍仅限于实验室阶段。化学沉淀法成本较低、操作简单、工艺成熟,同时可以结合其他分离方法获得高纯度的V、Mo产品,因此依然是工业上运用最多的V、Mo分离工艺。
本研究采用化学沉淀法,以CaCl2、Ba(OH)2为沉淀剂从强碱性V-Mo-Al溶液中分步沉淀回收V、Mo,通过热力学理论计算预测与条件实验相结合的方法考察沉淀剂物质的量、温度、pH、沉淀时间等因素对碱性溶液中V、Mo沉淀分离的影响,从而为废加氢催化剂碱性焙烧-水浸工艺浸出液中V、Mo、Al的分离回收提供理论支撑和工艺参数。
1 实验部分
1.1 实验方法
废加氢催化剂为运转后失去活性的重油加氢脱硫催化剂,主要成分为Mo、V、Al、N(i质量分数分别为6.233%、4.095%、36.270%、5.126%)以及少量S、P、Si、Fe、Co、Cu等。采用碱性焙烧-浸出工艺将废加氢催化剂在高温下与碳酸钠反应并在热水中浸出,得到的浸出液中含有多种离子,其中Mo、V、Al主要以(2.5~5.0 g/L)(1.5~3.2 g/L)、(0.2~4.0 g/L)等离子形式存在,此外溶液中还含有低浓度的Fe、P、Si、Ni等离子。为了避免其他杂质离子的影响,在实验过程中采用NaAlO2、NaVO3、Na2MoO4、NaOH 配置 V-Mo-Al碱性溶液模拟废加氢催化剂碱性浸出液。首先采用CaCl2为沉淀剂,从V-Mo-Al溶液中优先沉淀V,过滤分离后再在溶液中加入沉淀剂Ba(OH)2,去除Mo以及少量的V。在实验过程中通过改变时间、温度、沉淀剂物质的量、溶液pH等条件来优化化学沉淀法分离V、Mo、Al的工艺参数。
1.2 分析方法
溶液中各离子的浓度通过电感耦合等离子体光谱仪(ICP-OES,Optima 8000,Perkin Elmer)进行测定。
2 结果与讨论
2.1 V、Mo沉淀分离的热力学分析
V(Ⅴ),Mo(Ⅵ)在水溶液中的存在形式非常复杂,如 V(Ⅴ)会以等多种离子存在,而溶液中V(Ⅴ)的具体存在形态及所占比例取决于V的总浓度和溶液pH,因此当沉淀剂在水溶液中与V(Ⅴ)、Mo(Ⅵ)反应时会受V、Mo浓度和pH的影响,从而得到的产物会不尽相同[26-27]。本研究结合浓度对数-pH图和实验条件对相应溶液体系进行热力学分析研究,为V、Mo的分离条件提供理论指导。
2.1.1 Ca-V(Ⅴ)-H2O体系V离子分布的理论分析 图1为根据25℃下Ca2+与V(Ⅴ)离子在水溶液中的热力学计算结果绘制的浓度对数-pH图。

图1 不同游离总Ca浓度下V-Ca-H2O体系的lg[V]T-pH图Fig.1 lg[V]T-pH equilibrium diagram for V-Ca-H2O system at different total free calcium concentrations
由图1可以看出,随着溶液pH的增大,在碱性范围内依次出现了Ca(VO3)2、Ca3(VO4)2两个沉淀稳定区,当沉淀V反应后游离总Ca浓度为0.01 mol/L时,pH在5.1~9.8,V以Ca(VO3)2形式沉淀,V的最低浓度可降至2×10-3mol/L;pH在9.8~14.0,V以Ca3(VO4)2的形式沉淀,V的最低浓度可降至2×10-4mol/L,相对而言,理论最佳沉淀V pH维持在11.0~13.0。另外,沉V后溶液中游离Ca的浓度对沉淀V效果有较大影响,游离Ca离子的浓度越高,溶液中V的离子浓度越低,因此为了提高沉淀率需要加入过量CaCl2。
2.1.2 Ba-Mo(Ⅵ)-H2O体系Mo离子分布的理论分析 根据热力学数据绘制出沉淀体系中Mo的浓度对数-pH图,如图2所示。

图2 不同游离总Ba浓度Mo-Ba-H2O体系的lg[Mo]T-pH图Fig.2 lg[Mo]T-pH equilibrium diagram for Mo-Ba-H2O system at different total free barium concentrations
由图2可以看出,Mo在水溶液中各种离子的存在形态和比例会随着溶液pH和总游离Ba浓度的改变而发生变化。在pH<3.8时,Mo以H2MoO4形式存在;pH升高至3.8~6.0时,Mo主要以式存在,溶液中开始有大量BaMO4沉淀生成;在此之后,随着pH的不断增大,Mo的离子存在形态不再发生改变,BaMoO4沉淀量也趋于稳定;因此Ba盐沉淀Mo应在偏碱性范围。此外,溶液总游离Ba的浓度对Mo离子浓度和BaMoO4沉淀量有一定的影响,如当[Ba]T由0.001 mol/L提高至0.01 mol/L,溶液中MoO2-4的浓度减少,而BaMoO4的沉淀量增加,因此沉淀Mo时Ba盐需要适当过量,以提高沉淀率。
2.2 反应条件对CaCl2沉V的影响
以CaCl2沉淀分离V-Mo-Al体系中的V,通过改变反应温度、CaCl2物质的量、反应时间、溶液pH以考察沉淀剂沉淀V的效果。
2.2.1 反应温度对沉淀率的影响 当n(Ca-Cl2)实际/n(CaCl2)理论=0.9,反应时间 1 h,溶液 pH 为12.8时,考察反应温度对各金属沉淀率的影响,结果如图3所示。
由图3可见,随着温度的升高,V的沉淀先稍有降低,后逐渐升高,在80℃时达到最大值86.59%,且在此温度下,Mo和Al的沉淀率达到最低,分别为1.14%和11.64%。在此条件下,由于CaCl2的物质的量较低导致V的沉淀率偏低。
2.2.2n(CaCl2)实际/n(CaCl2)理论对沉淀率的影响 固定反应温度为80℃,反应时间1 h,溶液pH为12.8时,调节CaCl2的物质的量以考察其对各金属沉淀率的影响,结果见图4。由图4可以看出,随着沉淀剂物质的量的增加,V的沉淀率逐渐增加。n(Ca-Cl2)实际/n(CaCl2)理论为 1.1、1.2 时 ,沉 淀 率 分 别 为94.08%和95.80%。Mo和Al的沉淀率先稍有降低后缓慢升高,当n(CaCl2)实际/n(CaCl2)理论超过 1.1时,沉淀率达到最低值,分别为8.52%和21.07%。
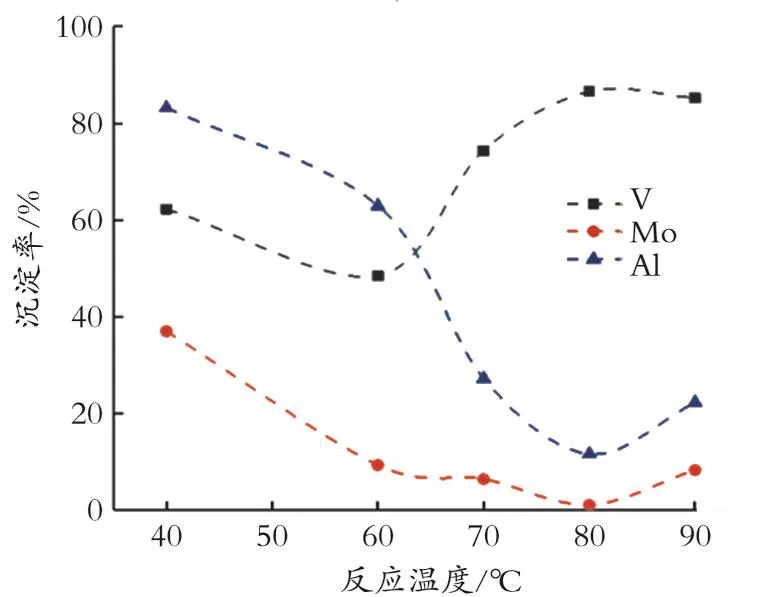
图3 反应温度对CaCl2沉淀V的影响规律Fig.3 Influence of reaction temperature on vanadium precipitate of CaCl2

图4 沉淀剂物质的量对CaCl2沉淀V的影响规律Fig.4 Influence of precipitant dosage on vanadium precipitate of CaCl2
2.2.3 反应时间对沉淀率的影响 当n(Ca-Cl2)实际/n(CaCl2)理论=1.1,反应时间 1 h,溶液 pH 为12.8时,考察反应时间对各金属沉淀率的影响,结果如图5所示。由图5可知,V的沉淀率随着反应时间的延长而增加,而Mo和Al的沉淀率随时间延长而降低,当超过1 h后趋于平稳,且此时V的沉淀率较高,而Mo和Al的沉淀率较低,因此选取1 h为较佳反应时间。
2.2.4 溶液pH对沉淀率的影响 当n(Ca-Cl2)实际/n(CaCl2)理论=1.1,反应时间 1 h 时,考察 pH对各金属沉淀率的影响,结果如图6所示。由图6可见,pH在8~13时,V的沉淀率从82.83%升高至95.31%,而Mo和Al的沉淀率稍有降低,这与理论计算的预测相符,根据实验结果确定较佳沉淀溶液pH为12.9。
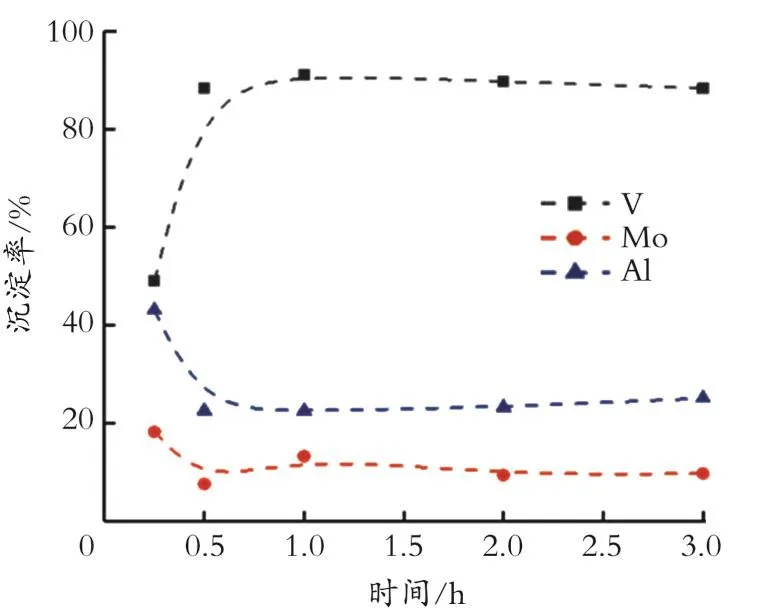
图5 反应时间对CaCl2沉淀V的影响规律Fig.5 Influence of reaction time on vanadium precipitate of CaCl2

图6 溶液pH对CaCl2沉淀V的影响规律Fig.6 Influence of pH value on vanadium precipitate of CaCl2
综上所述,以CaCl2沉淀V的最佳条件为:温度80 ℃,n(CaCl2)实际/n(CaCl2)理论=1.1,反应时间 1 h,pH为12.9,在此条件下,V的回收率达到95.3%,其中沉淀Mo和Al的掺杂率分别为13.1%、9.8%。
2.3 反应条件对Ba(OH)2沉淀Mo的影响
采用Ba(OH)2沉淀分离除V后溶液中的Mo离子。通过改变反应温度、Ba(OH)2物质的量、反应时间以考察沉淀剂沉淀Mo的效果。根据Mo的浓度对数-pH图可知,在pH为6~12时,BaMoO4的沉淀量趋于平稳,因此没有考察pH对Mo沉淀率的影响。
2.3.1 反应温度对沉淀率的影响 当Ba(OH)2添加量为理论物质的量,沉淀时间1 h时,考察反应温度对各金属沉淀率的影响,结果如图7所示。
由图7可知,温度对各金属离子的沉淀率影响不大,其中V的沉淀率由95.11%降低至92.80%,Mo的沉淀率由11.98%升高至32.14%。Mo的沉淀率要低于V,可能是由于Ba(OH)2的添加量不足,因此有必要考察Ba(OH)2添加量对Mo沉淀率的影响。

图7 反应温度对Ba(OH)2沉淀Mo的影响规律Fig.7 Influence of reaction temperature on molybdenum precipitate of Ba(OH)2
2.3.2n(Ba(OH)2)实际/n(Ba(OH)2)理论对 沉 淀率 的 影响 当反应温度为80℃,沉淀时间1 h时,调节n(Ba(OH)2)实际/n(Ba(OH)2)理论以考察其对各金属离子沉淀率的影响,结果如图8所示。

图8 沉淀剂物质的量对Ba(OH)2沉淀Mo的影响Fig.8 Influence of precipitant dosage on molybdenum precipitate of Ba(OH)2
由图 8 可 知 ,当n(Ba(OH)2)实际/n(Ba(OH)2)理论增加时,Mo的沉淀率急剧增加,在其实际物质的量为理论物质的量的2.5倍时,Mo的沉淀率达到99.6%,即溶液中Mo基本被沉淀完全,而此时V和Al的沉淀率也相对较低。
2.3.3 反应时间对沉淀率的影响 当反应温度为 80 ℃,n(Ba(OH)2)实际/n(Ba(OH)2)理论=2.5 时,考察反应时间对各金属沉淀率的影响,结果见图9。
由图9可知,反应时间对各金属的沉淀率的影响不大,为了尽量提高Mo的沉淀回收率,可选取60 min为较佳反应时间。
综上所述,以Ba(OH)2沉淀Mo的最佳条件为:温度 80 ℃,n(Ba(OH)2)实际/n(Ba(OH)2)理论=2.5,时间60 min,在此条件下,Mo的回收率达到99.6%,其中沉淀中V和Al的掺杂率分别为3.0%、12.1%。

图9 反应时间对Ba(OH)2沉淀Mo的影响规律Fig.9 Influence of reaction time on molybdenum precipitate of Ba(OH)2
3 结 论
(1)热力学的理论分析表明,Ca-V(Ⅴ)-H2O体系中理论最佳沉淀V的pH在11~13,V以Ca3(VO4)2的形式沉淀,为了提高V的沉淀率需要加入过量CaCl2;Ba-Mo(Ⅵ)-H2O体系中pH>6后,Mo离子存在形态不发生改变,BaMoO4沉淀量也趋于稳定,且溶液中游离Ba离子浓度越高,越有利于Mo的沉淀。
(2)以 CaCl2沉淀 V,当反应温度为 80℃,n(CaCl2)实际/n(CaCl2)理论=1.1,反应时间为 1 h,pH 为12.9时,V的沉淀回收率达到95.3%
(3)以 Ba(OH)2沉淀 Mo,当温度为 80 ℃,n(Ba(OH)2)实际/n(Ba(OH)2)理论=2.5,沉淀时间为 60 min时,Mo的沉淀回收率达到99.6%。
(4)碱性V-Mo-Al溶液经CaCl2沉淀V、Ba(OH)2沉淀Mo后,溶液中仍含有少量Mo和V,且各步沉淀的产物中也含有一定量的杂质,因此为得到高纯度的相关产品需要进一步的提纯净化。化学沉淀法可以作为碱性溶液中V、Mo、Al的初步分离,从而达到提高效率,节约成本的效果。
