质谱蛋白质组学研究中草莓雌蕊蛋白提取方法优化
2020-12-29裘劼人柴伟国童建新周历萍王淑珍
裘劼人, 柴伟国, 童建新, 周历萍, 王淑珍
(杭州市农业科学研究院,浙江 杭州 310024)
蛋白质组学作为连接转录组学和代谢组学的桥梁,是系统生物学的重要组成部分。近年来,质谱因其高通量和高分辨率的特性成为复杂蛋白质样品分析的首选方法,基于质谱的蛋白质组学已经成为解读基因组编码信息的一项必不可少的技术[1]。由于蛋白种类的千变万化,不同组织蛋白质组成各有特点,在进行蛋白质组学实验时需要根据组织样本的特点选择合适的提取方法。如提取人树突状细胞蛋白时,纯丙酮沉淀法比三氯乙酸/丙酮沉淀法更有效,约提升了28%的蛋白鉴定量[2]。而植物细胞一般富含色素、多酚等次生代谢物,在蛋白酶解时起干扰作用,因此提取植物蛋白时需进行更繁复的纯化程序。目前常用的适用于质谱分析的植物蛋白提取方法主要为三氯乙酸/丙酮法和酚提法[3]。
草莓(Fragaria×ananassaDuch.)因其香甜的口感和丰富的营养元素而深受消费者青睐,是重要的经济作物。杂交授粉是草莓育种的常用手段,而雌蕊可授性强弱是杂交成功的重要影响因素。发育成熟的草莓雌蕊柱头表面覆有一层亲水蛋白膜,经研究报道可能与花粉识别和萌发相关,因此可采用蛋白质组学方法研究雌蕊可授性[4]。非数据依赖性采集(data-independent acquisition, DIA)质谱技术,是一种高效稳定的非标记蛋白质组研究方法[5]。本研究拟对传统蛋白提取方法进行优化并利用DIA技术评价筛选出一种适用于质谱分析的草莓雌蕊蛋白提取方法,为草莓雌蕊蛋白质组学研究与育种应用提供技术基础。
1 材料与方法
1.1 实验材料
实验用草莓品种为红颊(Benihoppe),于2020年3月上旬在杭州市农业科学研究院生物技术所草莓试验基地采取。取开花第一天的草莓花,150朵混成1个重复,每种方法设3个重复。去花柄、萼片、雄蕊,取雌蕊组织称取鲜重(约0.5 g)后立即置于液氮冷冻保存。
1.2 实验方法
1.2.1 蛋白提取
雌蕊组织液氮下研磨成粉,分别采用三种方法进行蛋白提取:三氯乙酸/丙酮沉淀法(方法Ⅰ)、酚提法(方法Ⅱ)和酚氯仿法(方法Ⅲ)。三氯乙酸/丙酮沉淀法和酚提法依照文献[6]步骤进行。酚氯仿法步骤如下:
取0.2 g研磨好的粉末转移至2 mL离心管,加入800 μL 4 ℃预冷的提取液(含0.7 mol·L-1蔗糖、0.1 mol·L-1氯化钾、0.5 mol·L-1Tris、2%巯基乙醇和50 mmol·L-1EDTA的水溶液, 盐酸调至pH 8.0),旋涡30 s混匀;再加入800 μL 4 ℃预冷的Tris饱和酚(pH 8.0)抽提,得到细胞沉淀和溶液层。溶液层又分为3层,从上至下依次为酚层、中间层和水层。吸取最上层酚层约600 μL至新的2 mL离心管,加入600 μL提取液进行抽提,再取最上层酚层约400 μL至10 mL离心管。吸取中间层和水层至另一新的2 mL离心管,加入800 μL氯仿进行抽提。此时溶液最上层为水层,中间层含部分蛋白,最下层为氯仿。吸取最上层水层丢弃,将中间层和最下层氯仿层转移到上述的10 mL离心管与酚层合并,此时离心管内溶液总体积约为1.2 mL。在10 mL离心管中加入6 mL-20 ℃预冷的0.1 mol·L-1醋酸铵甲醇,-20 ℃沉淀过夜,5 000×g离心30 min弃上清。沉淀经-20 ℃预冷的甲醇清洗3次,于-70~-20 ℃冻干至恒重成蛋白粉。
蛋白粉加入400 μL裂解液(8 mol·L-1尿素,0.1 mol·L-1Tris-HCl,1 mmol·L-1PMSF(苯甲基磺酰氟),pH 8.0),涡旋30 s,置于0 ℃冰水浴中,以1 000 kJ能量、超声3 s间歇5 s的模式超声2 min至蛋白粉完全溶解。溶解液在4 ℃ 14 000×g离心20 min取上清即为蛋白溶液。
1.2.2 蛋白酶解
蛋白溶液采用Bradford试剂盒(碧云天,上海)定量,取200 μg蛋白还原烷基化后转移至Amicon-Ultra-15超滤管(Merck Millipore,美国),按说明书除杂,加入含4 μg胰酶(Promega,美国)的100 mmol·L-1NH4HCO3(pH 8.0)缓冲液,37 ℃反应12~16 h。酶解完成后于4 ℃、 12 000×g离心15 min,用200 mmol·L-1NH4HCO3(pH 8.0)清洗2次,即得肽段溶液。肽段溶液中加入5%三氟乙酸(Thermo Fisher Scientific,美国)至终浓度为0.1%~1.0%,以PierceTMC18 Tips(Thermo Fisher Scientific,美国)除盐后冻干,复溶于200 μL 0.1%甲酸水。
1.2.3 DIA质谱分析
酶解后所有样本取10 μL肽段混合,混合样本中加入1 μL 10×iRT标准肽段溶液(Biognosys,瑞士),按本课题组前期优化的二维液质联用方法建立肽段谱图数据库[7]。每个样本再各取10 μL分别进行反向色谱串联DIA质谱分析。
反向色谱分离梯度:0~3 min,4%~7% Buffer B;3~103 min,7%~18% Buffer B;103~113 min,18%~35% Buffer B;113~117 min,35%~75% Buffer B;117~120 min,75% Buffer B(Buffer A,0.1%甲酸水溶液;Buffer B,0.1%甲酸乙腈溶液)。质谱设置参数:扫描时间120 min,离子模式正离子,一级质谱分辨率70 000 atm/z200,最大注入时间50 ms,扫描范围 350~1 300m/z;二级扫描分辨率17 500 atm/z200;碰撞能量27%,分设30个隔离窗口,为350~381、381~398、398~415、415~432、432~444、444~456、456~468、468~480、480~492、492~504、504~516、516~528、528~540、540~552、552~564、564~576、576~592、592~608、608~624、624~640、640~656、656~672、672~688、688~712、712~736、736~766、766~806、806~856、856~926、926~1 300m/z。
1.2.4 数据分析
蛋白提取得率通过Microsoft Excel 2016统计,并利用GraphPad Prism(v. 8.0.1)进行两两比较单因素方差分析。质谱原始数据通过Spectronaut PulsarⅩ(Biognosys, 瑞士)进行蛋白鉴定,通过保留时间和质量窗口的校正决定理想的提取窗口,与谱图库进行匹配,蛋白质定性标准:母离子阈值1.0% FDR,蛋白阈值1.0% FDR。采用jvenn包进行韦恩图分析蛋白交集情况[8],并利用Deeploc (v. 1.0)进行非共有蛋白的亚细胞定位预测[9],利用在线工具(http://www.bioinformatics.orgsms2protein_gravy.html)评估非共有蛋白的总平均亲水性(grand average of hydropathicity,Gravy)[10]。
2 结果与分析
2.1 蛋白提取得率比较
方法Ⅰ三次重复的总蛋白提取得率分别为0.21%、0.22%和0.19%,平均得率0.20%;方法Ⅱ三次重复的总蛋白提取得率分别为0.11%、0.12%和0.12%,平均得率0.12%;方法Ⅲ三次重复的总蛋白提取得率分别为0.26%、0.27%和0.27%,平均得率0.27%(图1)。此试验结果显示,方法Ⅲ的蛋白提取效率最高,而方法Ⅱ效率最低。
2.2 蛋白鉴定通量比较
三种方法提取得到的蛋白酶解后混合上机建立肽段谱图库,共鉴定到6 577个蛋白,25 895个肽段。三种方法鉴定蛋白的韦恩图(图2)结果表明,方法Ⅰ3次重复分别鉴定到4 876、4 826和4 869个蛋白,总共鉴定到5 170个蛋白;方法Ⅱ3次重复分别鉴定到5 082、4 995和5 056个蛋白,总共鉴定到5 345个蛋白;方法Ⅲ 3次重复分别鉴定到5 439、5 509和5 511个蛋白,总共鉴定到5 697个蛋白。
总鉴定蛋白的韦恩图分析显示,4 864个蛋白在3种方法中均有鉴定到,为共有蛋白。方法Ⅰ另外鉴定到的306个非共有蛋白中,有255个蛋白与方法Ⅲ有交集;方法Ⅱ鉴定到的481个非共有蛋白中,有421个蛋白与方法Ⅲ有交集;157个蛋白仅在方法Ⅲ鉴定到,35个蛋白仅在方法Ⅰ中鉴定到,44个仅在方法Ⅱ中鉴定到。由此可看出,方法Ⅲ提取的蛋白鉴定通量最高,并且交集到了方法Ⅰ和方法Ⅱ提取到的大部分非共有蛋白中,是提取最全面的方法。
2.3 非共有蛋白的亚细胞位置分析
方法Ⅰ、Ⅱ、Ⅲ鉴定到的非3组共有蛋白数分别为306、481和833,按照提取方法分别对各自的非共有蛋白进行亚细胞定位预测分析,并统计各个细胞位置分布的蛋白数和占比。结果显示(表1),3种方法提取的细胞质蛋白在各自鉴定到的非共有蛋白中占比差异不大,分别为23.20%、23.91%、22.83%;而细胞核蛋白占比则变化较大。方法Ⅰ提取的细胞核蛋白数量在其鉴定到的非共有蛋白中占比37.58%,与占比第二的细胞质蛋白相差约14%,这个差距在3种方法中最高;而方法Ⅱ中细胞核蛋白仅占16.74%,且其绝对数量在3种方法中也最低,线粒体、内质网、高尔基体、液泡、细胞膜蛋白则相比方法Ⅰ有显著提升;方法Ⅲ中细胞核蛋白占比最大为27.47%,但与细胞质蛋白占比相差不大。方法Ⅲ提取的总蛋白数最多,分布到各亚细胞位置的绝对数量也均在3种方法中居首,大多数位置上均超过前2种方法的蛋白总和。
由此可知,3种方法对细胞蛋白的提取具有一定的位置偏好性,方法Ⅰ偏好细胞核蛋白的提取;而方法Ⅱ细胞核蛋白比例偏低,更偏向内质网、高尔基体等其他细胞器蛋白的提取;相对前两种方法,方法Ⅲ提取的非共有蛋白较全面,在各细胞位置分布较为平衡。
2.4 非共有蛋白的亲疏水性分布
总平均亲水性Gravy值用以评价蛋白的亲疏水性,Gravy值为正的蛋白为疏水性蛋白,为负则是亲水性蛋白。对非共有蛋白的Gravy值进行计算,并以0.5为一个区段进行分布统计,结果显示(图3):三种方法提取到的草莓雌蕊蛋白均以亲水性蛋白为主,方法Ⅰ提取的非共有蛋白中亲疏水蛋白比例分别为93.5%和6.5%,其中强亲水性蛋白(Gravy值<0.5)有153个;方法Ⅱ提取的非共有蛋白中亲疏水蛋白比例分别为74.9%和25.1%,相较方法Ⅰ,亲水性蛋白比例下降明显,且强亲水性蛋白绝对量也仅为103个;而方法Ⅲ中非共有蛋白亲疏水性蛋白占比分别为81.8%和18.2%,比例介于前两者之间,但各区段蛋白分布数量均高于前两者,其中强亲水性蛋白283个。
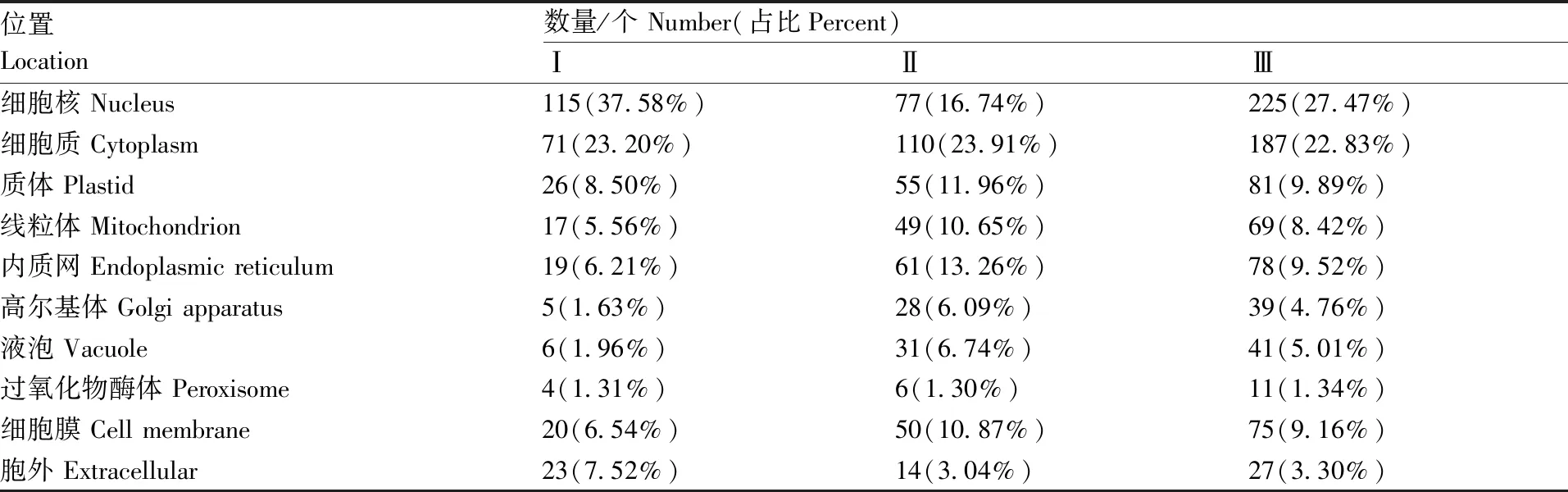
表1 三种方法鉴定的非共有蛋白亚细胞位置分布
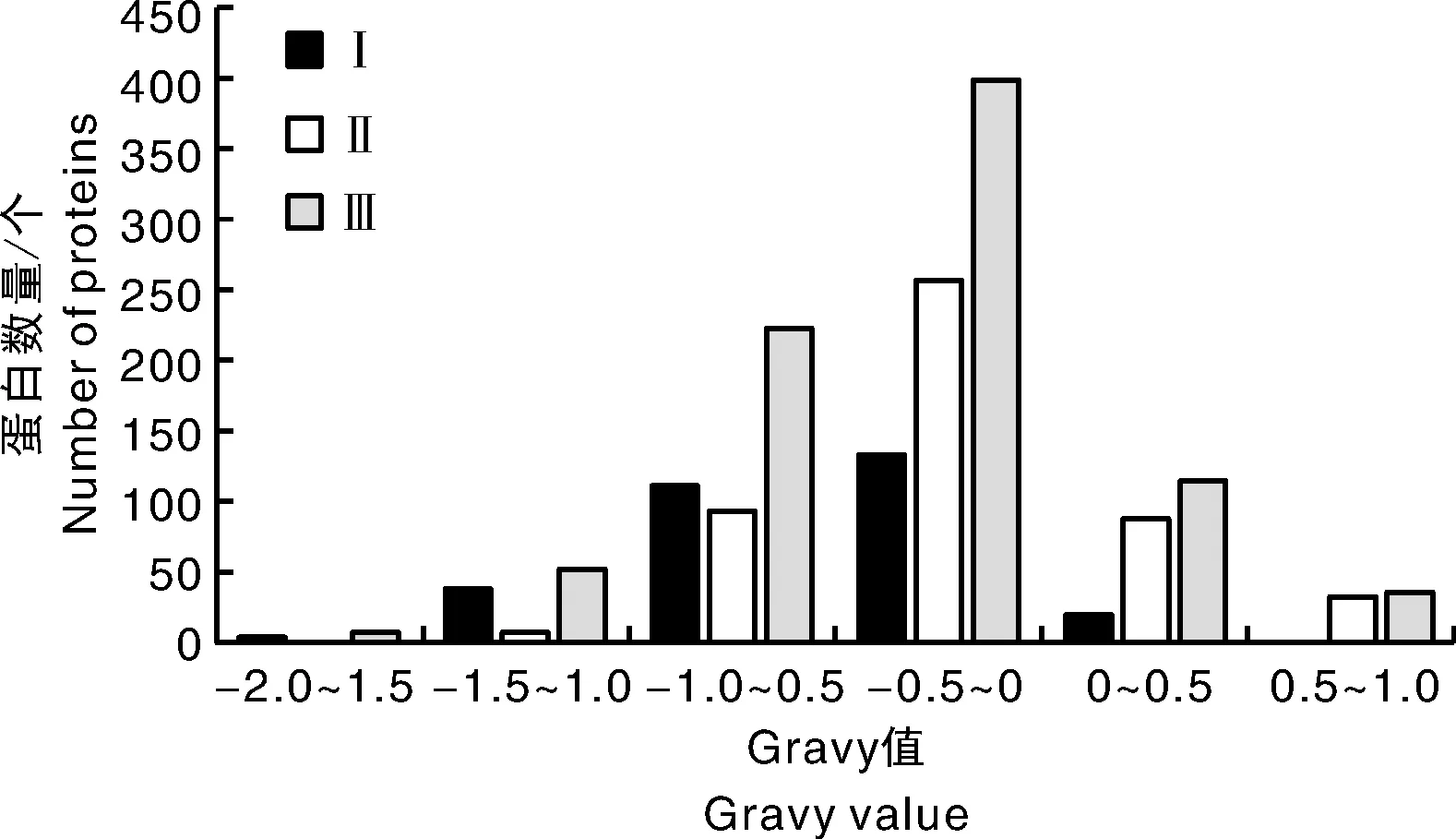
图3 非共有蛋白Gravy值分布图Fig.3 Histogram of Gravy value distribution of non-shared proteins
3 讨论
三氯乙酸/丙酮沉淀法和酚提法是传统常用的植物组织蛋白提取方法,酚氯仿法则是对酚提法的优化。本研究结果表明,两种传统方法中,三氯乙酸/丙酮法的总蛋白提取得率高于酚提法,约为后者的1.67倍,但质谱鉴定通量不及后者,这与Jin等[11]在棉花叶片蛋白提取上的试验结果相符;提取蛋白种类方面,三氯乙酸/丙酮法中细胞核和强亲水性蛋白的提取比例较高、疏水性蛋白提取能力较弱,而酚提法中细胞核和亲水性蛋白提取能力下降、疏水性和内质网等其他细胞器蛋白比例提升。
本研究借鉴核酸提取时去除蛋白杂质的原理,通过在传统酚提法中加入氯仿提取步骤,建立了新的酚氯仿抽提蛋白方法。在传统酚提法中,组织细胞中的蛋白首先溶入提取液水层,再经酚抽提变性溶入酚层后,用甲醇沉淀纯化并浓缩[12]。但由于酚与水能部分互溶(常温下约8 g酚溶于100 g水),水层中仍有少量酚和强亲水性蛋白残留[13]。核酸提取时,常用酚氯仿混合物萃取含有核酸的水相,去除水相中的蛋白。氯仿在其中除了变性蛋白外,还起进一步萃取酚进入氯仿层、加速水相和酚相分离的作用[14]。酚提取后加入氯仿抽提步骤,预计将增加亲水性尤其是强亲水性蛋白的提取比例,本研究结果支持了这一预测。相比酚提法,酚氯仿法提取的亲水性蛋白比例提升了6.9%,其中强亲水性蛋白增加180个,超过了三氯乙酸/丙酮沉淀法的亲水性蛋白提取容量,并同时保留了酚提法提取疏水性蛋白能力较高的特点,因此其蛋白提取得率和鉴定通量在3种方法中均为最高。以往的研究中注重氯仿的疏水属性,常以氯仿/甲醇组合直接抽提细胞以进行疏水性和脂溶性蛋白的提取,如Vertommen等[15]用氯仿/甲醇法进行了香蕉叶片膜蛋白的提取;而本研究结果显示,氯仿与酚组合还可以促进亲水性蛋白的提取,弥补酚提法亲水性蛋白提取能力较弱的不足。
本研究利用DIA技术对3种方法——三氯乙酸/丙酮沉淀法、酚提法和酚氯仿法提取草莓雌蕊蛋白的适用性进行了评估。通过总蛋白提取得率、蛋白鉴定通量、非共有蛋白亚细胞位置和亲疏水性分布4个方面的综合评价得出,3种方法中酚氯仿法的提取效率最高,蛋白提取最全面。酚氯仿法综合了两种传统方法的特点,提取到了两者大部分的非共有蛋白,兼顾了亲疏水性和各细胞位置蛋白的提取,其提取得率、鉴定通量、蛋白种类相比两种传统方法均有显著提升,为最优提取方法。本研究结果为草莓雌蕊组织蛋白质组学研究选择合适的蛋白提取方法提供了依据,为后续草莓雌蕊可授性机理研究奠定了技术基础。
