辣椒疫病抗性的浸根接种鉴定方法
2020-12-28赫卫张慧
赫卫 张慧

摘要 为建立规模化的辣椒疫病苗期抗性鉴定技术,将辣椒疫霉人工接种于抗疫病辣椒品种‘ICPN21-03和感病辣椒品种‘B16144,研究了接种菌液浓度、接种时期、病情调查时期和接种方法等对人工接种鉴定效果的影响。结果表明,接种菌液游动孢子浓度为10个/mL时,感病品种病情指数为73.37,可以满足寄主发病的需要;1 ~ 10真叶期接种均能使植株发病,但5 ~ 6真叶期接种能反映抗感病品种真实抗性;接种5 d调查抗感病品种病情指数分别为9.32和73.37,可明显区别抗感病品种。使用浸根法进行鉴定,需菌量小,对接种环境要求小。用37个辣椒品种进行验证,鉴定结果表明该苗期抗性鉴定技术可很好地对辣椒品种进行抗性水平分级鉴定。
关键词 辣椒; 疫病; 抗性鉴定
中图分类号: S 436.418.1
文献标识码: A
DOI: 10.16688/j.zwbh.2019520
Abstract In order to develop a technique for large-scale assessment of the resistance of pepper materials to Phytophthora blight by using artificial inoculation with Phytophthora capsici, the parameters of the inoculation system including levels of inocula, growth stage of seedlings, investigation time and inoculation methods were studied by using ‘ICPN21-03 (resistant to blight) and ‘B16144 (susceptible to blight) in the laboratory. The results showed that the actual levels of plant resistance could be identified at 10 zoospores/mL, in which the disease index of ‘B16144 was 73.37. The true resistance of the varieties could be identified in the seedlings at 5-6-leaf stage, while it could cause Phytophthora blight from 1-leaf to 10-leaf stages. The disease indices of ‘ICPN21-03 and ‘B16144 were 9.32 and 73.37, respectively, 5th day of inoculation, which clearly distinguished between the resistant and susceptible varieties. The efficiency of inoculation by using root-soaking method was well, in which the inoculum concentration and the requirements for inoculation environment were low. The technique was verified by inoculation of 37 pepper varieties. The results suggest that the established assessment system is able to identify the level of plant resistance to P.capsici in pepper seedlings.
Key words pepper; Phytophthora capsici; resistance identification
辣椒是全球第一大蔬菜,疫病是辣椒的主要病害,是由疫霉Phytophthora capsici L.引起的毀灭性真菌病害。控制疫病有多种方式,可以利用分子生物学寻找致病相关基因,如SDA1[1]、CaSBP12[2]等。也可以利用化学药剂防治,如Tian等[3]合成了16种麦芽酚磺酸盐衍生物,并分别在体外测定了它们对辣椒疫霉的抗菌活性。Wang等[4]对菜籽粕的生物熏蒸和棉隆的化学熏蒸进行了测试,发现生物熏蒸通过改变土壤微生物群落结构降低了辣椒疫病的发病率。选育和利用抗病品种是防治辣椒疫病最直接、安全、高效的措施之一,有着减少农药使用,减少对空气、水和土壤的污染,降低农残等优点。筛选抗病种质资源一直是抗病育种的重要基础工作。灌根法是目前最常用的辣椒疫病鉴定方法。谭清群等[5]对24份贵州省辣椒新品种、关天舒等[6]对国内外217份辣椒材料分别采用灌根法鉴定其对疫病的抗性。或者采用果实鉴定法,Naegele等[7]使用果实接种鉴定了来自五大洲45个国家的170种辣椒基因型的疫病抗性。研究人员也在尝试采用分子手段鉴定辣椒品种的疫病抗性。Liu等[8]找到标记Phyto5NBS1,可用于鉴定疫病抗性相关的5号染色体上主要QTL。Yu等[9]开发了一种基于侧流层析试纸条的重组酶聚合酶扩增(LF-RPA)的新型检测方法,用于快速,无设备检测辣椒疫霉。本文介绍了一种浸根法,其优点在于简便易行、需菌量小、无接种环境要求、真实反映系统抗性等,是大规模接种鉴定辣椒疫病的可行方法。
1 材料与方法
1.1 试验材料
辣椒抗病品种‘ICPN21-03和感病品种‘B16144,以及人工接种鉴定所用35份辣椒材料,均由黑龙江省农业科学院园艺分院提供。辣椒播种前进行种子消毒处理,用52~55℃的温水浸种30 min,10%次氯酸钠溶液浸泡5 min,清水冲洗后浸种催芽,播种于育苗钵内。育苗基质为蛭石∶草炭∶土壤=1∶2∶1,134℃ 灭菌30 min后备用。
1.2 疫霉培养
将辣椒疫霉菌种接种在燕麦固体培养基上,在25~28℃暗培养7 d,然后在25~28℃,L∥D=16 h∥8 h培养7 d诱发孢子囊。用无菌水冲洗菌体获得悬浮液,悬浮液4℃放置30 min,孢子囊破裂,释放游动孢子,在显微镜100倍物镜下观察,有透明的游动孢子释放出来即可用于接种。
1.3 接种
采用浸根法接种。辣椒苗根部用无菌水冲洗干净,然后用吸水纸拭去表面的水分。50 mL锥形瓶内加入菌液30 mL,每个锥形瓶内插入6株苗,置于温度28℃光照16 h,25℃黑暗8 h的植物培养箱内,在侵染期间锥形瓶内水缺少时,补充无菌水。每个处理30株苗以上,3次重复,以水处理为对照。
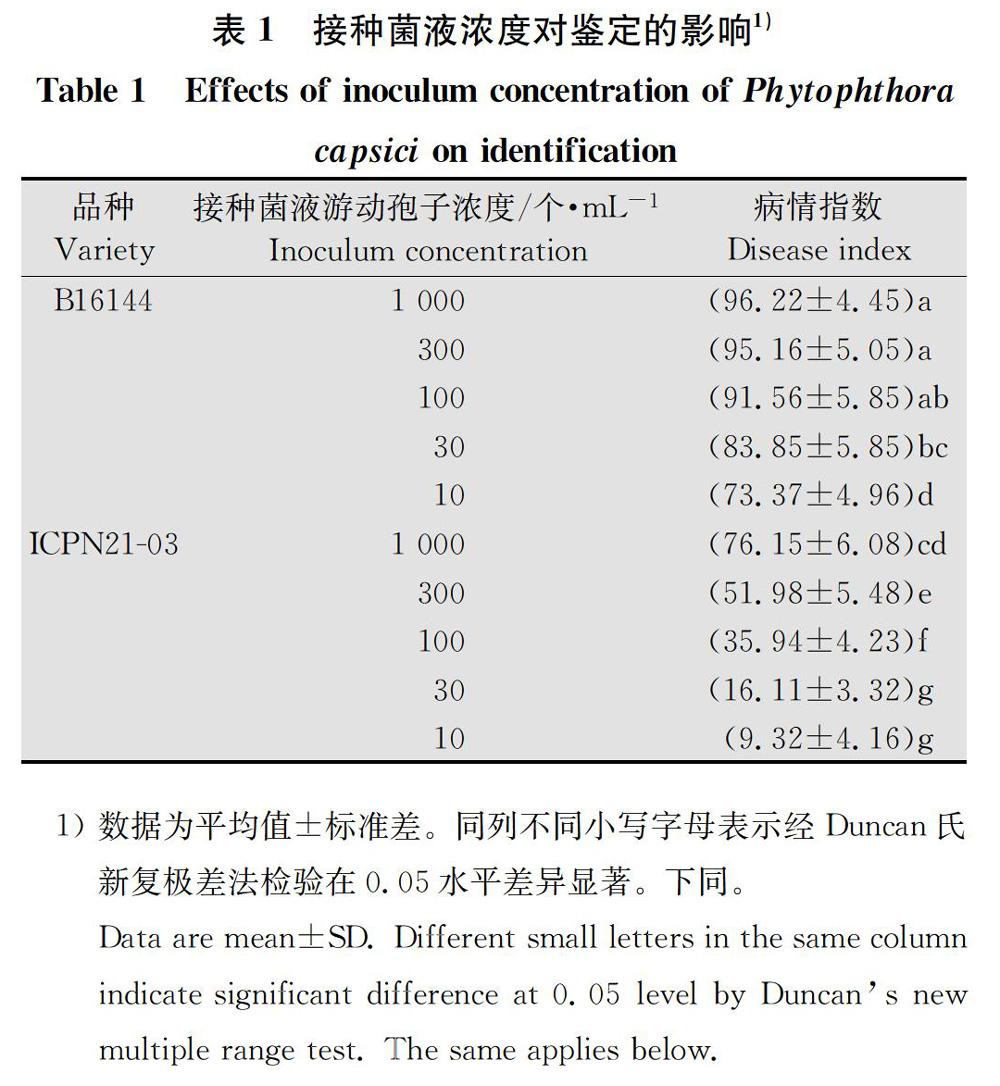
接菌浓度筛选:接菌液游动孢子浓度分别为10、30、100、300、1 000个/mL。在5~6片真叶期接种,接种5 d调查病情。
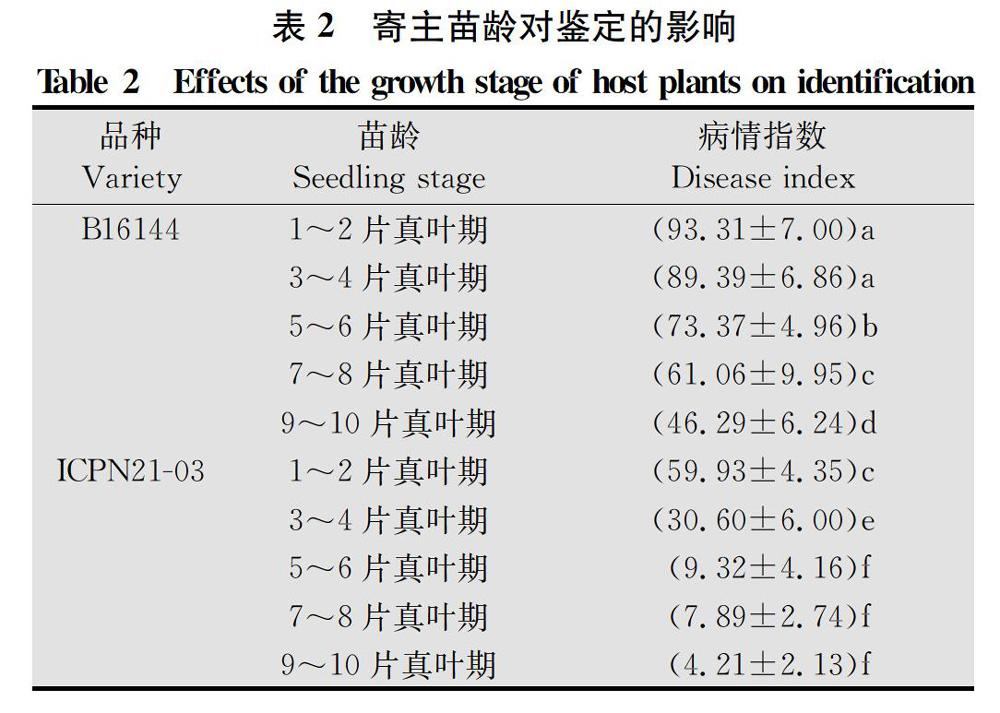
接种时期筛选:分别在辣椒1~2、3~4、5~6、7~8、9~10片真叶期采用浸根法接种。接菌液游动孢子浓度为10个/mL,接种5 d调查病情。
调查时间筛选:分别浸根3、5、7、9 d调查病情。接种时期为5~6片真叶期,接菌游动孢子浓度为10个/mL。
不同接种方法比较:灌根接种法参考谭清群等[5]的方法,接种后第7 天第1次调查,接种后第14 天第2次调查。果实接种法参考赫卫等[10]的方法,接种后第3 天第1次调查,接种后第5 天第2次调查。
1.4 调查标准
幼苗病情级别分为6级(图1),其相应的调查标准如下:0级,无症状;1级,幼苗根茎部轻微水浸状病斑,叶片不萎蔫或可恢复性萎蔫;2级,幼苗根茎部水浸状病斑直径2~3 cm,叶片不可恢复性萎蔫,下部叶片偶有脱落;3级,幼苗根茎部水浸状病斑直径超过3 cm,叶片明显萎蔫或落叶明显;4级,幼苗根茎部水浸状病斑大面积蔓延,除生长点外全部落叶或植株萎蔫;5级,植株枯死。
疫病抗性评价标准:免疫(I),病情指数=0;高抗(HR),0<病情指数≤10;抗病(R),10<病情指数≤30;中抗(MR),30<病情指数≤50;感病(S),50<病情指数≤70;高感(HS),病情指数>70。
2 结果与分析
2.1 接菌浓度的选择
辣椒苗期疫病发病率及病情指数随着接种菌液浓度的增大而显著升高(表1,图2)。在较高接种菌液游动孢子浓度为1 000、300个/mL和100個/mL时,抗病品种的病情指数分别为76.15、51.98和3594,发病过重,抗性材料变为感病或中抗,不能真实反映品种的抗性水平。感病品种病情指数在3个浓度下无显著差异,发病均很重。在接种菌液游动孢子浓度为30个/mL或10个/mL时,抗病品种的病情指数分别为16.11和9.32,感病品种的病情指数分别为8385和73.37,能够真实反映材料本身的抗病性,且抗病品种与感病品种的病情指数差异显著,能明显区分抗感品种,而接种菌液游动孢子浓度在10个/mL时,用菌量更少。因此在苗期人工接种鉴定中,适宜的接种菌液游动孢子浓度确定为10个/mL。
2.2 接种寄主苗龄对鉴定效果的影响
接种寄主的苗龄对疫病接种效果影响较大(表2,图2),随着苗龄的增长,植株的抗病力增强,发病延迟。1~2、3~4、5~6、7~8、9~10片真叶期接种的病情指数差异显著;其中5~6片真叶期接种的抗感病品种的病情指数分别为9.32和73.37,病情指数大小适中,真实反映了材料本身的抗病性。1~2片真叶期接种的抗感病品种明显萎蔫或枯死,其对照水处理出现茎基部腐烂的症状,干扰了病情指数调查。出现这种情况可能是苗龄过小,茎基部没有木质化,经受不住多天的液体浸泡。1~2、3~4片真叶期接种的抗病品种的病情指数分别为59.93和3060,7~8、9~10片真叶期接种的感病品种病情指数分别为61.06和4629,不能反映材料的真实抗性水平。在7~8、9~10片真叶期,苗龄过大,植株抵抗病害的能力较强,侵染进程和发病时间较长。此外,9~10片真叶期苗龄过大,有向生殖生长转变的趋势。因此最佳接种苗龄为5~6片真叶期。
2.3 病情调查时期的选择
试验结果表明,在游动孢子悬浮液浓度10个/mL处理下,辣椒幼苗疫病发病率及病情指数随着处理时间的延长而升高,各处理间差异显著(表3,图2)。接种3 d后,感病品种叶片多为可恢复性萎蔫,病情指数为27.76,发病太轻,不能真实地反映品种的抗性水平。接种7 d后,抗病品种的植株为可恢复性或不可恢复性萎蔫,病情指数为31.84,感病品种的植株呈明显萎蔫或枯死的状态,发病重,不能真实反映品种的抗性水平。接种9 d后,抗感病品种都表现为明显萎蔫或枯死,发病过重。接种5 d后,不萎蔫、可恢复性萎蔫、不可恢复性萎蔫、落叶明显、枯死的植株并存,抗病品种与感病品种的病情指数分别为9.32和73.37,差异显著,易区分抗感品种,能真实地反映品种的抗性水平。因此适宜的病情调查时期为接种第5天。
2.4 不同接种方法的比较
采用3种方法接种均可以有效区分抗感病品种,抗病品种‘ICPN21-03和感病品种‘B16144的病情指数差异显著(表4)。比较3种接种方法,发病最快且严重的为果实接种法,接种第3天即表现为菌丝扩散,出现水浸状病斑,抗病品种‘ICPN21-03的病情指数为19.70,显著高于浸根法的9.32(5 d)和灌根法的8.21(7 d)。
果实接种法发病重于其他两种方法。第一次调查时,浸根法(5 d)的抗病品种和感病品种的病情指数分别与灌根法(7 d)无显著差异,与鉴定寄主抗感情况一致,但抗、感病品种的发病率(40.76%和100%)显著高于灌根法(22.82%和84.38%),发病整齐度更好。第二次调查时,浸根法(7 d)的抗病品种的病情指数显著高于灌根法(14 d)。说明浸根法可用于疫病鉴定,具有发病快、发病整齐的特点。
2.5 辣椒种质资源的抗病性鉴定
采用浸根法对辣椒品种的疫病抗性进行分级,不同品种呈现抗性明显不同。根据病情指数与抗病性的关系对37个品种进行鉴定(表5),其中鉴定为高抗(HR)的仅2个品种,抗病(R)品种11个,中抗(MR)品种6个,感病(S)品种12个,高感品种(HS)6个。说明采用浸根法可以将不同辣椒品种进行很好的抗性水平分级。
3 结论与讨论
本试验建立了一种适合辣椒疫病的苗期抗性鉴定方法,即在苗龄为5~6片真叶期时采用浸根法接种,接种游动孢子悬浮液浓度为10个/mL,接种5 d后调查发病率和病情指数。利用辣椒品种对建立的鉴定方法进行了验证,该苗期抗性鉴定方法可很好地对辣椒品种进行抗性水平分级鉴定,表明该方法可用于辣椒抗性材料的筛选。本研究采用6级分级标准,与灌根法采用的分级标准大体一致。灌根法在接种试验中应用比较多,但该方法接种菌液浓度高,对菌液的需求量大,而研究者采用固体培养基培养疫霉[5-6],疫霉大量扩繁困难,工作量大。本研究通过不同菌液浓度对辣椒疫病抗性鉴定的影响试验,证明游动孢子悬浮液仅仅10个/mL的浓度就可以达到辣椒疫病浸根法接种的浓度需求,能够真实反映辣椒幼苗本身的抗性,与灌根法接种疫霉游动孢子浓度1 000个/mL相比,菌浓度大大降低,不需要大量扩繁疫霉。浸根法接种寄主苗龄为5~6片真叶期,与灌根法的第6片真叶展平期相近。本研究发现,辣椒1~10叶期接种均能发病,但接种苗龄越大,植株本身的抗病性越强,疫病发生时间也随之推迟。果实接种法是离体接种,要求严格控制湿度,灌根法在接种期间要适时浇水,保持土壤湿度近饱和状态。浸根法根部直接暴露在菌液中,没有土壤环境的干扰,利于发病,且不需要控制湿度。与灌根法和果实接种法相比,本研究建立的接种方法具有菌需求量小,需求空间小,对接种环境要求小,鉴定时间短等优点,适于大批量种质资源的筛选。本研究可为辣椒抗病育种工作提供技术支持。
参考文獻
[1] ZHU Chunyuan, YANG Xiaoyan, L Rongfei, et al. Phytophthora capsici homologue of the cell cycle regulator SDA1 is required for sporangial morphology, mycelial growth and plant infection [J]. Molecular Plant Pathology, 2016, 17(3): 369-387.
[2] ZHANG Huaixia, ALI M, FENG Xiaohui, et al. A novel transcription factor CaSBP12 gene negatively regulates the defense response against Phytophthora capsici in pepper (Capsicum annuum L.) [J/OL]. International Journal of Molecular Sciences, 2019, 20(1):48. DOI:10.3390/ijms20010048.
[3] TIAN Yuee, SUN Di, YANG Jinming, et al. Synthesis of sulfonate derivatives of maltol and their biological activity against Phytophthora capsici and Bursaphelenchus xylophilus in vitro [J]. Journal of Asian Natural Products Research, 2020,22(6):578-587.
[4] WANG Qiujun, MA Yan, YANG Hao, et al. Effect of biofumigation and chemical fumigation on soil microbial community structure and control of pepper phytophthora blight [J]. World Journal of Microbiology and Biotechnology, 2014, 30(2):507-518.
[5] 谭清群, 袁洁, 杨学辉, 等. 贵州省辣椒新品种对疫病和青枯病的抗性鉴定研究[J]. 种子, 2014, 33(11):82-85.
[6] 关天舒, 刘长远, 王丽萍, 等. 辣椒抗疫病材料的筛选[J]. 江西农业学报, 2011, 23(11):100-102.
[7] NAEGELE R P, TOMLINSON A J, HAUSBECK M K. Evaluation of a diverse, worldwide collection of wild, cultivated, and landrace pepper (Capsicum annuum) for resistance to phytophthora fruit rot, genetic diversity, and population structure [J]. Phytopathology, 2015, 105(1): 110-118.
[8] LIU W Y, KANG J H, JEONG H S, et al. Combined use of bulked segregant analysis and microarrays reveals SNP markers pinpointing a major QTL for resistance to Phytophthora capsici in pepper [J]. Theoretical and Applied Genetics, 2014, 127(11): 2503-2513.
[9] YU J, SHEN D, DAI T, et al. Rapid and equipment-free detection of Phytophthora capsici using lateral flow strip-based recombinase polymerase amplification assay [J]. Letters in Applied Microbiology, 2019, 69(1): 64-70.
[10]赫卫, 张慧, 王莹. 辣椒对疫霉抗性的快速鉴定[J]. 植物保护, 2018, 44(2): 145-148.
(责任编辑:杨明丽)
